沪教版九年级上册化学 5.2 金属矿物 铁的治练 课件(25张PPT)
文档属性
| 名称 | 沪教版九年级上册化学 5.2 金属矿物 铁的治练 课件(25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-16 09:40:30 | ||
图片预览








文档简介
课件25张PPT。金属矿物 铁的冶炼目标达成1.知道自然界中金属的分布形式
2.了解从铁矿石中将铁还原出来的方法
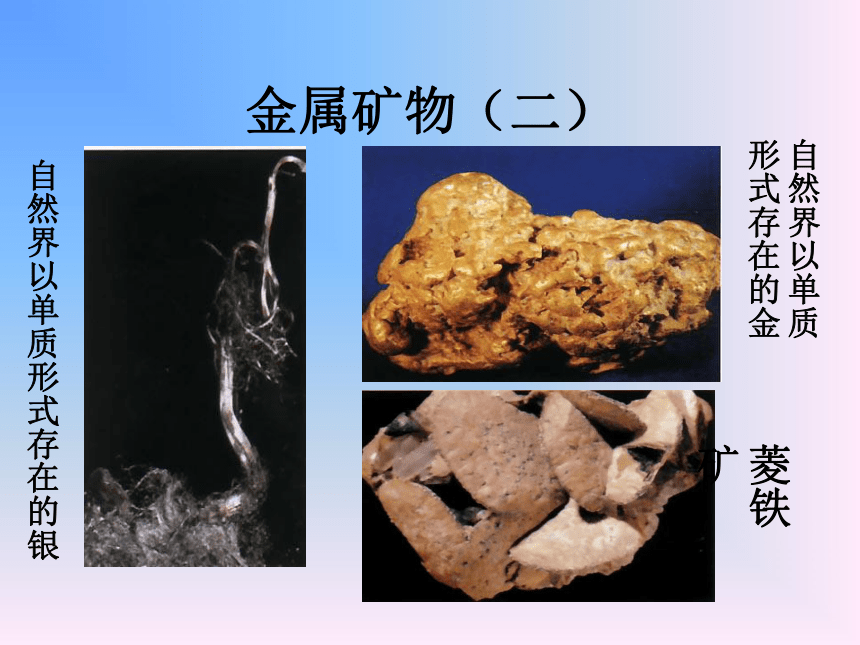
3.知道生铁和钢的区别,简单区分炼钢和炼铁的原理一、常见的金属矿物金属矿物(一)孔雀石铝土矿黄铜矿金属矿物(二)自然界以单质形式存在的银自然界以单质形式存在的金菱铁矿金属矿物金属元素在自然界中除极少数不活泼的金
属(如金,银,铂等)以单质存在。其余
金属元素都以化合物形式存在矿石中。
铁矿石主要有赤铁矿(主要成分Fe2O3 ),
磁铁矿(主要成分Fe3O4
铜,铝的矿石见书P123讨论 在生产和日常
生活中应用最广泛
的金属是什么?你
对它还有什么了解? 地壳中铁的含量怎么样?在自然界中主要以化合物形式还是单质的形式存在?想一想想一想: 假如你是炼铁厂的厂长,你认为哪种矿石最不适宜作为工业炼铁的原料? 70%72.4%48.3%46.7% Fe2O3和Fe的组成上均含有Fe元素,不同之处在于Fe少了O元素,要使Fe2O3转变成Fe ,可从哪些方面入手?交流与讨论(1)可在一定条件下,使Fe2O3直接失氧,转变成铁;
(2)可加入某类物质,让其与Fe2O3中的O元素结合,主动夺取Fe2O3中的“O”元素,使Fe2O3转变成金属Fe。 金属铁的冶炼,是把它们的矿物跟易得氧的物质一起加热反应,以夺氧的方式还原铁的氧化物。通常使用的还原剂是CO。以赤铁矿为例,其化学方程式为:
3CO+Fe2O3==2Fe+3CO2高温小结观察与思考:1、澄清石灰水的作用是什么?实验中会出现什么现象? 2、尾气如何处理?
3、实验中为什么要先通一段时间CO,再加热Fe2O3? 4、实验结束前应如何操作?
5、如何验证实验中产生了铁?(1)检查装置的气密性;
(2)装入药品并固定;
(3)向玻璃管内通入一氧化碳气体;
(4)给氧化铁加热;
(5)停止加热;
(6)待试管冷却后停止通一氧化碳。实验步骤(CO:早到迟退
酒精灯:迟到早退)澄清石灰水 1、红棕色的固体逐渐变成黑色 ,且黑色固体能被磁铁吸引;
2、澄清的石灰水变浑浊。
实验现象化学方程式3CO+Fe2O3===2Fe+3CO2
CO2+Ca(OH)2===CaCO3 +H2O高温注意1、实验中先通一段时间CO,再加热Fe2O3的目的:
2、实验完毕后继续通一氧化碳的目的
3、尾气的成分中含有CO,必须加以处理,方法有
排出装置内的空气,以免加热时CO与空气混合,可能会发生爆炸。
防止石灰水倒吸;
防止生成的铁重新被氧化。
(1)用气球收集;
(2)点燃;
(3)用排水法收集;
(4)采用绿色化学理念利用。 工业炼铁的主要设备、原料、原理、还原剂各是什么?各原料的作用又是如何的呢? 交流与讨论2、炼铁的原料:(1)铁矿石:
(2)焦 炭:
(3)石灰石:
(4)空 气:
d提供铁 元素
a、提供热源、维持炉温
b、制还原剂
制造炉渣
提供氧气
将铁矿石中的 SiO2转变为炉渣(Fe2O3)生铁出铁口炉渣出渣口高炉气体高炉气体① 产生一氧化碳
② 提供热量3、炼铁的原理:在高温条件下,用还原剂一氧化碳从铁的
氧化物中将铁还原出来。
4、炼钢的原理:在高温条件下,利用氧气降低生铁中碳的
含量,除掉硫、磷等有害元素
1.许多金属的冶炼,是把它们的矿物跟焦炭或氢气、一氧化碳等物质一起加热反应。(如锰、锌、铁、镍、铅等)
2.有些金属很难从其矿物中提取出来,需用电解的方法。(如铝等)
指导阅读:课本P125“拓展视野”2Al2O3===4Al+3O2通电几种金属的冶炼方法拓展视野1、工业炼铁的原理:
3CO+Fe2O3====2Fe+3CO2
2、工业炼铁的原料:
铁矿石、焦炭、石灰石、空气
3、工业炼铁的设备:高炉
高温我今天知道了:1、工业炼铁中的还原剂是( )
A、C B、CO C、Fe2O3 D、Fe
2、炼铁的原料是( )
A、铁矿石、一氧化碳、空气
B、铁矿石、烟煤、生石灰
C、铁矿石、焦炭、空气
D、铁矿石、焦炭、石灰石、空气练习与实践BD3、某同学改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热,再通入一氧化碳可能产生的后果是 。
(2)写出A中发生反应的化学方程式 .
(3)B装置中产生的现象可判断反应
是否开始发生,B试剂是 。
(4)C装置的作用是 。
(5)C装置收集气体的方法叫 。
练习与实践Fe2O3COABC发生爆炸高温3CO+Fe2O3==2Fe+3CO2澄清石灰水收集未反应的CO,防止污染空气排水法
2.了解从铁矿石中将铁还原出来的方法
3.知道生铁和钢的区别,简单区分炼钢和炼铁的原理一、常见的金属矿物金属矿物(一)孔雀石铝土矿黄铜矿金属矿物(二)自然界以单质形式存在的银自然界以单质形式存在的金菱铁矿金属矿物金属元素在自然界中除极少数不活泼的金
属(如金,银,铂等)以单质存在。其余
金属元素都以化合物形式存在矿石中。
铁矿石主要有赤铁矿(主要成分Fe2O3 ),
磁铁矿(主要成分Fe3O4
铜,铝的矿石见书P123讨论 在生产和日常
生活中应用最广泛
的金属是什么?你
对它还有什么了解? 地壳中铁的含量怎么样?在自然界中主要以化合物形式还是单质的形式存在?想一想想一想: 假如你是炼铁厂的厂长,你认为哪种矿石最不适宜作为工业炼铁的原料? 70%72.4%48.3%46.7% Fe2O3和Fe的组成上均含有Fe元素,不同之处在于Fe少了O元素,要使Fe2O3转变成Fe ,可从哪些方面入手?交流与讨论(1)可在一定条件下,使Fe2O3直接失氧,转变成铁;
(2)可加入某类物质,让其与Fe2O3中的O元素结合,主动夺取Fe2O3中的“O”元素,使Fe2O3转变成金属Fe。 金属铁的冶炼,是把它们的矿物跟易得氧的物质一起加热反应,以夺氧的方式还原铁的氧化物。通常使用的还原剂是CO。以赤铁矿为例,其化学方程式为:
3CO+Fe2O3==2Fe+3CO2高温小结观察与思考:1、澄清石灰水的作用是什么?实验中会出现什么现象? 2、尾气如何处理?
3、实验中为什么要先通一段时间CO,再加热Fe2O3? 4、实验结束前应如何操作?
5、如何验证实验中产生了铁?(1)检查装置的气密性;
(2)装入药品并固定;
(3)向玻璃管内通入一氧化碳气体;
(4)给氧化铁加热;
(5)停止加热;
(6)待试管冷却后停止通一氧化碳。实验步骤(CO:早到迟退
酒精灯:迟到早退)澄清石灰水 1、红棕色的固体逐渐变成黑色 ,且黑色固体能被磁铁吸引;
2、澄清的石灰水变浑浊。
实验现象化学方程式3CO+Fe2O3===2Fe+3CO2
CO2+Ca(OH)2===CaCO3 +H2O高温注意1、实验中先通一段时间CO,再加热Fe2O3的目的:
2、实验完毕后继续通一氧化碳的目的
3、尾气的成分中含有CO,必须加以处理,方法有
排出装置内的空气,以免加热时CO与空气混合,可能会发生爆炸。
防止石灰水倒吸;
防止生成的铁重新被氧化。
(1)用气球收集;
(2)点燃;
(3)用排水法收集;
(4)采用绿色化学理念利用。 工业炼铁的主要设备、原料、原理、还原剂各是什么?各原料的作用又是如何的呢? 交流与讨论2、炼铁的原料:(1)铁矿石:
(2)焦 炭:
(3)石灰石:
(4)空 气:
d提供铁 元素
a、提供热源、维持炉温
b、制还原剂
制造炉渣
提供氧气
将铁矿石中的 SiO2转变为炉渣(Fe2O3)生铁出铁口炉渣出渣口高炉气体高炉气体① 产生一氧化碳
② 提供热量3、炼铁的原理:在高温条件下,用还原剂一氧化碳从铁的
氧化物中将铁还原出来。
4、炼钢的原理:在高温条件下,利用氧气降低生铁中碳的
含量,除掉硫、磷等有害元素
1.许多金属的冶炼,是把它们的矿物跟焦炭或氢气、一氧化碳等物质一起加热反应。(如锰、锌、铁、镍、铅等)
2.有些金属很难从其矿物中提取出来,需用电解的方法。(如铝等)
指导阅读:课本P125“拓展视野”2Al2O3===4Al+3O2通电几种金属的冶炼方法拓展视野1、工业炼铁的原理:
3CO+Fe2O3====2Fe+3CO2
2、工业炼铁的原料:
铁矿石、焦炭、石灰石、空气
3、工业炼铁的设备:高炉
高温我今天知道了:1、工业炼铁中的还原剂是( )
A、C B、CO C、Fe2O3 D、Fe
2、炼铁的原料是( )
A、铁矿石、一氧化碳、空气
B、铁矿石、烟煤、生石灰
C、铁矿石、焦炭、空气
D、铁矿石、焦炭、石灰石、空气练习与实践BD3、某同学改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热,再通入一氧化碳可能产生的后果是 。
(2)写出A中发生反应的化学方程式 .
(3)B装置中产生的现象可判断反应
是否开始发生,B试剂是 。
(4)C装置的作用是 。
(5)C装置收集气体的方法叫 。
练习与实践Fe2O3COABC发生爆炸高温3CO+Fe2O3==2Fe+3CO2澄清石灰水收集未反应的CO,防止污染空气排水法
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
