沪教版九年级上册化学 4.2 化学反应中的质量关系 课件(35张PPT)
文档属性
| 名称 | 沪教版九年级上册化学 4.2 化学反应中的质量关系 课件(35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 646.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-18 09:04:46 | ||
图片预览








文档简介
课件35张PPT。
4.2化学反应中的质量关系
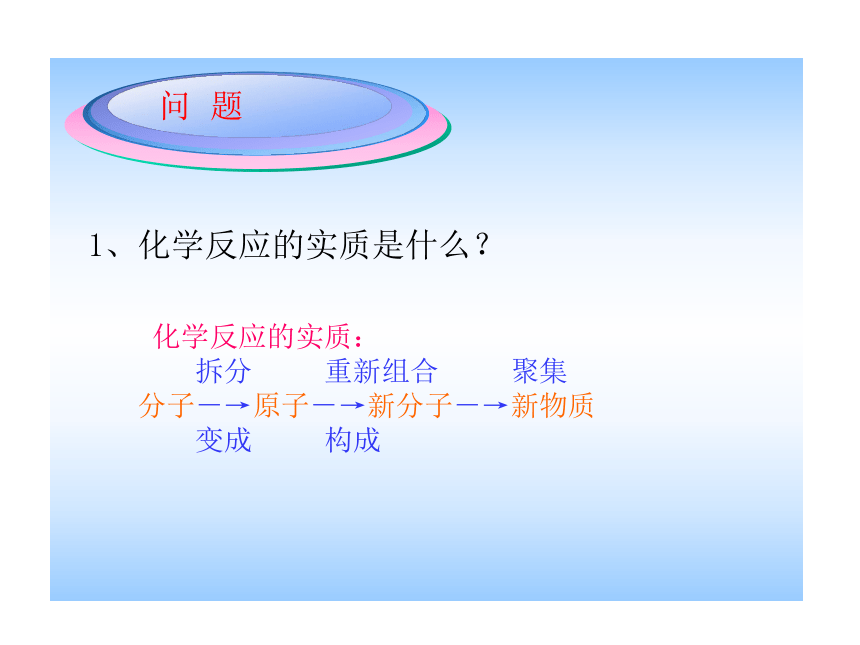
质量守恒定律反应后反应前1、化学反应的实质是什么? 化学反应的实质:
拆分 重新组合 聚集
分子-→原子-→新分子-→新物质
变成 构成 2、怎样判断化学反应已经发生? 化学变化发生时,一定有新物质生成,还会伴随着能量的释放或吸收,有时还会发生颜色变化、或生成沉淀、产生气体等现象。那么,在化学变化中物质的质量发生变化吗?思考这些物质:火柴、酒精燃烧最后留下什么?铜片在火焰上加热呢?○火柴燃烧最后剩下灰烬
○酒精充分燃烧最后连灰烬都没有留下
化学变化中物质质量变小了吗?○铜片加热表面变黑,质量变大。
化学变化中物质质量变大了吗?猜想一下物质发生化学变化前后,总质量是增加、减小、还是不变?对物质变化要进行定量研究提出问题:物质发生变化前后,总质量是否发生改变?现在就让我们一起来按下面的步骤对这一问题进行探究吧!1. 猜想与假设:(物质发生化学变化后,其总质量会怎样?)
假设的根据是:
2. 设计实验方案验证
3. 进行实验探究活动
4. 得出结论
带着这4点我们来进行实验探究……白磷的燃烧铁和硫酸铜反应 ⑴在烧杯中放入蓝色硫酸铜溶液,小试管中放入氢氧化钠溶液;
⑵称量烧杯内物质的总质量;
⑶倾斜烧杯,使二者反应,观察现象:
⑷称量烧杯内物质的总质量。演示实验1:氢氧化钠溶液跟硫酸铜溶液反应前后质量的测定 M1 = M2产生的现象为:产生蓝色沉淀;溶液的蓝色逐渐变浅;
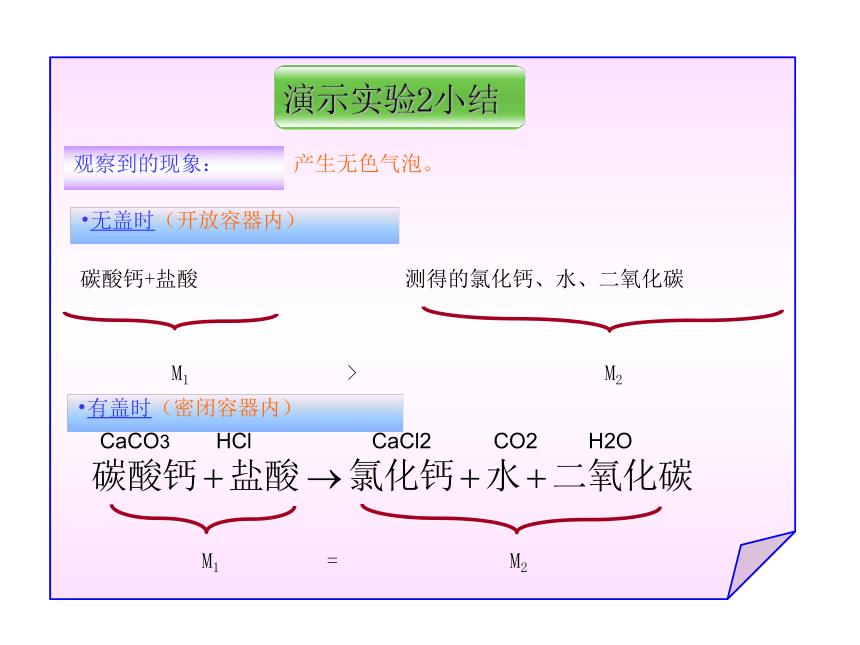
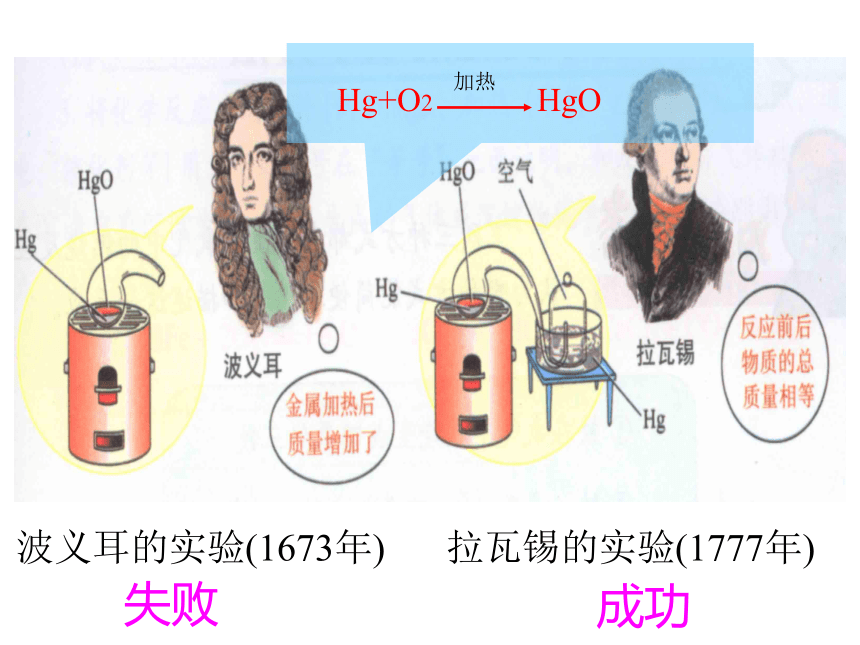
且天平仍然保持平衡 结论:反应前后,参加反应的物质总质量相等CuSO4 NaOH Na2SO4 Cu(OH)2 (蓝色溶液 ) (蓝色沉淀)CuSO4 + NaOH = Cu(OH ) 2↓ + Na2SO4盐酸和碳酸钠反应镁条的燃烧有盖时(密闭容器内)观察到的现象:产生无色气泡。无盖时(开放容器内)波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功质量守恒定律生成的各物质的质量总和 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。参加反应的各物质的质量总和参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。质量守恒定律的内容知识小结:在验证质量守恒定律时,如果有气体参加或者生成时,实验装置必须 。切记:科学实验一定要严密!密封。切记:科学实验一定要严密!知识小结:在验证质量守恒定律时,如果有气体参加或者生成时,实验装置必须 。切记:科学实验一定要严密!2、“总和”意味着把各种状态的反应物或生成物都算在内。如肉眼看不见的气体也应考虑。1、“参加”意味着反应物中过量部分的物质质量不应算在内。如蜡烛燃烧剩余的石蜡不算在内。3、质量守恒定律仅适用于化学变化。4、质量守恒定律只适合于质量守恒,而不是体积守恒.对守恒定律的深入理解下列现象符合质量守恒定律是 ( )
A.100g水受热变成100g水蒸气
B.50mL水加入50mL酒精,总体积小于100mL
C.铁丝在氧气中完全燃烧后生成物的质量大于铁丝质量
D.纸在空气中燃烧后化为灰烬,灰烬质量比纸的质量小
E.10g过氧化氢溶液与1g二氧化锰,待充分反应 后提纯得到1g二氧化锰。
C D1.某同学定量研究化学反应时发现:木炭燃烧后质量减小了,而铁钉生锈后质量增加了。请你分析下这些反应是否遵守质量守恒定律?1.木炭燃烧是因为
生成物二氧化碳是一种气体跑到空气中去了,所以质量减少了。2.铁钉之所以会生锈是因为铁与空气中的氧气发生了缓慢氧化,所以最后生成的铁锈的质量不仅包括铁的质量还包括参加反应的氧气的质量
2.为什么“参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和”呢? 你能用物质由微粒构成的观点对质量守恒定律作出解释吗?请以金属镁和氧气的反应为例说明。 Mg O2 Mg O 化学反应是反应物的原子重新组合转变成生成物的过程 2 Mg+O22Mg O点燃原子数:氧原子:2
镁原子:2氧原子:2
镁原子:2相对质量:24×2+16×2=802×(24 +16 )=80参加反应的各物质质量总和反应生成的各物质质量总和化学反应前后原子数目、原子种类原子数目、原子种类都没有改变原子的种类没有改变
原子的数目没有增减
原子的质量没有变化质量守恒的原因?通电通电拆成重新组合元素种类变了吗?元素质量变了吗?分子数目变了吗?化学反应前后物质种类呢?分子种类呢?动脑筋不变改变可能改变走进微观COH++=总结:在化学反应前后,原子的 , , 都不变。走向宏观即可得出:在化学反应前后,元素的 , 都不变,故参加反应的物质的总质量也不变。原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目化学变化的本质:元素化合价质量守恒定律适用于一切化学反应1. 进行有关的计算 2. 推测一些物质的组成 3. 解释一些实验事实我们可以运用该定律: 1、在反应A+B=C+D中,已知2gA和5gB参加了反应,生成
了4gC,则有____gD生成。 三.质量守恒定律的简单应用32、 将24.5g氯酸钾加热至完全分解,得到固体质量
14.9g,则产生气体 g。
3、加热10g氯酸钾和二氧化锰的混合物,反应后称得残留
物的质量总和为9.52g,则生成氧气的质量为 g9.60.484、已知石蜡是蜡烛的主要成分,蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有__ _元素。C、HO5、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、X2Y4B6.镁带在密闭的容器中加热,其总质量与时间的关系正确的
是 ( )B7.双氧水和二氧化锰的混合物共a g,完全反应后得 到b g氧气和c g水,则混合物中二氧化锰的质量 为( ) A.(a+b-c)g B.(a-b-c)g C.(a+b+c)g D.(a-c)g 8.有A物质36g,在一定条件下完全分解生成4g B气体和气 体C,这些C气体在一定条件下与一定量的D恰好完全化合,生成44g E,则参加反应的D的质量为( ) A.12g B.10g C .16g D.21gBA点燃2∶1∶210.在一定密闭容器内有X、Y、Z、Q四种物质,在一
定条件下充分反应后,测得反应前后各物质的
质量如下求反应后X的质量____,该反应属于______反应.55分解
拆分 重新组合 聚集
分子-→原子-→新分子-→新物质
变成 构成 2、怎样判断化学反应已经发生? 化学变化发生时,一定有新物质生成,还会伴随着能量的释放或吸收,有时还会发生颜色变化、或生成沉淀、产生气体等现象。那么,在化学变化中物质的质量发生变化吗?思考这些物质:火柴、酒精燃烧最后留下什么?铜片在火焰上加热呢?○火柴燃烧最后剩下灰烬
○酒精充分燃烧最后连灰烬都没有留下
化学变化中物质质量变小了吗?○铜片加热表面变黑,质量变大。
化学变化中物质质量变大了吗?猜想一下物质发生化学变化前后,总质量是增加、减小、还是不变?对物质变化要进行定量研究提出问题:物质发生变化前后,总质量是否发生改变?现在就让我们一起来按下面的步骤对这一问题进行探究吧!1. 猜想与假设:(物质发生化学变化后,其总质量会怎样?)
假设的根据是:
2. 设计实验方案验证
3. 进行实验探究活动
4. 得出结论
带着这4点我们来进行实验探究……白磷的燃烧铁和硫酸铜反应 ⑴在烧杯中放入蓝色硫酸铜溶液,小试管中放入氢氧化钠溶液;
⑵称量烧杯内物质的总质量;
⑶倾斜烧杯,使二者反应,观察现象:
⑷称量烧杯内物质的总质量。演示实验1:氢氧化钠溶液跟硫酸铜溶液反应前后质量的测定 M1 = M2产生的现象为:产生蓝色沉淀;溶液的蓝色逐渐变浅;
且天平仍然保持平衡 结论:反应前后,参加反应的物质总质量相等CuSO4 NaOH Na2SO4 Cu(OH)2 (蓝色溶液 ) (蓝色沉淀)CuSO4 + NaOH = Cu(OH ) 2↓ + Na2SO4盐酸和碳酸钠反应镁条的燃烧有盖时(密闭容器内)观察到的现象:产生无色气泡。无盖时(开放容器内)波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功质量守恒定律生成的各物质的质量总和 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。参加反应的各物质的质量总和参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。质量守恒定律的内容知识小结:在验证质量守恒定律时,如果有气体参加或者生成时,实验装置必须 。切记:科学实验一定要严密!密封。切记:科学实验一定要严密!知识小结:在验证质量守恒定律时,如果有气体参加或者生成时,实验装置必须 。切记:科学实验一定要严密!2、“总和”意味着把各种状态的反应物或生成物都算在内。如肉眼看不见的气体也应考虑。1、“参加”意味着反应物中过量部分的物质质量不应算在内。如蜡烛燃烧剩余的石蜡不算在内。3、质量守恒定律仅适用于化学变化。4、质量守恒定律只适合于质量守恒,而不是体积守恒.对守恒定律的深入理解下列现象符合质量守恒定律是 ( )
A.100g水受热变成100g水蒸气
B.50mL水加入50mL酒精,总体积小于100mL
C.铁丝在氧气中完全燃烧后生成物的质量大于铁丝质量
D.纸在空气中燃烧后化为灰烬,灰烬质量比纸的质量小
E.10g过氧化氢溶液与1g二氧化锰,待充分反应 后提纯得到1g二氧化锰。
C D1.某同学定量研究化学反应时发现:木炭燃烧后质量减小了,而铁钉生锈后质量增加了。请你分析下这些反应是否遵守质量守恒定律?1.木炭燃烧是因为
生成物二氧化碳是一种气体跑到空气中去了,所以质量减少了。2.铁钉之所以会生锈是因为铁与空气中的氧气发生了缓慢氧化,所以最后生成的铁锈的质量不仅包括铁的质量还包括参加反应的氧气的质量
2.为什么“参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和”呢? 你能用物质由微粒构成的观点对质量守恒定律作出解释吗?请以金属镁和氧气的反应为例说明。 Mg O2 Mg O 化学反应是反应物的原子重新组合转变成生成物的过程 2 Mg+O22Mg O点燃原子数:氧原子:2
镁原子:2氧原子:2
镁原子:2相对质量:24×2+16×2=802×(24 +16 )=80参加反应的各物质质量总和反应生成的各物质质量总和化学反应前后原子数目、原子种类原子数目、原子种类都没有改变原子的种类没有改变
原子的数目没有增减
原子的质量没有变化质量守恒的原因?通电通电拆成重新组合元素种类变了吗?元素质量变了吗?分子数目变了吗?化学反应前后物质种类呢?分子种类呢?动脑筋不变改变可能改变走进微观COH++=总结:在化学反应前后,原子的 , , 都不变。走向宏观即可得出:在化学反应前后,元素的 , 都不变,故参加反应的物质的总质量也不变。原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目化学变化的本质:元素化合价质量守恒定律适用于一切化学反应1. 进行有关的计算 2. 推测一些物质的组成 3. 解释一些实验事实我们可以运用该定律: 1、在反应A+B=C+D中,已知2gA和5gB参加了反应,生成
了4gC,则有____gD生成。 三.质量守恒定律的简单应用32、 将24.5g氯酸钾加热至完全分解,得到固体质量
14.9g,则产生气体 g。
3、加热10g氯酸钾和二氧化锰的混合物,反应后称得残留
物的质量总和为9.52g,则生成氧气的质量为 g9.60.484、已知石蜡是蜡烛的主要成分,蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有__ _元素。C、HO5、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、X2Y4B6.镁带在密闭的容器中加热,其总质量与时间的关系正确的
是 ( )B7.双氧水和二氧化锰的混合物共a g,完全反应后得 到b g氧气和c g水,则混合物中二氧化锰的质量 为( ) A.(a+b-c)g B.(a-b-c)g C.(a+b+c)g D.(a-c)g 8.有A物质36g,在一定条件下完全分解生成4g B气体和气 体C,这些C气体在一定条件下与一定量的D恰好完全化合,生成44g E,则参加反应的D的质量为( ) A.12g B.10g C .16g D.21gBA点燃2∶1∶210.在一定密闭容器内有X、Y、Z、Q四种物质,在一
定条件下充分反应后,测得反应前后各物质的
质量如下求反应后X的质量____,该反应属于______反应.55分解
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
