沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件(22张PPT)
文档属性
| 名称 | 沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件(22张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-19 10:22:50 | ||
图片预览







文档简介
(共22张PPT)
原子的构成
相对原子质量
学习目标:
1、了解原子的结构。
2、初步了解相对原子质量的概念,学会查找相对原子质量表。
3、学会计算物质的相对分子质量。
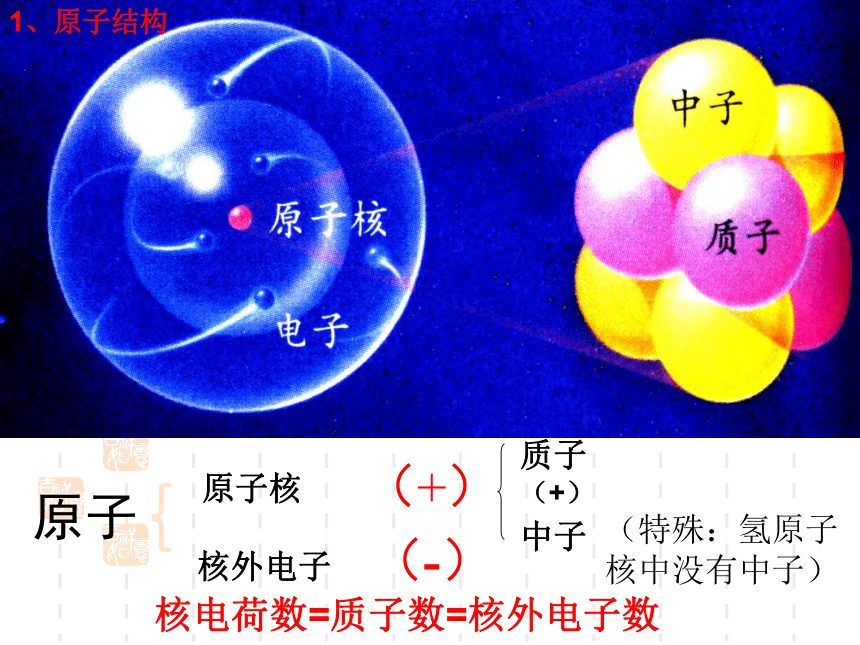
1、原子的结构
原子是化学变化中不能再分的最小的微粒。原子是否就是所有微观微粒中最小的微粒呢?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
原子结构的发现史
1897年,英国科学家汤姆生在原子中
发现了电子。
α粒子散射实验(1909年)
——原子有核
卢瑟福和他的助手做了著名α粒子散射实验。
英国科学家卢瑟福
(E.Rutherford,1871~1937)
科学家是怎样认识原子的
卢瑟福
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带正电荷的粒子)轰击金箔时,发现:
1、大多数α粒子能穿透金箔,而且不改变原来的运动方向;
2、也有一小部分α粒子改变了原来的运动路径;
3、甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。
交流共享一
结合以上实验的3个实验现象,分析原子结构的以下特点:
1.现象1说明了什么?
2.现象2说明了什么?
3.现象3说明了什么?
原子内有很大的空间
这个微粒体积很小、质量很大。
原子内有一个带正电的微粒
原子核
(+)
原子
{
核外电子
(-)
质子(+)
中子
核电荷数=质子数=核外电子数
1、原子结构
(特殊:氢原子核中没有中子)
原子结构动画模拟
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
位于原子中央,体积很小,却集中了几乎原子的全部质量
在核外作高速运动,
质量和体积都很小。
两者电量大小相同,电性相反,因而原子呈电中性。
以一种碳原子(质子数为6,中子数为6的碳原子)的质量的1/12作为基准,其他原子的质量与这个基准的比值。
公式表达式:
Ar(原子)=
m(某原子)
m(某碳原子)×1/12
相对原子质量不是原子的实际质量,是一个比值
相对原子质量的单位是1
注意:
2、相对原子质量:
电子的质量很小,可以忽略不计。原子的质量主要集中在原子核上。
规律:
相对原子质量=质子数+中子数
相对分子质量(Mr):
构成分子的各原子的相对原子质量的总和。
例题:
求出水的相对分子质量
Mr(H2O)=2Ar(H)+Ar(O)=2×1+16=18
阅读P70观察与思考。
检测题:
请你根据课本P75页表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少.
小结:学完本课题你知道什么
二、原子的构成
原子核
核外电子
原子
三、相对原子质量:
原子里:核电荷数=质子数=核外电子数
相对原子质量=质子数+中子数
(带1个单位负电荷)
(不带电)
(带1个单位正电荷)
质子
中子
以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
一、分子、原子都是构成物质的微粒,分子是由原子构成的。在化学变化中,分子可以再分,而原子不可以再分。
1.在 原 子 的 组 成 中,_____带 正 电,
_____带 负 电,_____ 不 带 电。
_____绕 着_______做 高 速 运 动。
_______占 据 原 子 的 绝 大 部 分 体 积。
原子 的 质 量 主 要集 中 在_______上 。
相对原子质量在数值上等于_______和
_______之和
电 子
质 子
中 子
电 子
原 子 核
电 子
原 子 核
课堂反馈
质子数
中子数
2.下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,
核外电子数不同
CD
课堂反馈
5.铁原子的相对原子质量是( )
A 56克 B 56
C 9.288 × 10-26 Kg D 1/56
4. 组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子
B
B
课堂反馈
3.某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
C
6. 铝原子的相对原子质量为27,核电荷数为13,则铝原子有( )个质子和( )个中子构成原子核,核外有( )个电子绕核作高速运动.整个原子不显电性的原因是:
质子和电子所带电量相等,电性相反
13
13
14
课堂反馈
课堂反馈
7.将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是______
(6)原子中数目一定相等的粒子是________
①②
③④⑤
①②④
③
①
③⑤
原子的构成
相对原子质量
学习目标:
1、了解原子的结构。
2、初步了解相对原子质量的概念,学会查找相对原子质量表。
3、学会计算物质的相对分子质量。
1、原子的结构
原子是化学变化中不能再分的最小的微粒。原子是否就是所有微观微粒中最小的微粒呢?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
原子结构的发现史
1897年,英国科学家汤姆生在原子中
发现了电子。
α粒子散射实验(1909年)
——原子有核
卢瑟福和他的助手做了著名α粒子散射实验。
英国科学家卢瑟福
(E.Rutherford,1871~1937)
科学家是怎样认识原子的
卢瑟福
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带正电荷的粒子)轰击金箔时,发现:
1、大多数α粒子能穿透金箔,而且不改变原来的运动方向;
2、也有一小部分α粒子改变了原来的运动路径;
3、甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。
交流共享一
结合以上实验的3个实验现象,分析原子结构的以下特点:
1.现象1说明了什么?
2.现象2说明了什么?
3.现象3说明了什么?
原子内有很大的空间
这个微粒体积很小、质量很大。
原子内有一个带正电的微粒
原子核
(+)
原子
{
核外电子
(-)
质子(+)
中子
核电荷数=质子数=核外电子数
1、原子结构
(特殊:氢原子核中没有中子)
原子结构动画模拟
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
位于原子中央,体积很小,却集中了几乎原子的全部质量
在核外作高速运动,
质量和体积都很小。
两者电量大小相同,电性相反,因而原子呈电中性。
以一种碳原子(质子数为6,中子数为6的碳原子)的质量的1/12作为基准,其他原子的质量与这个基准的比值。
公式表达式:
Ar(原子)=
m(某原子)
m(某碳原子)×1/12
相对原子质量不是原子的实际质量,是一个比值
相对原子质量的单位是1
注意:
2、相对原子质量:
电子的质量很小,可以忽略不计。原子的质量主要集中在原子核上。
规律:
相对原子质量=质子数+中子数
相对分子质量(Mr):
构成分子的各原子的相对原子质量的总和。
例题:
求出水的相对分子质量
Mr(H2O)=2Ar(H)+Ar(O)=2×1+16=18
阅读P70观察与思考。
检测题:
请你根据课本P75页表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少.
小结:学完本课题你知道什么
二、原子的构成
原子核
核外电子
原子
三、相对原子质量:
原子里:核电荷数=质子数=核外电子数
相对原子质量=质子数+中子数
(带1个单位负电荷)
(不带电)
(带1个单位正电荷)
质子
中子
以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
一、分子、原子都是构成物质的微粒,分子是由原子构成的。在化学变化中,分子可以再分,而原子不可以再分。
1.在 原 子 的 组 成 中,_____带 正 电,
_____带 负 电,_____ 不 带 电。
_____绕 着_______做 高 速 运 动。
_______占 据 原 子 的 绝 大 部 分 体 积。
原子 的 质 量 主 要集 中 在_______上 。
相对原子质量在数值上等于_______和
_______之和
电 子
质 子
中 子
电 子
原 子 核
电 子
原 子 核
课堂反馈
质子数
中子数
2.下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,
核外电子数不同
CD
课堂反馈
5.铁原子的相对原子质量是( )
A 56克 B 56
C 9.288 × 10-26 Kg D 1/56
4. 组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子
B
B
课堂反馈
3.某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
C
6. 铝原子的相对原子质量为27,核电荷数为13,则铝原子有( )个质子和( )个中子构成原子核,核外有( )个电子绕核作高速运动.整个原子不显电性的原因是:
质子和电子所带电量相等,电性相反
13
13
14
课堂反馈
课堂反馈
7.将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是______
(6)原子中数目一定相等的粒子是________
①②
③④⑤
①②④
③
①
③⑤
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
