实验活动6 酸、碱的化学性质(35张PPT)
文档属性
| 名称 | 实验活动6 酸、碱的化学性质(35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-23 16:09:54 | ||
图片预览








文档简介
(共35张PPT)
实验活动6 酸、碱的化学性质
第十单元 酸和碱
酸、碱的化学性质
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
1
知识点
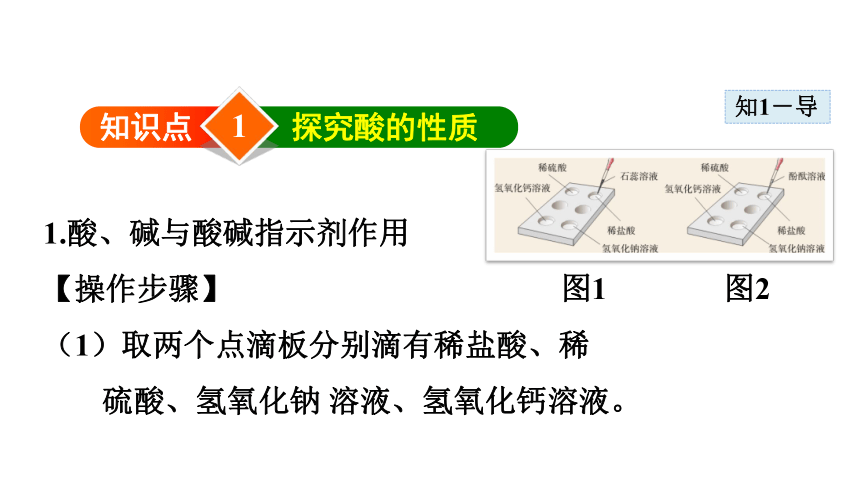
探究酸的性质
1.酸、碱与酸碱指示剂作用
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
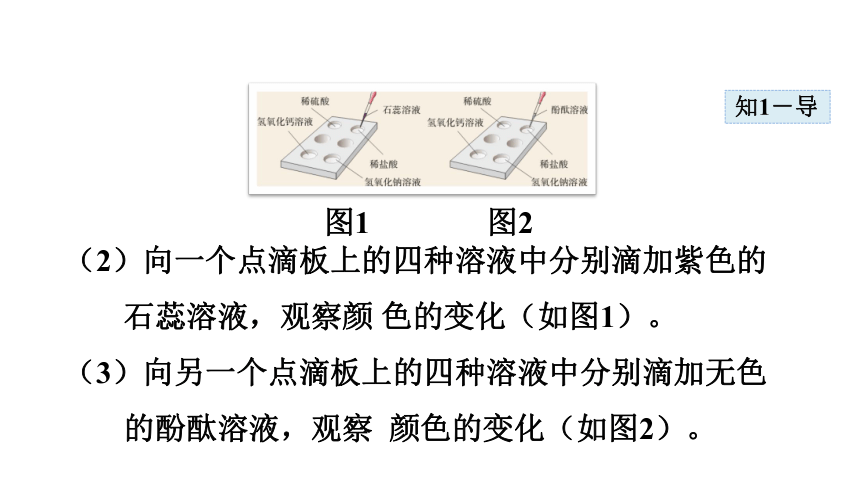
图1 图2
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜 色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察 颜色的变化(如图2)。
图1 图2
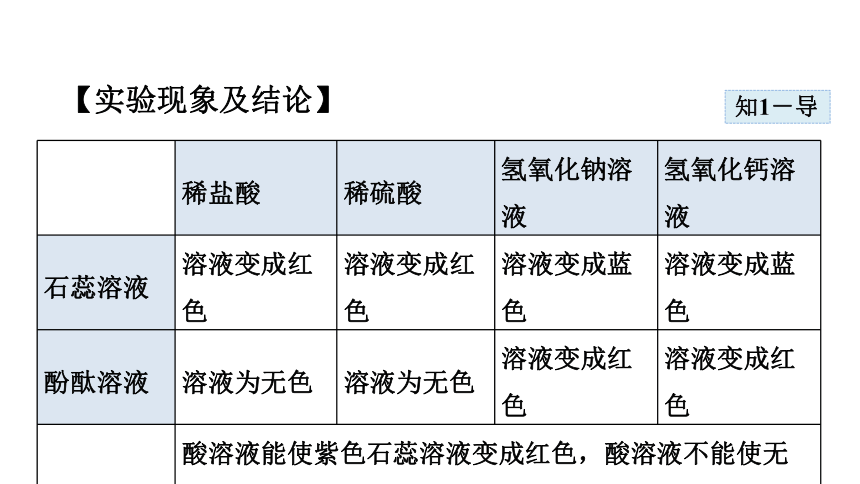
【实验现象及结论】
? 稀盐酸 稀硫酸 氢氧化钠溶液 氢氧化钙溶液
石蕊溶液 溶液变成红色 溶液变成红色 溶液变成蓝色 溶液变成蓝色
酚酞溶液 溶液为无色 溶液为无色 溶液变成红色 溶液变成红色
实验结论 酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
【实验现象及结论】
? 反应现象 结论(化学方程式)
稀盐酸和生锈铁钉的反应 铁锈消失,铁钉变得光亮,溶液由无色变成黄色 Fe2O3+6HCl===2FeCl3+3H2O
光亮的铁钉继续与酸作用 光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色 Fe + 2HCl===FeCl2+H2↑
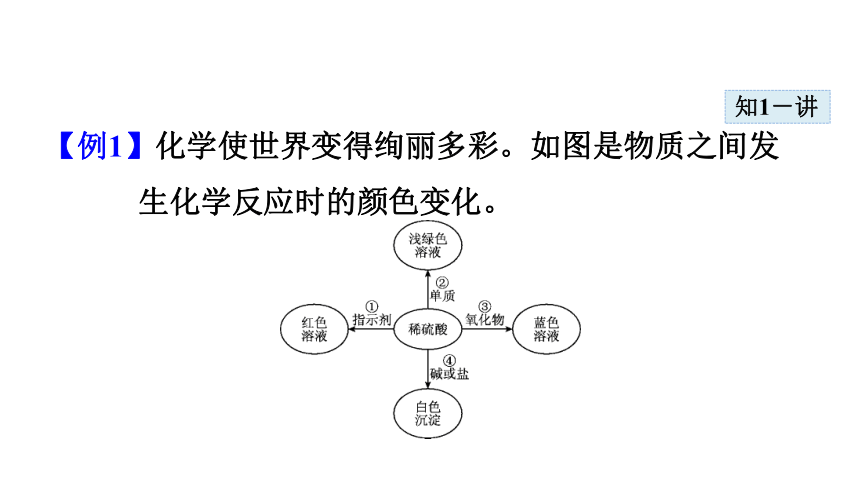
【例1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应时的颜色变化。
(1)请你在编号②、③处各填入一种物质:
②是_______________;③是 。
(2)根据上图可以总结出稀硫酸的五条化学性质。请你写出编号①稀硫酸的化学性质___________________________。
铁(或Fe)
氧化铜(或CuO)
硫酸可使紫色石蕊试液变红
(3)若编号④的物质是碱,请你写出符合编号④的一个化学方程式_________________________________。
Ba(OH)2+H2SO4===BaSO4↓+2H2O
导引:从图中可看出酸能与五类物质发生反应,一、能与酸碱指示剂反应,如①中使紫色石蕊试液变红;二、与活泼金属反应,其中与铁反应能得到浅绿色的溶液;三、与金属氧化物反应,若要得到蓝色溶液,可与氧化铜反应得到蓝色的硫
酸铜溶液;四、与碱反应生成盐和水;五、与某些盐反应。要生成白色沉淀,只有利用硫酸中的硫酸根离子与钡离子结合生成硫酸钡沉淀,可选用氢氧化钡或氯化钡等溶液与稀硫酸反应。
1.下列物质加入稀硫酸中,有大量气泡产生的是( )
A.Zn B.Cu
C.CuO D.NaOH
A
2.【中考?河池】下列关于稀盐酸化学性质的描述中,不属于酸的共同性质的是( )
A.能与氧化铝反应生成盐和水
B.能使紫色石蕊试液变红色
C.能与AgNO3反应生成白色沉淀
D.能与氢氧化钠反应生成水
C
3.【中考?重庆】食醋里通常含有3%~5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法不正确的是( )
A.产生的气体是二氧化碳
B.加水稀释食醋,溶液pH变小
C.醋酸在水溶液里能解离出H+
D.不宜用铝制容器盛装食醋
B
4.【中考?青岛】根据你所学的化学知识和生活经验判断,下列说法错误的是( )
A.打开盛浓盐酸的试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动
B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂能溶解油污
C.吃松花蛋时可加入少量食醋,是因为食醋能消除蛋中所含碱性物质的涩味
D.稀盐酸能用来除去铁制品表面的铁锈,是因为稀盐酸能与某些金属氧化物反应
B
(1)试写出盐酸走出迷宫不会被“吃掉”的路线,按从入口至出口的顺序(用序号相连)
______________;
②④⑥⑨⑧?
(2)写出“吃掉”盐酸的置换反应_______________________;
(3)盐酸想走捷径,从最近距离走出,却被“吃掉”,生成一种固体时叫“干冰”的气体,其化学方程式为_________________________________________;
(4)用迷宫中的物质检验(3)中生成气体的化学方程式为________________________________________。
Fe+2HCl===FeCl2+H2↑
CaCO3+2HCl===CaCl2+H2O+CO2↑
Ca(OH)2+CO2===CaCO3↓+H2O
2
知识点
探究碱的性质
1.碱与盐的反应
【操作步骤】在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象。然后再向试管中加入稀盐酸,观察现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向盛有CuSO4溶液的试管中加入几滴NaOH溶液 有蓝色沉淀生成 CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
再向上述试管中加入稀盐酸 蓝色沉淀消失 Cu(OH)2+2HCl===CuCl2+2H2O
2.中和反应
【操作步骤】在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸 溶液由无色变成红色,然后溶液由红色变成无色 NaOH+HCl===NaCl+H2O
取上述无色的溶液1 mL置于蒸发皿中加热蒸干 蒸发皿上出现白色固体 ?
3. 氢氧化钙的性质
【实验步骤】
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡 固体部分溶解,溶液由无色变为红色 氢氧化钙微溶于水,水溶液显碱性
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡 固体部分溶解,溶液由无色变为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色 Ca(OH)2+2HCl
===CaCl2+2H2O
【例2】归纳总结是学习化学的重要方法,小明同学总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应),如图所示。
(1)为了验证反应①,小明将紫色石蕊试液滴入NaOH溶液中,溶液变成________色。
(2)反应②说明NaOH溶液在空气中易变质,其化学方程式为__________________________________。
蓝
CO2+2NaOH=== Na2CO3+H2O
(3)为了验证反应③能够发生,你选择的物质是
________(填序号)。
A.K2CO3 B.盐酸
C.CuSO4 D.MgCl2
(4)为了验证反应④,小明向NaOH溶液中滴入一定量FeCl3溶液,该反应的现象是_________________。
B
产生红褐色沉淀
导引:(1)氢氧化钠能与酸碱指示剂反应,使紫色石蕊试液变蓝;
6.【中考?广西】下列有关氢氧化钠的说法不正确的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂,用于造纸、纺织等工业
C
7.【中考?北京】下列物质能与NaOH反应的是( )
A.Fe B.CO2
C.Fe2O3 D.NaCl
B
8.【中考?广州】下列有关氢氧化钾的说法正确的是( )
A.氢氧化钾固体露置在空气中易变质
B.氢氧化钾溶液能使石蕊溶液变红
C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀
D.2 mL氢氧化钾溶液与1 mL硫酸溶液恰好完全反应
A
9.【节选?成都】如图所示实验,用药匙的柄把端挑起一点氢氧化钙粉末于试管中,依次进行实验。观察到的现象为:浑浊→变红→红色消失。
(1)根据现象判断氢氧化钙的性质有____________、_____________________________________(物理性质和化学性质各填一条)。
(2)按图实验完毕,所得溶液中除酚酞外一定有的溶质是__________,可能有的溶质是______________。
HCl
微溶于水
能使无色酚酞试液变红(或能与盐酸反应)
CaCl2
实验活动6 酸、碱的化学性质
第十单元 酸和碱
酸、碱的化学性质
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
1
知识点
探究酸的性质
1.酸、碱与酸碱指示剂作用
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
图1 图2
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜 色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察 颜色的变化(如图2)。
图1 图2
【实验现象及结论】
? 稀盐酸 稀硫酸 氢氧化钠溶液 氢氧化钙溶液
石蕊溶液 溶液变成红色 溶液变成红色 溶液变成蓝色 溶液变成蓝色
酚酞溶液 溶液为无色 溶液为无色 溶液变成红色 溶液变成红色
实验结论 酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
【实验现象及结论】
? 反应现象 结论(化学方程式)
稀盐酸和生锈铁钉的反应 铁锈消失,铁钉变得光亮,溶液由无色变成黄色 Fe2O3+6HCl===2FeCl3+3H2O
光亮的铁钉继续与酸作用 光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色 Fe + 2HCl===FeCl2+H2↑
【例1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应时的颜色变化。
(1)请你在编号②、③处各填入一种物质:
②是_______________;③是 。
(2)根据上图可以总结出稀硫酸的五条化学性质。请你写出编号①稀硫酸的化学性质___________________________。
铁(或Fe)
氧化铜(或CuO)
硫酸可使紫色石蕊试液变红
(3)若编号④的物质是碱,请你写出符合编号④的一个化学方程式_________________________________。
Ba(OH)2+H2SO4===BaSO4↓+2H2O
导引:从图中可看出酸能与五类物质发生反应,一、能与酸碱指示剂反应,如①中使紫色石蕊试液变红;二、与活泼金属反应,其中与铁反应能得到浅绿色的溶液;三、与金属氧化物反应,若要得到蓝色溶液,可与氧化铜反应得到蓝色的硫
酸铜溶液;四、与碱反应生成盐和水;五、与某些盐反应。要生成白色沉淀,只有利用硫酸中的硫酸根离子与钡离子结合生成硫酸钡沉淀,可选用氢氧化钡或氯化钡等溶液与稀硫酸反应。
1.下列物质加入稀硫酸中,有大量气泡产生的是( )
A.Zn B.Cu
C.CuO D.NaOH
A
2.【中考?河池】下列关于稀盐酸化学性质的描述中,不属于酸的共同性质的是( )
A.能与氧化铝反应生成盐和水
B.能使紫色石蕊试液变红色
C.能与AgNO3反应生成白色沉淀
D.能与氢氧化钠反应生成水
C
3.【中考?重庆】食醋里通常含有3%~5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法不正确的是( )
A.产生的气体是二氧化碳
B.加水稀释食醋,溶液pH变小
C.醋酸在水溶液里能解离出H+
D.不宜用铝制容器盛装食醋
B
4.【中考?青岛】根据你所学的化学知识和生活经验判断,下列说法错误的是( )
A.打开盛浓盐酸的试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动
B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂能溶解油污
C.吃松花蛋时可加入少量食醋,是因为食醋能消除蛋中所含碱性物质的涩味
D.稀盐酸能用来除去铁制品表面的铁锈,是因为稀盐酸能与某些金属氧化物反应
B
(1)试写出盐酸走出迷宫不会被“吃掉”的路线,按从入口至出口的顺序(用序号相连)
______________;
②④⑥⑨⑧?
(2)写出“吃掉”盐酸的置换反应_______________________;
(3)盐酸想走捷径,从最近距离走出,却被“吃掉”,生成一种固体时叫“干冰”的气体,其化学方程式为_________________________________________;
(4)用迷宫中的物质检验(3)中生成气体的化学方程式为________________________________________。
Fe+2HCl===FeCl2+H2↑
CaCO3+2HCl===CaCl2+H2O+CO2↑
Ca(OH)2+CO2===CaCO3↓+H2O
2
知识点
探究碱的性质
1.碱与盐的反应
【操作步骤】在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象。然后再向试管中加入稀盐酸,观察现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向盛有CuSO4溶液的试管中加入几滴NaOH溶液 有蓝色沉淀生成 CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
再向上述试管中加入稀盐酸 蓝色沉淀消失 Cu(OH)2+2HCl===CuCl2+2H2O
2.中和反应
【操作步骤】在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸 溶液由无色变成红色,然后溶液由红色变成无色 NaOH+HCl===NaCl+H2O
取上述无色的溶液1 mL置于蒸发皿中加热蒸干 蒸发皿上出现白色固体 ?
3. 氢氧化钙的性质
【实验步骤】
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
【实验现象及结论】
? 反应现象 结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡 固体部分溶解,溶液由无色变为红色 氢氧化钙微溶于水,水溶液显碱性
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡 固体部分溶解,溶液由无色变为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色 Ca(OH)2+2HCl
===CaCl2+2H2O
【例2】归纳总结是学习化学的重要方法,小明同学总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应),如图所示。
(1)为了验证反应①,小明将紫色石蕊试液滴入NaOH溶液中,溶液变成________色。
(2)反应②说明NaOH溶液在空气中易变质,其化学方程式为__________________________________。
蓝
CO2+2NaOH=== Na2CO3+H2O
(3)为了验证反应③能够发生,你选择的物质是
________(填序号)。
A.K2CO3 B.盐酸
C.CuSO4 D.MgCl2
(4)为了验证反应④,小明向NaOH溶液中滴入一定量FeCl3溶液,该反应的现象是_________________。
B
产生红褐色沉淀
导引:(1)氢氧化钠能与酸碱指示剂反应,使紫色石蕊试液变蓝;
6.【中考?广西】下列有关氢氧化钠的说法不正确的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂,用于造纸、纺织等工业
C
7.【中考?北京】下列物质能与NaOH反应的是( )
A.Fe B.CO2
C.Fe2O3 D.NaCl
B
8.【中考?广州】下列有关氢氧化钾的说法正确的是( )
A.氢氧化钾固体露置在空气中易变质
B.氢氧化钾溶液能使石蕊溶液变红
C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀
D.2 mL氢氧化钾溶液与1 mL硫酸溶液恰好完全反应
A
9.【节选?成都】如图所示实验,用药匙的柄把端挑起一点氢氧化钙粉末于试管中,依次进行实验。观察到的现象为:浑浊→变红→红色消失。
(1)根据现象判断氢氧化钙的性质有____________、_____________________________________(物理性质和化学性质各填一条)。
(2)按图实验完毕,所得溶液中除酚酞外一定有的溶质是__________,可能有的溶质是______________。
HCl
微溶于水
能使无色酚酞试液变红(或能与盐酸反应)
CaCl2
同课章节目录
