科粤化学九下 8.3 酸和碱的反应(20张PPT)
文档属性
| 名称 | 科粤化学九下 8.3 酸和碱的反应(20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 588.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-24 08:52:52 | ||
图片预览







文档简介
课件20张PPT。8.3 酸和碱的反应
粤教版九年级化学下册学校:斗门街办初级中学
教师:李晓丽探究问题一 酸和碱的组成特点活动1:请你测定下列溶液能否导电。步骤:将待测溶液连入电路,观察灯泡是否
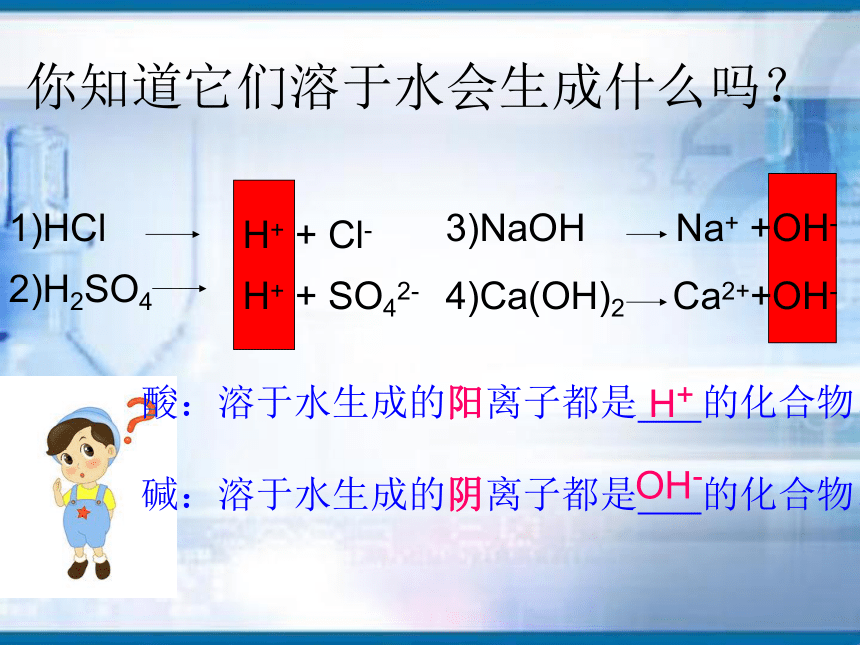
发光并思考其中的原因。没有带电的粒子有带电的粒子这些带电的粒子是什么?H+ + SO42-H+ + Cl-1)HCl2)H2SO43)NaOHNa+ +OH-4)Ca(OH)2 Ca2++OH-
酸:溶于水生成的阳离子都是 的化合物。
碱:溶于水生成的阴离子都是 的化合物。
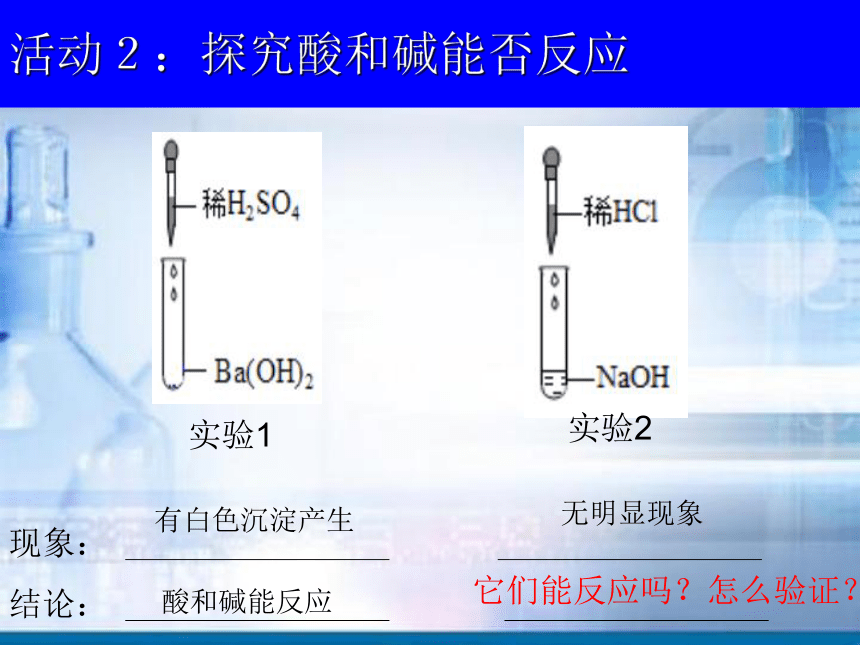
H+OH-你知道它们溶于水会生成什么吗?探究问题二: 酸和碱之间会发生反应吗?活动2:探究酸和碱能否反应实验1实验2现象:有白色沉淀产生结论:酸和碱能反应无明显现象它们能反应吗?怎么验证?你的猜想:如何设计方案来证明你的猜想?问题:稀盐酸与氢氧化钠能反应吗? 它们先物理上混合。接着,其中一种被反应完
另一种有剩余,也可能恰好完全反应。证明盐酸或氢氧化钠有一个或都消失了,说明
两者能反应。注意:量的问题利用盐酸、氢氧化钠的化学性质,选择有明显
现象的反应,来检验盐酸、氢氧化钠是否仍然
存在。回顾:稀盐酸、氢氧化钠的化学性质 稀盐酸
氢氧化钠使紫色石蕊溶液变红,不能使无色酚酞变色
与较活泼金属生成盐和H2
与金属氧化物生成盐和水
与盐生成新酸和新盐
使紫色石蕊溶液变蓝,无色酚酞变红
与非金属氧化物生成盐和水
与盐生成新碱和新盐
锌粒或镁条氧化铜或氧化铁碳酸钙硫酸铜或氯化铁溶液探究“稀盐酸和氢氧化钠能否反应”实验报告单分组实验:
请各小组利用桌面上提供的药品及仪器,设计并完成实验,填写实验报告单,再派代表汇报。稀盐酸和氢氧化钠能反应活动3:稀盐酸和氢氧化钠生成了什么?恰好完全反应白色固体NaCl反应方程式: HCl+NaOH = NaCl+H2O
(酸)(碱) (盐)(水)
1、H2SO4 + NaOH =
2、 HCl +Ca(OH)2 =2 2中和反应: 酸跟碱生成盐和水的反应。判断:生成盐和水的反应一定属于中和反应。( )你能写出下列反应的方程式吗?找规律!
观察:1) 哪些离子没有发生变化?
2) 哪些离子真正发生变化?
H+ + OH- =H2O中和反应的微观实质:
中和反应的应用一:改良酸性或碱性土壤酸 雨土壤板结撒熟石灰某一硫酸厂的废水中仍有硫酸,能直接排放吗?加入熟石灰中和反应的应用二:处理工业废水给你注射一针蚁酸,哈哈!弱碱性中和反应的应用(三)--医药学以致用小明同学忘记滴加酸碱指示剂。为了确定滴加的盐酸是否已经
过量。下表的实验方案,不合理的是( )检验的是氯离子,而氯离子始终在溶液中。√√√X酸、碱各多一性质 酸指示剂较活泼金属金属氧化物碱指示剂非金属氧化物盐盐碱酸作业:巧记酸碱化学性质酸 H+ 石蕊酚酞盐H2活泼
金属金属
氧化物盐H2O碱盐H2O盐新酸新盐pH试纸自己完成右手吧!通过本节课的学习,
你有哪些收获?
谈收获寄语一份耕耘,一份收获。勤于思考,乐于探究,善于合作化学知识似乎杂乱无章,其实它们之间有一定的规律可循,只要我们多问几个为什么,乐于思考,善于总结,就一定觉得事半而功倍。“一份耕耘,一份收获”!愿同学们在今年的中考中取得更大的收获!
粤教版九年级化学下册学校:斗门街办初级中学
教师:李晓丽探究问题一 酸和碱的组成特点活动1:请你测定下列溶液能否导电。步骤:将待测溶液连入电路,观察灯泡是否
发光并思考其中的原因。没有带电的粒子有带电的粒子这些带电的粒子是什么?H+ + SO42-H+ + Cl-1)HCl2)H2SO43)NaOHNa+ +OH-4)Ca(OH)2 Ca2++OH-
酸:溶于水生成的阳离子都是 的化合物。
碱:溶于水生成的阴离子都是 的化合物。
H+OH-你知道它们溶于水会生成什么吗?探究问题二: 酸和碱之间会发生反应吗?活动2:探究酸和碱能否反应实验1实验2现象:有白色沉淀产生结论:酸和碱能反应无明显现象它们能反应吗?怎么验证?你的猜想:如何设计方案来证明你的猜想?问题:稀盐酸与氢氧化钠能反应吗? 它们先物理上混合。接着,其中一种被反应完
另一种有剩余,也可能恰好完全反应。证明盐酸或氢氧化钠有一个或都消失了,说明
两者能反应。注意:量的问题利用盐酸、氢氧化钠的化学性质,选择有明显
现象的反应,来检验盐酸、氢氧化钠是否仍然
存在。回顾:稀盐酸、氢氧化钠的化学性质 稀盐酸
氢氧化钠使紫色石蕊溶液变红,不能使无色酚酞变色
与较活泼金属生成盐和H2
与金属氧化物生成盐和水
与盐生成新酸和新盐
使紫色石蕊溶液变蓝,无色酚酞变红
与非金属氧化物生成盐和水
与盐生成新碱和新盐
锌粒或镁条氧化铜或氧化铁碳酸钙硫酸铜或氯化铁溶液探究“稀盐酸和氢氧化钠能否反应”实验报告单分组实验:
请各小组利用桌面上提供的药品及仪器,设计并完成实验,填写实验报告单,再派代表汇报。稀盐酸和氢氧化钠能反应活动3:稀盐酸和氢氧化钠生成了什么?恰好完全反应白色固体NaCl反应方程式: HCl+NaOH = NaCl+H2O
(酸)(碱) (盐)(水)
1、H2SO4 + NaOH =
2、 HCl +Ca(OH)2 =2 2中和反应: 酸跟碱生成盐和水的反应。判断:生成盐和水的反应一定属于中和反应。( )你能写出下列反应的方程式吗?找规律!
观察:1) 哪些离子没有发生变化?
2) 哪些离子真正发生变化?
H+ + OH- =H2O中和反应的微观实质:
中和反应的应用一:改良酸性或碱性土壤酸 雨土壤板结撒熟石灰某一硫酸厂的废水中仍有硫酸,能直接排放吗?加入熟石灰中和反应的应用二:处理工业废水给你注射一针蚁酸,哈哈!弱碱性中和反应的应用(三)--医药学以致用小明同学忘记滴加酸碱指示剂。为了确定滴加的盐酸是否已经
过量。下表的实验方案,不合理的是( )检验的是氯离子,而氯离子始终在溶液中。√√√X酸、碱各多一性质 酸指示剂较活泼金属金属氧化物碱指示剂非金属氧化物盐盐碱酸作业:巧记酸碱化学性质酸 H+ 石蕊酚酞盐H2活泼
金属金属
氧化物盐H2O碱盐H2O盐新酸新盐pH试纸自己完成右手吧!通过本节课的学习,
你有哪些收获?
谈收获寄语一份耕耘,一份收获。勤于思考,乐于探究,善于合作化学知识似乎杂乱无章,其实它们之间有一定的规律可循,只要我们多问几个为什么,乐于思考,善于总结,就一定觉得事半而功倍。“一份耕耘,一份收获”!愿同学们在今年的中考中取得更大的收获!
