选修4 化学反应原理 第一章 第三节反应热的计算(26张)
文档属性
| 名称 | 选修4 化学反应原理 第一章 第三节反应热的计算(26张) |  | |
| 格式 | zip | ||
| 文件大小 | 264.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-29 15:38:32 | ||
图片预览








文档简介
(共26张PPT)
1.能源就是能提供 自然资源,包括_____________________________________________ _____________________________________________等。
2.我国目前使用的主要能源是 。
3.能源是国民经济和社会发展的重要物质基础,它的开发
和利用情况,可以用来衡量一个国家或地区的经济发展
和科学技术水平。
4.解决能源的办法是 ,即开发 __和节约
,提高能源的 。
5.现在探索开发的新能源有
等,
新能源的主要优势是 。
三、能源
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
化学反应热的计算
强调:正逆反应的反应热数值相等,符号
相反。“+”不能省去。
知识回顾
1.已知石墨的燃烧热:△H=-393.5kJ/mol
1)写出石墨的完全燃烧的热化学方程式
2)二氧化碳转化为石墨和氧气的热化学方程式
如何求出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ΔH1=?
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH、 Δ H1、 Δ H2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
CO(g)
C(s)
CO2(g)
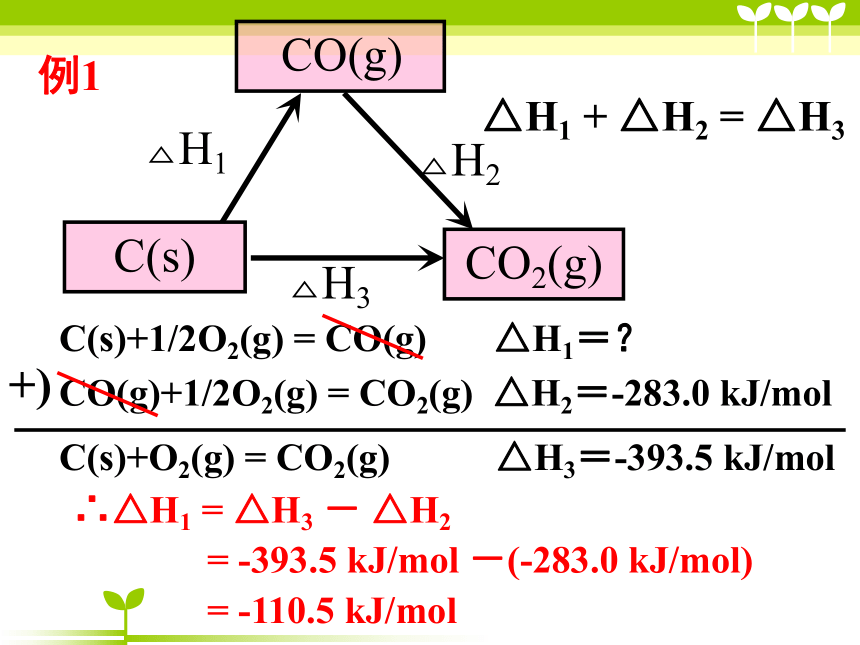
例1
C(s)+1/2O2(g) = CO(g) △H1=?
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol
+)
△H1 + △H2 = △H3
∴△H1 = △H3 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
H2(g)+1/2O2(g) = H2O (g)
△H1=-241.8kJ/mol
H2(g)+1/2O2(g) = H2O (l)
△H=△H1+ △H2=-285.8kJ/mol
例2
下列数据△H1表示燃烧热吗?why
△H=
①
②
③
盖斯定律的应用
关键:目标方程式的“四则运算式”的导出
方法:
1.写出目标方程式确定始态和终态。
2.然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
【例1】某次发射火箭,用N2H4(肼)在NO2中
燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g) = 2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭
反应的热化学方程式。
③ 2N2H4(g)+ 2NO2(g) = 3N2(g)+4H2O(l)
△H=
【解】: ③ = ② ×2 - ① ΔH=ΔH2×2 -ΔH1 ? =-534×2 -67.2 =-1135.2 kJ/mol
-1135.2 kJ/mol
【例2】已知①CO(g) + 1/2 O2(g) = CO2(g)
ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l)
ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l)
ΔH3= - 1370 kJ/mol 试计算:④2CO(g)+4H2(g) = H2O(l)+C2H5OH (l)
的ΔH
【解】:①×2 + ②×4 - ③ = ④ ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
1.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,
石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,
石墨的能量比金刚石的高;
C.由石墨制备金刚石是放热反应;等质量时,
石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,
石墨的能量比金刚石的高
A
①C(石墨,s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)= CO2(g) △H2=-395.0kJ/mol
2.实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4 。
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH1=-890.3kJ·mol-1 (1)
C(石墨)+O2(g)=CO2(g) ΔH2=-393·5kJ·mol-1 (2)
H2(g)+ O2(g)=H2O(l)
ΔH3=-285.8kJ·mol-1 (3)
C(石墨)+2H2(g)=CH4(g) ΔH4 (4)
-74.8kJ·mol-1
3.在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s) +1/2O2(g) = CO(g) = -110.35 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) = -282.57 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJ
C
题型一:已知一定量的物质参加反应放出的热量,
写出其热化学反应方程式。
例1、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态B2O3和液态水,放出649.5kJ热量,其热化学方程式为 。又已知H2O(l) = H2O(g) △H=+44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出热量是多少千焦? 。
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H =-2165kJ/mol
1016.5kJ
例2、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
(1)
(s,白磷)+
(2)
则白磷转化为红磷的热化学方程_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷________(填“高”或“低”)。
题型二:利用盖斯定律求反应热
欲得到相同的热量,需分别燃烧固体碳和氢气的
质量比约为
A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8
题型三:根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例3、已知:
√
例4、下列各组热化学方程式中,化学反应的△H 前者大于后者的是( )
① C(s)+O2(g)===CO2(g) △H1
C(s)+O2(g)===CO(g) △H2
② S(s)+O2(g)===SO2(g) △H3
S(g)+O2(g)===SO2(g) △H4
③ H2(g)+O2(g)===H2O(l) △H5
2H2(g)+O2(g)===2H2O(l) △H6
④ CaCO3(s)===CaO(s)+CO2(g) △H7
CaO(s)+H2O(l)===Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
C
题型四:反应热大小比较
人们常把拆开1 mol某化学键所吸收的能量看成该化学键的键能,键能的单位是kJ/mol。
题型五:利用键能计算反应热
例5、CH3CH3→CH2=CH2+H2;
有关化学键的键能如下:
化学键 C-H C=C C-C H-H 键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热。
1、已知热化学方程式:
提问:
反应放出的热量Q与反应物的用量有关吗?
反应热△H与反应物的用量有关吗?
有关
无关
反应热△H是与化学计量数有关!
2、在测定中和热的过程中,如果大烧杯上如不盖硬纸板,测得的中和热数值__________。
偏小
若改为:大烧杯上如不盖硬纸板,测得的中和热△H
__________。
偏大
(填“偏大”“偏小”“无影响”)
注意:若问的是中和热或燃烧热,不考虑符号。
若问的是反应热或△H,考虑符号。
1. 已知:
C(s)+O2(g) = CO2(g) △H=-393.5kJ/mol H2(g)+1/2O2(g) = H2O (l) △H =- 41.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为 ( )
A. 2:3.25 B. 12:3.25
C. 1:1 D. 393.5:241.8
B
练习
2.氢气、一氧化碳、辛烷、甲烷的热化学方程式
分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全
燃烧时放出热量最少的是( )
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
B
3.已知:2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比
列方程求解
若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q kJ,则金刚石和石墨的物质的量之比为: 。
4.已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s)+O2(g) = CO2(g)
△H1=-395.41kJ/mol
② C(石墨、s)+O2(g) = CO2(g)
△H2=-393.51kJ/mol
5.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s) = CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C.Q1A
盖斯定律的灵活应用
1.能源就是能提供 自然资源,包括_____________________________________________ _____________________________________________等。
2.我国目前使用的主要能源是 。
3.能源是国民经济和社会发展的重要物质基础,它的开发
和利用情况,可以用来衡量一个国家或地区的经济发展
和科学技术水平。
4.解决能源的办法是 ,即开发 __和节约
,提高能源的 。
5.现在探索开发的新能源有
等,
新能源的主要优势是 。
三、能源
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
化学反应热的计算
强调:正逆反应的反应热数值相等,符号
相反。“+”不能省去。
知识回顾
1.已知石墨的燃烧热:△H=-393.5kJ/mol
1)写出石墨的完全燃烧的热化学方程式
2)二氧化碳转化为石墨和氧气的热化学方程式
如何求出这个反应的反应热:
C(s)+1/2O2(g)==CO(g) ΔH1=?
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH、 Δ H1、 Δ H2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
CO(g)
C(s)
CO2(g)
例1
C(s)+1/2O2(g) = CO(g) △H1=?
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol
+)
△H1 + △H2 = △H3
∴△H1 = △H3 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
H2(g)+1/2O2(g) = H2O (g)
△H1=-241.8kJ/mol
H2(g)+1/2O2(g) = H2O (l)
△H=△H1+ △H2=-285.8kJ/mol
例2
下列数据△H1表示燃烧热吗?why
△H=
①
②
③
盖斯定律的应用
关键:目标方程式的“四则运算式”的导出
方法:
1.写出目标方程式确定始态和终态。
2.然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
【例1】某次发射火箭,用N2H4(肼)在NO2中
燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g) = 2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭
反应的热化学方程式。
③ 2N2H4(g)+ 2NO2(g) = 3N2(g)+4H2O(l)
△H=
【解】: ③ = ② ×2 - ① ΔH=ΔH2×2 -ΔH1 ? =-534×2 -67.2 =-1135.2 kJ/mol
-1135.2 kJ/mol
【例2】已知①CO(g) + 1/2 O2(g) = CO2(g)
ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l)
ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l)
ΔH3= - 1370 kJ/mol 试计算:④2CO(g)+4H2(g) = H2O(l)+C2H5OH (l)
的ΔH
【解】:①×2 + ②×4 - ③ = ④ ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
1.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,
石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,
石墨的能量比金刚石的高;
C.由石墨制备金刚石是放热反应;等质量时,
石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,
石墨的能量比金刚石的高
A
①C(石墨,s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)= CO2(g) △H2=-395.0kJ/mol
2.实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4 。
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH1=-890.3kJ·mol-1 (1)
C(石墨)+O2(g)=CO2(g) ΔH2=-393·5kJ·mol-1 (2)
H2(g)+ O2(g)=H2O(l)
ΔH3=-285.8kJ·mol-1 (3)
C(石墨)+2H2(g)=CH4(g) ΔH4 (4)
-74.8kJ·mol-1
3.在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s) +1/2O2(g) = CO(g) = -110.35 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) = -282.57 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJ
C
题型一:已知一定量的物质参加反应放出的热量,
写出其热化学反应方程式。
例1、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态B2O3和液态水,放出649.5kJ热量,其热化学方程式为 。又已知H2O(l) = H2O(g) △H=+44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出热量是多少千焦? 。
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H =-2165kJ/mol
1016.5kJ
例2、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
(1)
(s,白磷)+
(2)
则白磷转化为红磷的热化学方程_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷________(填“高”或“低”)。
题型二:利用盖斯定律求反应热
欲得到相同的热量,需分别燃烧固体碳和氢气的
质量比约为
A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8
题型三:根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例3、已知:
√
例4、下列各组热化学方程式中,化学反应的△H 前者大于后者的是( )
① C(s)+O2(g)===CO2(g) △H1
C(s)+O2(g)===CO(g) △H2
② S(s)+O2(g)===SO2(g) △H3
S(g)+O2(g)===SO2(g) △H4
③ H2(g)+O2(g)===H2O(l) △H5
2H2(g)+O2(g)===2H2O(l) △H6
④ CaCO3(s)===CaO(s)+CO2(g) △H7
CaO(s)+H2O(l)===Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
C
题型四:反应热大小比较
人们常把拆开1 mol某化学键所吸收的能量看成该化学键的键能,键能的单位是kJ/mol。
题型五:利用键能计算反应热
例5、CH3CH3→CH2=CH2+H2;
有关化学键的键能如下:
化学键 C-H C=C C-C H-H 键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热。
1、已知热化学方程式:
提问:
反应放出的热量Q与反应物的用量有关吗?
反应热△H与反应物的用量有关吗?
有关
无关
反应热△H是与化学计量数有关!
2、在测定中和热的过程中,如果大烧杯上如不盖硬纸板,测得的中和热数值__________。
偏小
若改为:大烧杯上如不盖硬纸板,测得的中和热△H
__________。
偏大
(填“偏大”“偏小”“无影响”)
注意:若问的是中和热或燃烧热,不考虑符号。
若问的是反应热或△H,考虑符号。
1. 已知:
C(s)+O2(g) = CO2(g) △H=-393.5kJ/mol H2(g)+1/2O2(g) = H2O (l) △H =- 41.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为 ( )
A. 2:3.25 B. 12:3.25
C. 1:1 D. 393.5:241.8
B
练习
2.氢气、一氧化碳、辛烷、甲烷的热化学方程式
分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全
燃烧时放出热量最少的是( )
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
B
3.已知:2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比
列方程求解
若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q kJ,则金刚石和石墨的物质的量之比为: 。
4.已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s)+O2(g) = CO2(g)
△H1=-395.41kJ/mol
② C(石墨、s)+O2(g) = CO2(g)
△H2=-393.51kJ/mol
5.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s) = CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C.Q1
盖斯定律的灵活应用
