选修五 第三章 第三节 羧酸 酯 课教学课件 (32张)
文档属性
| 名称 | 选修五 第三章 第三节 羧酸 酯 课教学课件 (32张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-03 09:01:28 | ||
图片预览








文档简介
(共33张PPT)
第三章 烃的含氧衍生物
第3节 羧酸 酯
自然界中的有机酸
我们常常会吃到一些酸味较浓的食物,
这些食物为什么有酸味?你能举例吗?
草酸晶体
蚁酸
HCOOH(蚁酸)
HOOC—COOH
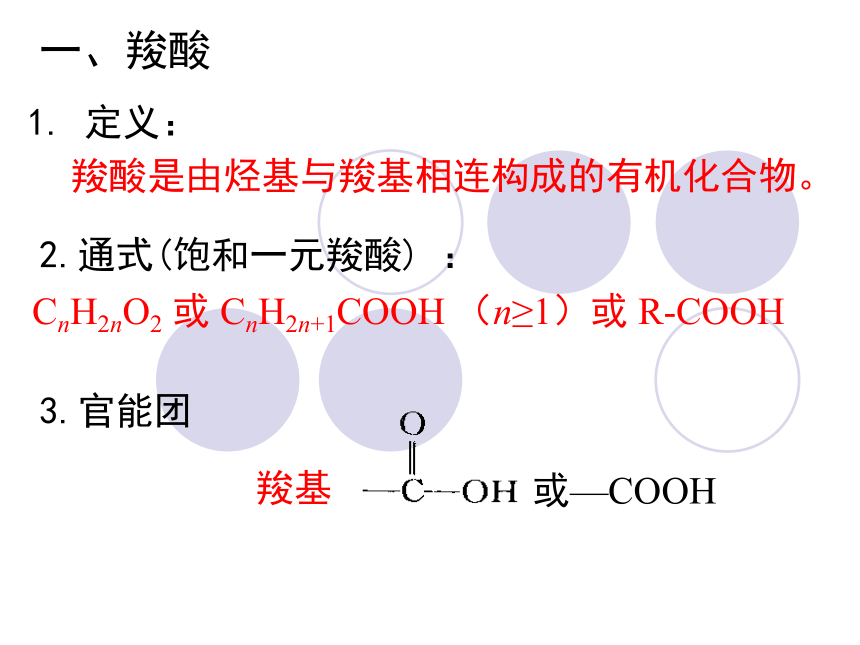
一、羧酸
1. 定义:
羧酸是由烃基与羧基相连构成的有机化合物。
2.通式(饱和一元羧酸) :
CnH2nO2 或 CnH2n+1COOH (n≥1)或 R-COOH
3.官能团
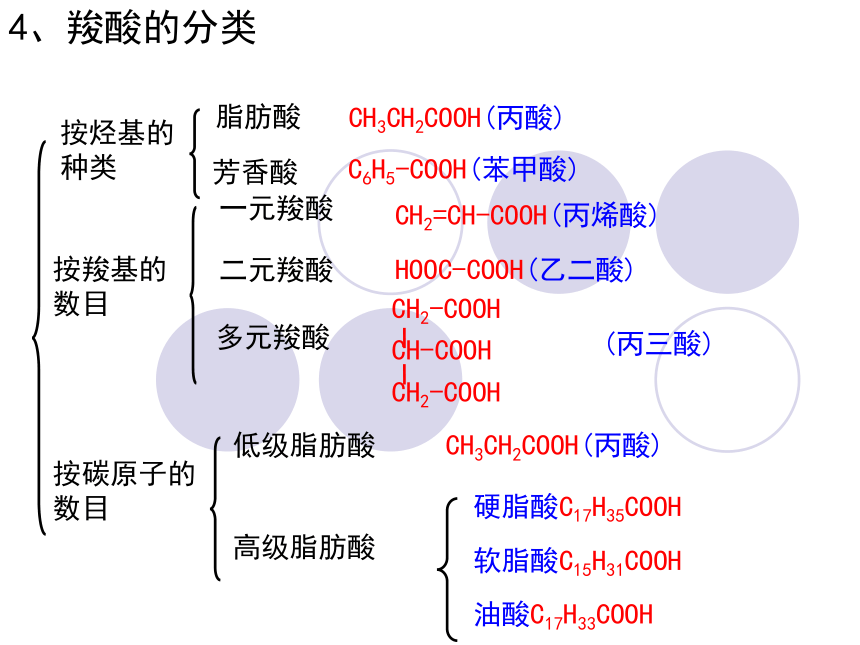
4、羧酸的分类
按烃基的种类
按羧基的数目
按碳原子的数目
脂肪酸
芳香酸
一元羧酸
二元羧酸
多元羧酸
低级脂肪酸
高级脂肪酸
CH3CH2COOH(丙酸)
C6H5-COOH(苯甲酸)
CH2=CH-COOH(丙烯酸)
HOOC-COOH(乙二酸)
硬脂酸C17H35COOH
软脂酸C15H31COOH
油酸C17H33COOH
CH3CH2COOH(丙酸)
(丙三酸)
饱和羧酸
不饱和羧酸
按烃基饱和程度
油酸(C17H33COOH)
硬脂酸(C17H35COOH)
4.几种重要的羧酸
除乙酸外的其它酸:
(1)甲酸:HCOOH
(2)苯甲酸:C6H5-COOH
(3)乙二酸(草酸):HOOC-COOH
1.物理性质
常温下为无色液体
强烈刺激性气味
与水、酒精以任意比互溶
气味 :
色 态 :
溶解性:
熔沸点:
熔点:16.6℃,易结成冰一样的晶体。(冰醋酸由此得名)沸点:117.9 ℃
二、羧酸代表物——乙酸
分析氢谱图写出乙酸的结构式。
二、羧酸代表物——乙酸
羧基上的氢
甲基上的氢
*
2、乙酸结构
分子式:
结构式:
结构简式:
官能团:
C2H4O2
H O
| ‖
H—C—C—O—H
|
H
CH3COOH
二、羧酸代表物——乙酸
结构分析
(弱酸性)
(酯化反应)
*
二、羧酸代表物——乙酸
[思考]酸有哪些通性?
使石蕊试液变红
与活泼金属置换出氢气
与碱发生中和反应
与碱性氧化物反应
能与部分盐(如碳酸盐)反应
3、化学性质:
(1)酸的通性:
2CH3COOH +2 Na = 2CH3COONa+H2↑
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑
CH3COOH
Na2CO3
苯酚钠溶液
1.利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
实验装置图1
科学探究P60页
实验装置图2
CH3COOH
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
有气泡生成
溶液变浑浊
CH3COOH
Na2CO3
苯酚钠溶液
CH3COOH
苯酚钠溶液
饱和NaHCO3
Na2CO3
结论:
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-
乙酸易挥发,挥发出来的乙酸也可使苯酚钠转化为苯酚而使溶液浑浊。
比较两种装置的优缺点、并写出反应的化学方程式。
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2
CH3COOH+NaHCO3 CH3COONa+H2O+CO2
CO2+H2O+C6H5ONa C6H5OH+NaHCO3
酸性:CH3COOH>H2CO3
除去挥发出来的乙酸蒸气
酸性:H2CO3>C6H5OH
乙酸 > 碳酸 > 苯酚
结论(酸性强弱):
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
不能
能,不产
生CO2
不能
能
能
增 强
中性
醇、酚、羧酸中羟基的比较
代表物 结构简式 羟基氢的活泼性 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应 与NaHCO3的反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
(2)酯化反应
含氧酸(有机酸或无机酸)和醇(或酚)作用,生成酯和水的反应叫做酯化反应。
浓硫酸作用:催化剂、吸水剂
乙酸乙酯
碎磁片的作用:防止暴沸
方式1:酸脱氢、醇脱羟基
方式2:酸脱羟基、醇脱氢
探究酯化反应可能的脱水方式
----同位素原子示踪法
酯化反应实质:
酸脱羟基醇脱羟基上的氢原子。
C2H5OH + HNO3→C2H5ONO2 + H2O
注:无机含氧酸也可发生酯化反应
(如 H2SO4、HNO3、H3PO4等)
B
1.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
2.酯化反应属于( )
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应
D
练习
苹果酸的结构如下所示,下列相关说法不正确的是( )
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能发生消去反应
D.1 mol苹果酸与Na2CO3溶液反应必须消耗2 mol Na2CO3
D
1、药品混合顺序?浓硫酸的作用是:
2、得到的反应产物是否纯净?
主要杂质有哪些?
3、饱和Na2CO3溶液有什么作用?
4、为什么导管不插入饱和Na2CO3溶液中?
不纯净;主要含乙酸、乙醇。
① 中和乙酸 ② 溶解乙醇。
③ 降低酯在水中的溶解度,以便使酯分层析出。
防止受热不匀发生倒吸。
催化剂、吸水剂
乙醇-浓硫酸-冰醋酸
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提
高乙酸乙酯产率的措施有:
(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
思考和交流(P63页)
*
三、酯
丁酸乙酯
戊酸戊酯
乙酸异戊酯
CH3(CH2)2COOCH2CH3
CH3(CH2)3COO(CH2)4CH3
自然界中的有机酯
*
三、酯
1.定义
2.羧酸分子羟基中的-OH被-OR取代后的产物
1.酸(有机酸、无机酸)跟醇或酚发生酯化反应生成的一类化合物。
2.一般通式:
*
3.饱和一元羧酸酯的通 式:
CnH2nO2
4.酯的物理性质
①低级酯是具有香气味的液体。
②密度比水小。
③难溶于水,易溶于乙醇和乙醚等
有机溶剂。
5.应用:
日常生活中的饮料,糖果和糕点等使用脂类香料。
*
探究乙酸乙酯在中、酸、碱性溶液下的水解速度
探究酯的水解
无变化
层厚减小,快
层厚减少多,较快
1、酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
2、温度越高,酯水解程度越大。
(水解反应是吸热反应)
不加热
加热
层厚稍有减少,慢
环境 中性 酸性
加热 碱性
加热
相同时间内酯层消失速度
结论
*
6、化学性质(水解反应或取代反应)
乙酸乙酯的水解
CH3COOH+NaOH=CH3COONa+H2O
*
酯化反应和水解反应的比较
NaOH中和酯水解生成的CH3COOH,提高酯的水
解率
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应
取代反应
水解反应
取代反应
酯化
水解
酯 化 水 解
反应关系
催 化 剂
催化剂的
其他作用
加热方式
反应类型
1.胆固醇是人体必需的生物活性物质,分子式为C27H46O 。一种胆固醇酯的液晶材料,分子式为C34H50O2 。合成这种胆固醇酯的羧酸是
( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C3H7COOH
B
2、1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol
C.3mol D.2mol
B
*
课堂巩固
1.对有机物
的叙述不正确的是 ( )
A.常温下能与Na2CO3反应放出CO2
B. 0.5mol该有机物与NaOH溶液完全反应,消耗NaOH 4mol
C.与稀H2SO4共热生成两种 有机物
D.该物质的化学式为C14H10O9
C
2、 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如右图:
下列对该化合物叙述正确的是( )
A 属于芳香烃
B 属于卤代烃
C 在酸性条件下不水解
D 在一定条件下可以发生加成反应
D
第三章 烃的含氧衍生物
第3节 羧酸 酯
自然界中的有机酸
我们常常会吃到一些酸味较浓的食物,
这些食物为什么有酸味?你能举例吗?
草酸晶体
蚁酸
HCOOH(蚁酸)
HOOC—COOH
一、羧酸
1. 定义:
羧酸是由烃基与羧基相连构成的有机化合物。
2.通式(饱和一元羧酸) :
CnH2nO2 或 CnH2n+1COOH (n≥1)或 R-COOH
3.官能团
4、羧酸的分类
按烃基的种类
按羧基的数目
按碳原子的数目
脂肪酸
芳香酸
一元羧酸
二元羧酸
多元羧酸
低级脂肪酸
高级脂肪酸
CH3CH2COOH(丙酸)
C6H5-COOH(苯甲酸)
CH2=CH-COOH(丙烯酸)
HOOC-COOH(乙二酸)
硬脂酸C17H35COOH
软脂酸C15H31COOH
油酸C17H33COOH
CH3CH2COOH(丙酸)
(丙三酸)
饱和羧酸
不饱和羧酸
按烃基饱和程度
油酸(C17H33COOH)
硬脂酸(C17H35COOH)
4.几种重要的羧酸
除乙酸外的其它酸:
(1)甲酸:HCOOH
(2)苯甲酸:C6H5-COOH
(3)乙二酸(草酸):HOOC-COOH
1.物理性质
常温下为无色液体
强烈刺激性气味
与水、酒精以任意比互溶
气味 :
色 态 :
溶解性:
熔沸点:
熔点:16.6℃,易结成冰一样的晶体。(冰醋酸由此得名)沸点:117.9 ℃
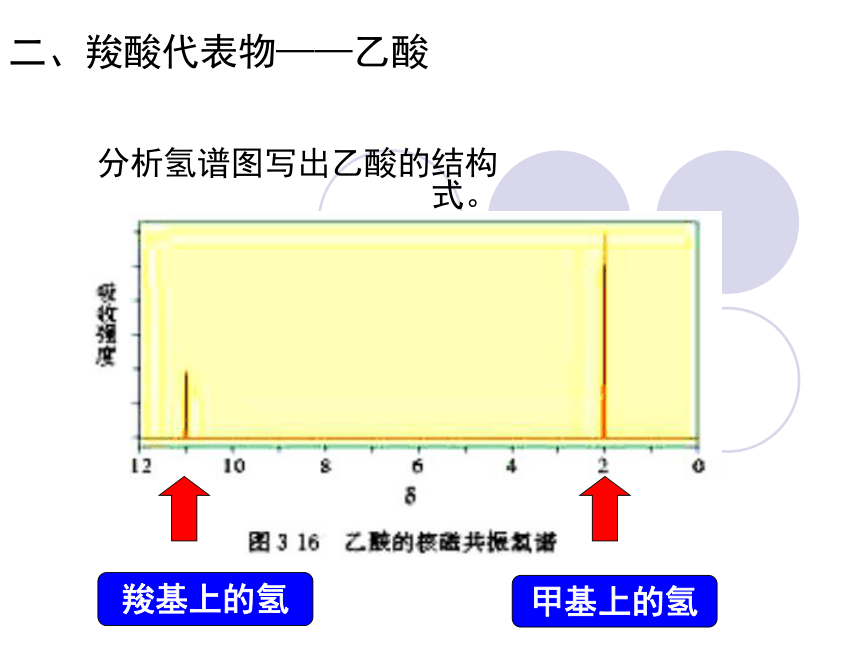
二、羧酸代表物——乙酸
分析氢谱图写出乙酸的结构式。
二、羧酸代表物——乙酸
羧基上的氢
甲基上的氢
*
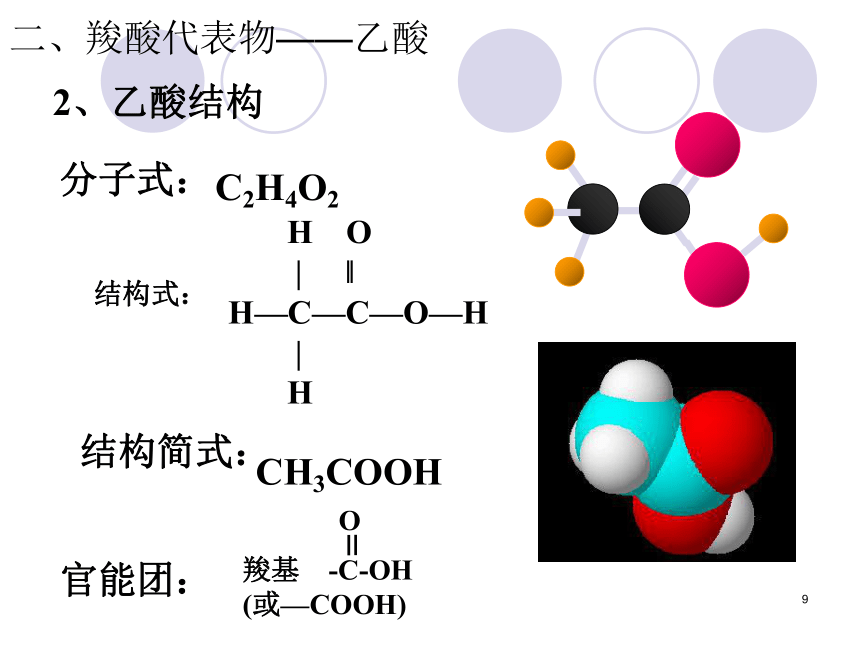
2、乙酸结构
分子式:
结构式:
结构简式:
官能团:
C2H4O2
H O
| ‖
H—C—C—O—H
|
H
CH3COOH
二、羧酸代表物——乙酸
结构分析
(弱酸性)
(酯化反应)
*
二、羧酸代表物——乙酸
[思考]酸有哪些通性?
使石蕊试液变红
与活泼金属置换出氢气
与碱发生中和反应
与碱性氧化物反应
能与部分盐(如碳酸盐)反应
3、化学性质:
(1)酸的通性:
2CH3COOH +2 Na = 2CH3COONa+H2↑
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑
CH3COOH
Na2CO3
苯酚钠溶液
1.利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
实验装置图1
科学探究P60页
实验装置图2
CH3COOH
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
有气泡生成
溶液变浑浊
CH3COOH
Na2CO3
苯酚钠溶液
CH3COOH
苯酚钠溶液
饱和NaHCO3
Na2CO3
结论:
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-
乙酸易挥发,挥发出来的乙酸也可使苯酚钠转化为苯酚而使溶液浑浊。
比较两种装置的优缺点、并写出反应的化学方程式。
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2
CH3COOH+NaHCO3 CH3COONa+H2O+CO2
CO2+H2O+C6H5ONa C6H5OH+NaHCO3
酸性:CH3COOH>H2CO3
除去挥发出来的乙酸蒸气
酸性:H2CO3>C6H5OH
乙酸 > 碳酸 > 苯酚
结论(酸性强弱):
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
不能
能,不产
生CO2
不能
能
能
增 强
中性
醇、酚、羧酸中羟基的比较
代表物 结构简式 羟基氢的活泼性 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应 与NaHCO3的反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
(2)酯化反应
含氧酸(有机酸或无机酸)和醇(或酚)作用,生成酯和水的反应叫做酯化反应。
浓硫酸作用:催化剂、吸水剂
乙酸乙酯
碎磁片的作用:防止暴沸
方式1:酸脱氢、醇脱羟基
方式2:酸脱羟基、醇脱氢
探究酯化反应可能的脱水方式
----同位素原子示踪法
酯化反应实质:
酸脱羟基醇脱羟基上的氢原子。
C2H5OH + HNO3→C2H5ONO2 + H2O
注:无机含氧酸也可发生酯化反应
(如 H2SO4、HNO3、H3PO4等)
B
1.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
2.酯化反应属于( )
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应
D
练习
苹果酸的结构如下所示,下列相关说法不正确的是( )
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能发生消去反应
D.1 mol苹果酸与Na2CO3溶液反应必须消耗2 mol Na2CO3
D
1、药品混合顺序?浓硫酸的作用是:
2、得到的反应产物是否纯净?
主要杂质有哪些?
3、饱和Na2CO3溶液有什么作用?
4、为什么导管不插入饱和Na2CO3溶液中?
不纯净;主要含乙酸、乙醇。
① 中和乙酸 ② 溶解乙醇。
③ 降低酯在水中的溶解度,以便使酯分层析出。
防止受热不匀发生倒吸。
催化剂、吸水剂
乙醇-浓硫酸-冰醋酸
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提
高乙酸乙酯产率的措施有:
(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
思考和交流(P63页)
*
三、酯
丁酸乙酯
戊酸戊酯
乙酸异戊酯
CH3(CH2)2COOCH2CH3
CH3(CH2)3COO(CH2)4CH3
自然界中的有机酯
*
三、酯
1.定义
2.羧酸分子羟基中的-OH被-OR取代后的产物
1.酸(有机酸、无机酸)跟醇或酚发生酯化反应生成的一类化合物。
2.一般通式:
*
3.饱和一元羧酸酯的通 式:
CnH2nO2
4.酯的物理性质
①低级酯是具有香气味的液体。
②密度比水小。
③难溶于水,易溶于乙醇和乙醚等
有机溶剂。
5.应用:
日常生活中的饮料,糖果和糕点等使用脂类香料。
*
探究乙酸乙酯在中、酸、碱性溶液下的水解速度
探究酯的水解
无变化
层厚减小,快
层厚减少多,较快
1、酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
2、温度越高,酯水解程度越大。
(水解反应是吸热反应)
不加热
加热
层厚稍有减少,慢
环境 中性 酸性
加热 碱性
加热
相同时间内酯层消失速度
结论
*
6、化学性质(水解反应或取代反应)
乙酸乙酯的水解
CH3COOH+NaOH=CH3COONa+H2O
*
酯化反应和水解反应的比较
NaOH中和酯水解生成的CH3COOH,提高酯的水
解率
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应
取代反应
水解反应
取代反应
酯化
水解
酯 化 水 解
反应关系
催 化 剂
催化剂的
其他作用
加热方式
反应类型
1.胆固醇是人体必需的生物活性物质,分子式为C27H46O 。一种胆固醇酯的液晶材料,分子式为C34H50O2 。合成这种胆固醇酯的羧酸是
( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C3H7COOH
B
2、1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol
C.3mol D.2mol
B
*
课堂巩固
1.对有机物
的叙述不正确的是 ( )
A.常温下能与Na2CO3反应放出CO2
B. 0.5mol该有机物与NaOH溶液完全反应,消耗NaOH 4mol
C.与稀H2SO4共热生成两种 有机物
D.该物质的化学式为C14H10O9
C
2、 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如右图:
下列对该化合物叙述正确的是( )
A 属于芳香烃
B 属于卤代烃
C 在酸性条件下不水解
D 在一定条件下可以发生加成反应
D
