华师大版科学八年级上册 第6章 物质的构成 章节复习(学案 无答案)
文档属性
| 名称 | 华师大版科学八年级上册 第6章 物质的构成 章节复习(学案 无答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 211.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-08-04 00:00:00 | ||
图片预览




文档简介
初中科学
教师
班级
学生
日期:
上课时间:
主课题:物质的构成与分类
教学目标:
知道构成物质的三种微粒
了解原子的构成
知道物质由元素组成
知道元素符号,以及化合价和化学式
知道物质的分类
教学重难点:
原子结构理解
用化学式推化合价
区分物质的分类
教学方法:寓学于乐,让学生在比较轻松的氛围之下学习,自然而然的掌握好知识点
教学内容
【同步检测】
1.在化学变化中可分的微粒是( )
A.原子 B.分子 C.质子 D.原子核
2.参考下列物质的微观结构图示,其中由阴、阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
3.下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
C.分子、原子、离子都可以直接构成物质
D.在化学反应中,任何离子都不能再分
4.构成原子核不可少的微粒是( )
A.原子 B.中子 C.质子 D.电子
5.下列有关化合价的说法中,正确的是( )
A.在NaCl和HCl里,氯元素均为-1价
B.在H2中,氢元素显+1价
C.一种元素在同一种化合物里,只能显相同的化合价
D.非金属元素在化合物里,一定显负价
6.上海建成了我国第一条磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。高温超导物质(Y2Ba4Cu6O13)是以YmOn、BaO和CuO为原料,经研磨烧结而成,此过程中所有元素的化合价均不变,则高温超导物质(Y2Ba4Cu6O13)中Y元素的化合价是( )
A.+2 B.+3 C.+4 D.+5
7.下列各组物质中,带点的同种元素的化合价相同的是( )
A.Cl2;NaCl B.NH4Cl;HNO3
C.MnO2;K2MnO4 D.P2O5;Ca3(PO4)2
8.下列化学式正确的是( )
A.高锰酸钾(K2MnO4) B.氧化镁(MgO2)
C.氯化钾(KClO3) D.氯化亚铁(FeCl2)
9.分类是学习和研究物质的一种常见的方法,下列物质的分类正确的是( )
A.氮气中只含氮元素,属于单质 B.氯酸钾中含有氧元素,属于氧化物
C.硫酸钠中含有硫酸根离子,属于酸 D.碳酸中含有碳元素,属于有机物
10.下列各组物质中,前一种属于混合物,后一种属于单质的是( )
A.医用生理盐水、不锈钢 B.天然气、煤
C.自来水、水银 D.胆矾(CuSO4·5H2O)、镁
11.“加碘盐”是指在食盐中加入一定量的碘酸钾(KIO3),则碘酸钾属于( )
A.混合物 B.化合物 C.氧化物 D.单质
【知识精讲】
1、物质的粒子
1.物质都是由微观粒子构成的,构成物质的微粒有 、 和 。分子是保持物质 的一种微粒。原子是 中的最小的微粒;离子是带电的 或 ,有阴、阳离子之分。
2.分子和原子的质量和体积都很小,大多数分子和原子的质量在 千克的数量级;原子的半径一般在 米的数量级。不同种类的原子质量不同,体积也不同。
2、原子的构成
原子由一个居中心的带 电荷的 与核外带 电荷的 构成的,原子核由带 电的 和不带电的 构成;质子和中子由 构成。原子核所带的电荷和核外电子所带的电荷数目 ,但电性 ,整个原子不显电性。原子核在整个原子中所占的体积很小,但原子的质量主要集中在 上。
在原子内,核电荷数= 数= 数。
3、原子结构模型的发展过程
1. 原子模型(1803年)——实心球模型(从现在的观点看都不正确)
2. 原子模型(1904年)——西瓜模型(汤姆生发现原子中有 ,带负电)
3. 原子模型(1911年)—— 模型(α粒子散射实验:原子核的存在)
4. 原子模型(1913年)—— 模型(电子能量不同,分布在不同的轨道中)
5.电子云模型(1927年—1935年)
从原子结构模型建立的过程,我们可以发现建立模型往往需要有一个不断完善、不断修正的过程,以使模型更接近事物的本质。
4、物质由元素组成
1.元素的概念:具有相同 数( 数)的同一类原子的总称。
比一比 元素和原子的区别与联系
元素
原子
定义
具有相同 (即 )
的同一类原子的总称。
化学变化中的最小微粒。
数量
只讲 ,不论 。
既讲种类,又论个数。
领域
用于描述物质的 组成。
如:水由 和 组
成。
用于描述物质的 构成。
如:铜由 构成,也描述分子的构成,如:水分子
是由 和 构成。
联系
元素是 原子的总称;原子是构成元素的基本单元。
2.元素在自然界中的分布是不均匀的
(1)元素在地壳中的分布从高到低依次是: 、Ca、Na、K、Mg。
(2)元素在人体中的分布从高到低依次是: 等(人体内也含有一些有害元素,如镉、汞、铅等)。
(3)元素在海水中的分布从高到低依次是: 、Na、Cl。
(4)植物生长需要多种元素,其中需要量最大的是含 元素的无机盐。农业上常用的化肥是 肥、 肥、
肥。
辨一辨
(1)能促使农作物的茎、叶生长茂盛,含有组成叶绿素的重要元素—— 肥。
(2)促使农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多,籽粒饱满—— 肥。
(3)促使农作物生长旺盛,茎秆粗壮,增强抗病虫害的能力,促使糖和淀粉的积累—— 肥。
5、元素符号
1.元素符号的表示方法
用该元素的拉丁文的 来表示,若有重复则取前两个字母,第二个字母小写。
2.元素符号表示的含义
(1)(宏观)表示一种 ;
(2)(微观)表示这种元素的 ;
(3)(宏观)由原子直接构成的物质,还可以表示这种 。
3. 常见元素符号
⑴ 字母单个元素:
氢 H 碳 C 氮 N 氧 O 氟 F 磷 P 硫 S 钾 K
碘 I
⑵ 读音双个元素:
钠 Na 锂 Li
⑶ 无规律类双个元素:
氦 He 氖 Ne 镁 Mg 铝 Al 硅 Si 氯 Cl 氩 Ar 钙 Ca
锰 Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au
贡 Hg
⑷ 常见气体元素:
氢气 H H2 氮气 N N2 氧气 O O2 臭气 O O3 氦气 He 氖气 Ne
氩气 Ar 氯气 CI CI2
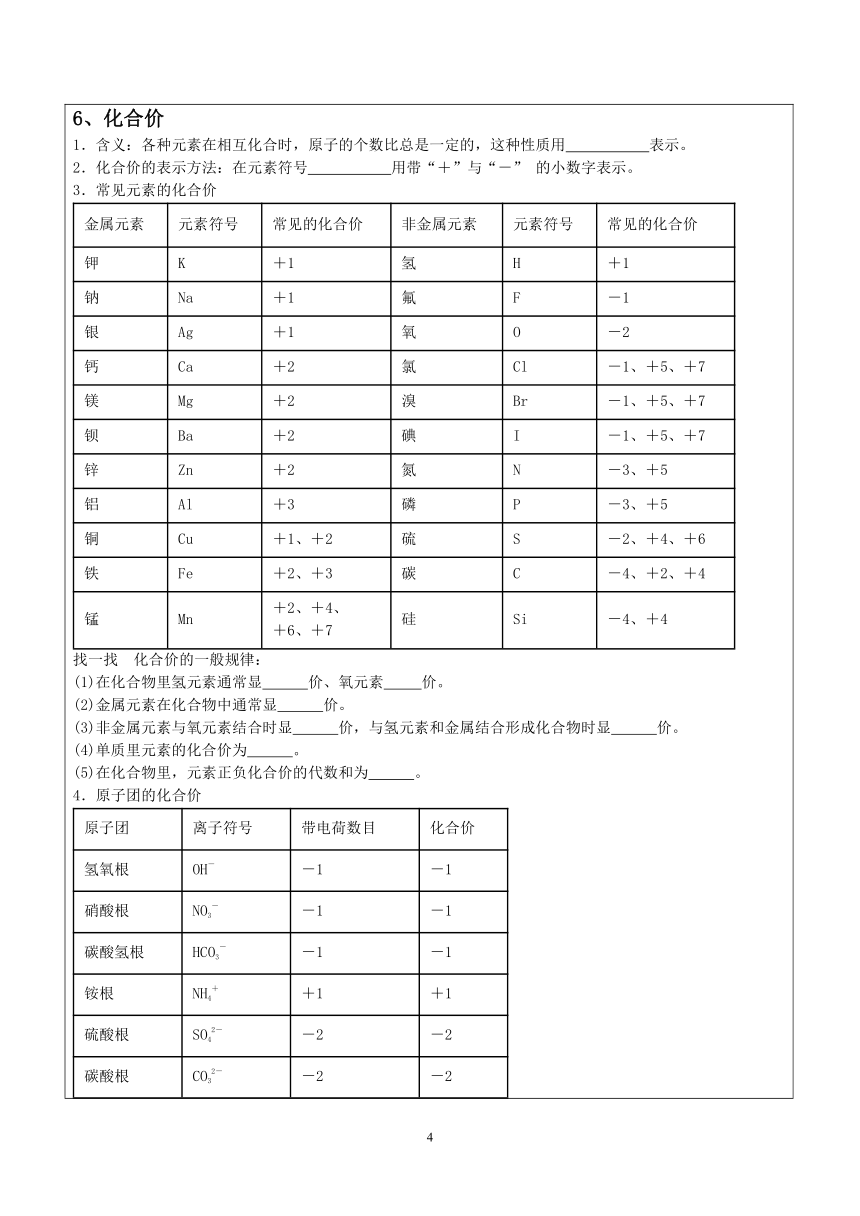
6、化合价
1.含义:各种元素在相互化合时,原子的个数比总是一定的,这种性质用 表示。
2.化合价的表示方法:在元素符号 用带“+”与“-” 的小数字表示。
3.常见元素的化合价
金属元素
元素符号
常见的化合价
非金属元素
元素符号
常见的化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氟
F
-1
银
Ag
+1
氧
O
-2
钙
Ca
+2
氯
Cl
-1、+5、+7
镁
Mg
+2
溴
Br
-1、+5、+7
钡
Ba
+2
碘
I
-1、+5、+7
锌
Zn
+2
氮
N
-3、+5
铝
Al
+3
磷
P
-3、+5
铜
Cu
+1、+2
硫
S
-2、+4、+6
铁
Fe
+2、+3
碳
C
-4、+2、+4
锰
Mn
+2、+4、
+6、+7
硅
Si
-4、+4
找一找 化合价的一般规律:
(1)在化合物里氢元素通常显 价、氧元素 价。
(2)金属元素在化合物中通常显 价。
(3)非金属元素与氧元素结合时显 价,与氢元素和金属结合形成化合物时显 价。
(4)单质里元素的化合价为 。
(5)在化合物里,元素正负化合价的代数和为 。
4.原子团的化合价
原子团
离子符号
带电荷数目
化合价
氢氧根
OH-
-1
-1
硝酸根
NO3-
-1
-1
碳酸氢根
HCO3-
-1
-1
铵根
NH4+
+1
+1
硫酸根
SO42-
-2
-2
碳酸根
CO32-
-2
-2
亚硫酸根
SO32-
-2
-2
磷酸根
PO43-
-3
-3
7、化学式
1.含义:用 来表示物质组成的式子,叫化学式。物质的组成是固定的,是经过由实验确定的,因此化学式也是固定的。而且一种物质只有一个化学式,以客观事实为基础,不能随意写出。
2.化学式所表示的含义(以H2O为例)
(1)宏观:表示 ;表示水由 组成的,水中氢元素和氧元素的质量比为 ;
(2)微观:表示一个 ;表示一个水分子中由 和 构成;
(3)水分子相对分子质量: ;
(4)若在化学式前加一系数,如“2H2O”,则表示 , 失去宏观意义。
3.常见氧化物
水
H2O
三氧化硫
SO3
一氧化碳
CO
二氧化碳
CO2
五氧化二磷
P2O5
过氧化氢
H2O2
二氧化氮
NO2
二氧化硫
SO2
氧化钙
CaO
氧化亚铁
FeO
氧化铁
Fe2O3
四氧化三铁
Fe3O4
氧化镁
MgO
氧化锌
ZnO
二氧化锰
MnO2
氧化汞
HgO
氧化铝
Al2O3
氧化铜
CuO
8、根据化学式的计算
1.相对原子质量以 作为标准,其他原子的质量与这个标准进行比较,所得的 就是该元素原子的相对原子质量。相对原子质量是一个比值,不是原子的真正质量,通. 常取整数。
2.相对分子质量
一个分子中各原子的 总和。
3.求化合物中各元素的质量比(以H2SO4为例):H∶S∶O= 。
4.求化合物中某元素的质量分数(以求(NH4)2SO4中氮元素的质量
分数为例):(NH4)2SO4中氮元素的质量分数 =×100%≈212%。
9、物质的分类
1.纯净物:由 组成(只有 种分子)的物质。
2.混合物:由 组成(分子有 种)的物质。
3.单质:由 组成的纯净物。
4.化合物:由 组成的纯净物。
5.氧化物:由 种元素组成,其中有一种元素是 元素的化合物。
10、纯净物和混合物
1.纯净物和混合物的比较
纯净物
混合物
宏观
由 组成
由 组成
微观
由 构成(由分子构成的物质)
由 构成(由分子构成的物质)
特征
一定条件下,有固定的
.
无固定 .
可用 表示
不能用 表示
2.混合物分离方法
过滤
蒸发
适用范围
适于分离固体和液体混合物或 固体和
固体混合物
适用于将
从溶液中分离出来
原理
根据 不同,固体留在滤纸上,滤液通过滤纸过滤到烧杯中
根据 不同,液体蒸发而固体留在蒸发皿中
主要操作
溶解、
3.过滤法应注意事项:
一贴、二低、三靠。
(1)一贴:滤纸紧贴 。
(2)二低:滤纸边缘 漏斗边缘;漏斗内液面 滤纸边缘。
(3)三靠:漏斗末端紧靠 ;玻璃棒轻靠 一边;烧杯尖嘴轻靠 。
4.粗盐的提纯实验步骤及玻璃棒的作用
步 骤
玻璃棒的作用
1. .
2. .
3. .
4. .
11、单质和化合物
1.单质和化合物的比较
单质和化合物的共同点:单质和化合物都属于 。
单质和化合物的区别:单质是由 组成的纯净物,而化合物是由 组成的纯净物。
(一)、例题分析
例1化学是研究物质组成、结构、性质及其变化规律的基础自然科学,请回答: (1)从组成角度看:氯化钠是由 组成. (2)从微粒角度看:氯化钠是由 构成(用微粒符号表示). (3)从制备角度看:将海水进行 可得到粗盐.
例2如图是某种汽车尾气处理装置中发生化学反应的微观示意图:
请回答下列问题: (1)标出氨分子中氮原子的化合价 . (2)水分子中氧元素的质量百分含量为 .(保留一位小数) (3)简述汽车尾气中氮的氧化物形成的原因 .
例3按照一定的依据把物质分类,是认识物质的组成、结构、性质和用途的捷径.现有物质:①硫酸溶液?②氢氧化钠?③氯化钙?④氧化铜?⑤锌粒.请按照要求填写:属于混合物的是
(填写序号),属于单质的是 (填写序号),氧化铜中铜元素的化合价是 价.
例4松油醇(C10H18O)是一种调香香精,多存在于松节油、芳樟油、玉树油、橙花油中.请回答: (1)松油醇中氢元素和氧元素的质量比是 ; (2)松油醇的相对分子质量是 ; (3)15.4g松油醇所含碳元素质量与 g葡萄糖(C6H12O6)所含碳元素质量相等.
例5下列有关计算结果错误的是( )
A.K2Cr2O7中Cr元素的化合价为+6价
B.NH4NO3中氮元素的质量分数为35%
C.C2H4与C4H8中碳元素和氢元素的质量比相同,均为6:2
D.已知20℃时,NaCl的溶解度为36g,据此计算出该温度下其饱和溶液的质量分数约为26.5%
例6元素周期表是学习和研究化学的重要工具,根据图,判断错误的是( )
H
?
He
?
?
?
?
?
X
?
?
?
?
?
?
?
Y
Z
?
A.铊元素属于金属元素 B.铊元素的核内质子数为81
C.Z的原子序数大于Y D.X和Y处于同一周期
例7用分子的性质解释下列生活中的现象,其中不正确的是( )
A.墙内开花墙外可嗅到花香,说明分子在不停地运动
B.湿衣服在阳光下比在阴凉处易于晾干,说明分子运动速率随温度升高而加快
C.将l00mL水与l00mL酒精混合,体积小于200mL,说明分子间有间隔
D.水由液态变成气态,体积膨胀,说明水分子体积变大
例8我国南海海底发现的巨大“可燃冰”带,能源总量估计相当于中国石油总量的一半,而我国东海“可燃冰”的蕴藏量也很可观….“可燃冰”的主要成分是一水合甲烷(CH4?H2O)晶体,则水合甲烷属于( )
A.混合物 B.氧化物 C化合物 D.单质
例9某金属元素R,它的氢氧化物的相对分子质量为m,它的氯化物的相对分子质量为n。则该金属元素R的化合价为?
(二)、当堂检测
1.一种元素跟另一种元素之间的最本质的不同点是( )
A.质子数 B.中子数 C.电子数 D.相对原子质量
2.下列元素符号书写正确的是( )
A.MN B.CA C.mg D.Zn
3.某元素氧化物的化学式为M2O3(M化合价不变化),则下列化学式中错误的是( )
A.MCl3 B.MSO4 C.M2(SO4)3 D.M(OH)3
4.某同学认为“O2”表示的意义有以下几种说法:
①表示氧元素 ②表示氧气这种物质 ③表示1个氧分子 ④表示2个氧原子 ⑤表示氧气是一种无色气体 ⑥表示1个氧分子里有2个氧原子。其中正确的是( )
A.②④⑤ B.②③⑥ C.②③④⑤ D.②③⑤⑥
5.用“”表示氢原子、“”表示氧原子。下列方框中,符合“2H2O”所表示的意义的是( )
6.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A.O B.Zn C.N2 D.CO
7.在化学世界里没有生命的阿拉伯数字也变得鲜活起来,它们在不同的位置表示着不同的含义。下列化学符号中数字“2”表示的意义正确的是( )
A.Mg2+:一个镁离子带2个单位正电荷
B.CO2:二氧化碳分子中含有氧原子
C.2H∶2个氢元素[来源:学科网]
D.:氧化钙的化合价为+2价
8.下图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是( )
9.汽水中含二氧化碳(CO2)、水(H2O)。关于这两种物质的类别,下列说法正确的是( )
A.都是金属单质 B.都是非金属单质 C.都是氧化物 D.都是碱
10.下列各组中,前者是单质,后者是氧化物的是( )
A.尿素、赤铁矿石 B.金刚石、干冰 C.液氧、氯酸钾 D.汞、碘酒
11.当二氧化硫与三氧化硫中氧元素的质量比为5:6时,则SO2与SO3的质量比为 ?
【课后练习】
1.下列各组元素符号的第一个字母相同的是( )
A.氢、氧、汞 B.铜、氯、碳 C.镁、银、汞 D.镁、锰、钠
2.下列符号所表示的元素全部为金属元素的是( )
A.Fe、Zn、Cl B.Al、Si、Ca C.Mg、Cu、Hg D.S、P、C
3.已知某元素的原子与碳-12原子的质量比为9,则该元素原子的相对原子质量为( )
A.108 B.1.33 C.108克 D.1.33克
4.下列相对分子质量计算正确的是( )
A.NO2:相对分子质量=14×16×2=448 B.2NH3:相对分子质量总和=2×14+1×3=31
C.O2:相对分子质量=16×2=32克 D.2CO2:相对分子质量总和=2×(12+16×2)=2×44=88
5.下列各组物质中,相对分子质量相等的是( )
A.N2和CO B.H2S和O2 C.SO2和O2 D.NH3和CH4
6.下列每组物质中,它们的名称、俗名、化学式和所属的物质类别都正确的一组是( )
名称
俗名
化学式
物质分类
A
碳酸钠
纯碱
NaCO3
碱
B
汞
水银
Hg
单质
C
氢氧化钠
苛性碱
NaOH
氧化物
D
氧化钙
熟石灰
CaO
盐
7.下列说法,不正确的是( )
A.纯净物一定由同种分子构成 B.混合物一定由不同种元素组成
C.含氧的化合物不一定是氧化物 D.同种元素组成的物质不一定是单质
8.下表中1、2、3各项之间能构成下图包含关系的是( )
编号
选项
1
2
3
A
金属
水银
合金
B
单质
化合物
纯净物
C
溶液
乳浊液
悬浊液
D
水
氧化物[来源.m
化合物
9.关于粗盐提纯的说法正确的是( )
A.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
B.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
C.当蒸发到剩有少量液体停止加热,利用余热蒸干
D.制得的晶体转移到新过滤器中用大量水进行洗涤
10.下列有关玻璃棒在“粗盐提纯”实验中,操作错误的是( )
A.捣碎研细 B.搅拌溶解 C.引流浊液 D.搅拌防溅
11.与n个硫酸分子中所含氧原子个数相等的是( )
A.n个CO2分子 B.4n个水分子 C.4n个氧气分子 D.2n个硝酸分子
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
