必修一 第一章 第二节 化学计量在实验中的应用(48张)
文档属性
| 名称 | 必修一 第一章 第二节 化学计量在实验中的应用(48张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1012.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-05 00:00:00 | ||
图片预览











文档简介
(共49张PPT)
必修1·第一章
9月13日,浙江省温州一家手机店里来了一位“神秘”男子,张口就要买5部苹果5S“土豪金”手机。只见男子突然扛来3个麻袋,里面倒出了一捆一捆的钱,全是5毛钱纸币,足足有好几十捆。“就用这些钱买手机。”神秘男子的话让店内所有人顿时都“石化”了。
温州男子提3麻袋5毛钱买iPhone土豪金 把老板吓懵
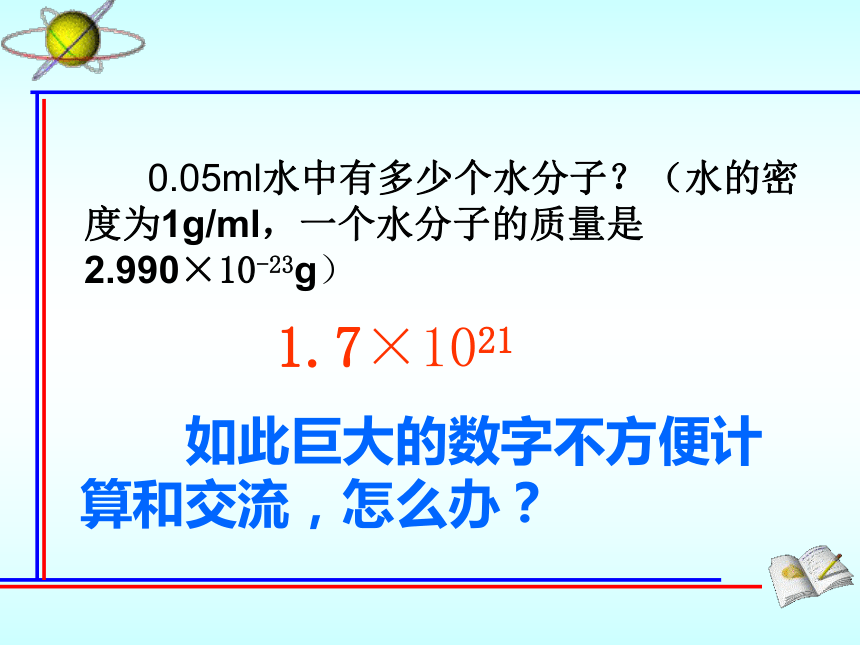
0.05ml水中有多少个水分子?(水的密度为1g/ml,一个水分子的质量是2.990×10-23g)
1.7×1021
如此巨大的数字不方便计算和交流,怎么办?
一、物质的量(n)
定义: 表示含有一定数目粒子的集体,是计量微观粒子数目的物理量。
示例:
n(H2O): 水分子的物质的量
(√)
(×)
(×)
(×)
(×)
水分子的量
水分子的质量
水分子的物质量
水分子的物质的质量
专有名词
国际上规定1mol粒子集体所含的粒子数与 0.012 kg12C中所含的碳原子数相同,约为6.02×1023个。
6.02×1023
一定数目
1molH2O中含有 个水分子。
6.02×1023
18gH2O
6.02×1023个水分子
1molH2O
27gAl
6.02×1023个铝原子
1molAl
图1—11 1mol物质的质量及所含粒子数
让我们一起来感受一下:
①如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次
②如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
所以物质的量只用来表示原子、分子、离子等微观粒子。
为什么不用于宏观物质?
使用范围
1mol小麦粒含有6.02×1023个麦粒。这句话是否正确?
不正确,麦粒是宏观物质。
(1)× (2)×
(3)√ (4)√
思考?下列说法是否正确:
(1)1mol大豆 (2)1mol氢
(3)1molH (4)1摩氮气分子
阿伏加德罗常数
判断正误:
NA通常用6.02×1023mol-表示;
6.02×1023叫做阿伏加德罗常数;
NA的数值约等于6.02×1023;
含有阿伏加德罗常数个微粒的物质是1mol。
(×)
(√)
(√)
(√)
算一算
1molO中含有多少个O?
2molH2O含有多少个H2O?
0.5molNa+含有多少个Na+ ?
1mol × 6.02×1023mol- = 6.02×1023
2mol × 6.02×1023mol- = 1. 204×1024
0.5mol×6.02×1023mol- = 3.01×1023
n
×
NA
=
N
请根据上述说明回答下列问题:
(1)1molO2的分子数为:_______ _;
(2)1.5molSO2的分子数为 __________;
(3)3.01×1023个H2O的物质的量是_______mol,其中H原子的物质的量是_______,原子数是 ;
(4)3molOH-约含有 mol质子,
个电子。
6.02×1023个
9.03×1023个
0.5
6.02×1023个
1mol
1.806×1025
27mol
推导
已知 N(H2)=3.01×1023个
N(O2)=6.02×1023个
求:n(H2):n(O2)=?
结论:微粒的数目之比等于其物质的量
之比
试一试
物质的量的应用
C + O2 CO2
点燃
质量比
12g ∶ 32g ∶ 44g
粒子数比
1 ∶ 1 ∶ 1
物质的量比
1mol ∶ 1mol ∶ 1mol
物质的量的应用
课堂习题
1.“物质的量”是指( )
A.物质的质量 C.物质的质量与微观粒子数
B.物质的微观粒子数 D.计量微观粒子数目的物理量
2.下列说法中正确地是( )
A.1 mol氧 B.1 molH2SO4 C.1 mol米 D.1 mol面粉
3.在1 molH2O中( )
A.含1 molH B.含6.02×1023个氢原子 C.含6.02×1023个水分子 D.含3.01×1023个氧原子
B
C
D
4.在0.5 molNa2SO4中,含有的Na+数约为( )
A.3.01×1023 B.6.02×1023 C.0.5 D. 1
5.1 mol下列气体中所含原子数最多的是( )
A.H2 B.CO2 C.CH4 D.O2
6.下列说法中正确的是(NA代表阿伏加德罗常数) ( )
A.1 molN2和1molCO所含的分子数都是NA
B.1 molH2和1molCO2所含的原子数都是NA
C.1 molCO和1molCO2所含的氧原子数都是NA
D.1 molH2SO4和1molH3PO4所含的原子数都是4NA
B
C
A
1.含有1.204×1023个电子的OH-的物质的量是多少?
作业:
2.0.5mol Al2(SO4)3与0.4molH2SO4物质的量之比为 ,所含分子数目之比为 ,所含硫酸根数目之比为 .
1molH2O中含有 个水分子。
6.02×1023
引入摩尔质量
1molAl中含有 个铝原子。
6.02×1023
请找出1mol物质的质量有什么规律
O Al H2 H2O
一个分子或原子的质量 2.657×
10-23g 4.485×
10-23g 3.294×
10-24g 2.990×
10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量 16 27 2 18
1mol物质
的质量 16 g 27g 2g 18g
1mol任何粒子或物质的质量以g为单位时,数值上都与其相对分子质量(或相对原子质量)相等。
发现规律
⑴1molCu质量是 ;
⑵1molO2质量是___ ;
⑶1molNa+质量是 ;
⑷1molNaCl质量是 .
64g
32g
23g
58.5g
摩尔质量
Fe的摩尔质量是:
水的摩尔质量是:
NaCl的摩尔质量是:
OH-的摩尔质量是:
56 g · mol-1
18 g · mol-1
58.5 g · mol-1
17 g · mol-1
相对原子质量:Fe 56;H 1;O 16;
Na 23;Cl 35.5.
3、NA个氧原子的质量为16g。 ( )
1、摩尔质量就是该物质的的相对分子质量或相对原子质量( )
4、Na+的摩尔质量是23 ( )
不对
不对
对
2、 NA个水分子的质量即水的摩尔质量。( )
不对
理解概念
1mol H2O的质量是多少?
2mol H2O的质量是多少?
M、m、n的关系
相对原子质量:H 1;O 16.
(1)2molFe的质量是_________。
(2)24.5克H2SO4的物质的量是_______。
112g
0.25mol
3mol H2O的质量是多少?
(3)3.01 ×1022个OH- 的物质的量为
,质量为 。
0.05mol
0.85g
N,n,m之间的相互转化
例:4. 9 g硫酸里含有多少个硫酸分子?
解: 硫酸的相对分子质量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4) =
0.05 mol×6.02×1023/mol
= 3.01×1022
先公式、后数字;标明每一个量的所属;带单位计算。
m (H2SO4)
M(H2SO4)
=
n (H2SO4) ×
NA
=
(1)求1.204×1023 个 SO2 的质量。
(2)求 32g SO2 中氧原子的个数。
作业(计算题)
1、等物质的量的 SO2 和 SO3 相比较,下列结论中错误的是
A、它们的分子数之比为 1 :1
B、它们所含氧原子数目之比为 2 :3
C、它们的质量之比为 1 :1
D、它们所含原子数目之比为 3 :4
√
练习
2、等质量的SO2和SO3中硫原子的物质
的量之比是 。
5∶4
A、6 g H2
B、0 . 5 mol CO2
C、1 . 204×10 24 个HCl 分子
D、147 g H2SO4
E、92 g C2H5OH(乙醇)
A
A
E
D
电解水实验
仔细观察现象,注意两极产生气体的量!
V(H2 ) :V(O2) =2:1
计算验证
2H2O
2H2
+
O2
通电
相对原子/分子质量
2×18 2×2 32
质量
物质的量
0.1mol 0.05mol
1.8g
0.2g 1.6g
初步结论:相同温度和压强下,1molH2
和1molO2的体积 。
表1.根据现象和推算得初步结论
相同
n(H2 ) :n(O2) =2:1
质量 物质的量 H2和O2的物质的量之比
H2 0.2g 0.1mol
O2 1.6g
0.05mol
22.4
22.4
表2. 1mol气体在标准状况下的体积
(标准状况:温度为0℃,压强为101KPa)
[结论] 在标准状况下,1mol任何气体所占的体积 L。
都约为22.4
物质名称 物质的量
mol 摩尔质量
g?mol-1 密度
g?L-1 体积
L
H2 1 2.016 0.0899
O2 1 32.00 1.429
7.2
10
18
53.6
表3. 1mol固,液体的体积
(V=m/ρ)
[结论] 相同条件下,1摩尔不同固体或液体物质的体积是 的。
不相同
物质
名称 状态 物质的量
mol 摩尔质量
g?mol-1 密度
g?cm-3 体积
cm3
Fe 固 1 56 7.8
Al 固 1 27 2.7
H2O 液 1 18 1
H2SO4 液 1 98 1.83
固体 Fe
液态水
铁原子
水分子
气体CO2
CO2分子
固体. 液体 .气体分子之间距离比较示意图
0.4 nm
4 nm
气体分子
气体的体积受温度、压强的影响很大.
压强变大
间距变小
体积变小
温度变大
间距变大
体积变大
只有在同温同压下,相同物质的量的不同气体才具有相同的体积。
1. 标准状况,1molH2O的体积约是22.4L。
错,水是液体
2. 1mol气体的体积约为22.4L。
(错,标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体 所含的分子数。
(错,未指明是否在相同条件)
5. 标准状况下,气体的摩尔体积都是22.4L。
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
(错,“约为”;单位应为L/mol)
判断正误
阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
8.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)分子数之比为 ;
(2)原子数之比为 ;
(3)物质的量之比为 ;
(4)摩尔质量之比为 ;
(5)质量之比为 ;
1:2
3:4
1:2
11:7
11:14
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
阿伏伽德罗定律推论
9.同温同压下,下列密度相同的气
体组是 ( )
A、CO、N2 B、NO、CH4
C、C2H4、NO D、SO2、Cl2
A
10.将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是 ( ) A、P(H2)=P(O2)=P(N2)
B、P(H2)>P(N2)>P(O2) C、P(H2)>P(O2) >P(N2)
D、P(N2)>P(O2) >P(H2)
B
11.同温同压下,等质量的SO2气体和CO2气体相比较,下列叙述中,正确的是( )
A、体积比为1:1 B、体积比为11:16
C、密度比为16:11 D、密度比为11:16
BC
计算题:标况下,6.72 L CO2气体的物质的量是多少?质量是多少?
作业
必修1·第一章
9月13日,浙江省温州一家手机店里来了一位“神秘”男子,张口就要买5部苹果5S“土豪金”手机。只见男子突然扛来3个麻袋,里面倒出了一捆一捆的钱,全是5毛钱纸币,足足有好几十捆。“就用这些钱买手机。”神秘男子的话让店内所有人顿时都“石化”了。
温州男子提3麻袋5毛钱买iPhone土豪金 把老板吓懵
0.05ml水中有多少个水分子?(水的密度为1g/ml,一个水分子的质量是2.990×10-23g)
1.7×1021
如此巨大的数字不方便计算和交流,怎么办?
一、物质的量(n)
定义: 表示含有一定数目粒子的集体,是计量微观粒子数目的物理量。
示例:
n(H2O): 水分子的物质的量
(√)
(×)
(×)
(×)
(×)
水分子的量
水分子的质量
水分子的物质量
水分子的物质的质量
专有名词
国际上规定1mol粒子集体所含的粒子数与 0.012 kg12C中所含的碳原子数相同,约为6.02×1023个。
6.02×1023
一定数目
1molH2O中含有 个水分子。
6.02×1023
18gH2O
6.02×1023个水分子
1molH2O
27gAl
6.02×1023个铝原子
1molAl
图1—11 1mol物质的质量及所含粒子数
让我们一起来感受一下:
①如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次
②如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
所以物质的量只用来表示原子、分子、离子等微观粒子。
为什么不用于宏观物质?
使用范围
1mol小麦粒含有6.02×1023个麦粒。这句话是否正确?
不正确,麦粒是宏观物质。
(1)× (2)×
(3)√ (4)√
思考?下列说法是否正确:
(1)1mol大豆 (2)1mol氢
(3)1molH (4)1摩氮气分子
阿伏加德罗常数
判断正误:
NA通常用6.02×1023mol-表示;
6.02×1023叫做阿伏加德罗常数;
NA的数值约等于6.02×1023;
含有阿伏加德罗常数个微粒的物质是1mol。
(×)
(√)
(√)
(√)
算一算
1molO中含有多少个O?
2molH2O含有多少个H2O?
0.5molNa+含有多少个Na+ ?
1mol × 6.02×1023mol- = 6.02×1023
2mol × 6.02×1023mol- = 1. 204×1024
0.5mol×6.02×1023mol- = 3.01×1023
n
×
NA
=
N
请根据上述说明回答下列问题:
(1)1molO2的分子数为:_______ _;
(2)1.5molSO2的分子数为 __________;
(3)3.01×1023个H2O的物质的量是_______mol,其中H原子的物质的量是_______,原子数是 ;
(4)3molOH-约含有 mol质子,
个电子。
6.02×1023个
9.03×1023个
0.5
6.02×1023个
1mol
1.806×1025
27mol
推导
已知 N(H2)=3.01×1023个
N(O2)=6.02×1023个
求:n(H2):n(O2)=?
结论:微粒的数目之比等于其物质的量
之比
试一试
物质的量的应用
C + O2 CO2
点燃
质量比
12g ∶ 32g ∶ 44g
粒子数比
1 ∶ 1 ∶ 1
物质的量比
1mol ∶ 1mol ∶ 1mol
物质的量的应用
课堂习题
1.“物质的量”是指( )
A.物质的质量 C.物质的质量与微观粒子数
B.物质的微观粒子数 D.计量微观粒子数目的物理量
2.下列说法中正确地是( )
A.1 mol氧 B.1 molH2SO4 C.1 mol米 D.1 mol面粉
3.在1 molH2O中( )
A.含1 molH B.含6.02×1023个氢原子 C.含6.02×1023个水分子 D.含3.01×1023个氧原子
B
C
D
4.在0.5 molNa2SO4中,含有的Na+数约为( )
A.3.01×1023 B.6.02×1023 C.0.5 D. 1
5.1 mol下列气体中所含原子数最多的是( )
A.H2 B.CO2 C.CH4 D.O2
6.下列说法中正确的是(NA代表阿伏加德罗常数) ( )
A.1 molN2和1molCO所含的分子数都是NA
B.1 molH2和1molCO2所含的原子数都是NA
C.1 molCO和1molCO2所含的氧原子数都是NA
D.1 molH2SO4和1molH3PO4所含的原子数都是4NA
B
C
A
1.含有1.204×1023个电子的OH-的物质的量是多少?
作业:
2.0.5mol Al2(SO4)3与0.4molH2SO4物质的量之比为 ,所含分子数目之比为 ,所含硫酸根数目之比为 .
1molH2O中含有 个水分子。
6.02×1023
引入摩尔质量
1molAl中含有 个铝原子。
6.02×1023
请找出1mol物质的质量有什么规律
O Al H2 H2O
一个分子或原子的质量 2.657×
10-23g 4.485×
10-23g 3.294×
10-24g 2.990×
10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量 16 27 2 18
1mol物质
的质量 16 g 27g 2g 18g
1mol任何粒子或物质的质量以g为单位时,数值上都与其相对分子质量(或相对原子质量)相等。
发现规律
⑴1molCu质量是 ;
⑵1molO2质量是___ ;
⑶1molNa+质量是 ;
⑷1molNaCl质量是 .
64g
32g
23g
58.5g
摩尔质量
Fe的摩尔质量是:
水的摩尔质量是:
NaCl的摩尔质量是:
OH-的摩尔质量是:
56 g · mol-1
18 g · mol-1
58.5 g · mol-1
17 g · mol-1
相对原子质量:Fe 56;H 1;O 16;
Na 23;Cl 35.5.
3、NA个氧原子的质量为16g。 ( )
1、摩尔质量就是该物质的的相对分子质量或相对原子质量( )
4、Na+的摩尔质量是23 ( )
不对
不对
对
2、 NA个水分子的质量即水的摩尔质量。( )
不对
理解概念
1mol H2O的质量是多少?
2mol H2O的质量是多少?
M、m、n的关系
相对原子质量:H 1;O 16.
(1)2molFe的质量是_________。
(2)24.5克H2SO4的物质的量是_______。
112g
0.25mol
3mol H2O的质量是多少?
(3)3.01 ×1022个OH- 的物质的量为
,质量为 。
0.05mol
0.85g
N,n,m之间的相互转化
例:4. 9 g硫酸里含有多少个硫酸分子?
解: 硫酸的相对分子质量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4) =
0.05 mol×6.02×1023/mol
= 3.01×1022
先公式、后数字;标明每一个量的所属;带单位计算。
m (H2SO4)
M(H2SO4)
=
n (H2SO4) ×
NA
=
(1)求1.204×1023 个 SO2 的质量。
(2)求 32g SO2 中氧原子的个数。
作业(计算题)
1、等物质的量的 SO2 和 SO3 相比较,下列结论中错误的是
A、它们的分子数之比为 1 :1
B、它们所含氧原子数目之比为 2 :3
C、它们的质量之比为 1 :1
D、它们所含原子数目之比为 3 :4
√
练习
2、等质量的SO2和SO3中硫原子的物质
的量之比是 。
5∶4
A、6 g H2
B、0 . 5 mol CO2
C、1 . 204×10 24 个HCl 分子
D、147 g H2SO4
E、92 g C2H5OH(乙醇)
A
A
E
D
电解水实验
仔细观察现象,注意两极产生气体的量!
V(H2 ) :V(O2) =2:1
计算验证
2H2O
2H2
+
O2
通电
相对原子/分子质量
2×18 2×2 32
质量
物质的量
0.1mol 0.05mol
1.8g
0.2g 1.6g
初步结论:相同温度和压强下,1molH2
和1molO2的体积 。
表1.根据现象和推算得初步结论
相同
n(H2 ) :n(O2) =2:1
质量 物质的量 H2和O2的物质的量之比
H2 0.2g 0.1mol
O2 1.6g
0.05mol
22.4
22.4
表2. 1mol气体在标准状况下的体积
(标准状况:温度为0℃,压强为101KPa)
[结论] 在标准状况下,1mol任何气体所占的体积 L。
都约为22.4
物质名称 物质的量
mol 摩尔质量
g?mol-1 密度
g?L-1 体积
L
H2 1 2.016 0.0899
O2 1 32.00 1.429
7.2
10
18
53.6
表3. 1mol固,液体的体积
(V=m/ρ)
[结论] 相同条件下,1摩尔不同固体或液体物质的体积是 的。
不相同
物质
名称 状态 物质的量
mol 摩尔质量
g?mol-1 密度
g?cm-3 体积
cm3
Fe 固 1 56 7.8
Al 固 1 27 2.7
H2O 液 1 18 1
H2SO4 液 1 98 1.83
固体 Fe
液态水
铁原子
水分子
气体CO2
CO2分子
固体. 液体 .气体分子之间距离比较示意图
0.4 nm
4 nm
气体分子
气体的体积受温度、压强的影响很大.
压强变大
间距变小
体积变小
温度变大
间距变大
体积变大
只有在同温同压下,相同物质的量的不同气体才具有相同的体积。
1. 标准状况,1molH2O的体积约是22.4L。
错,水是液体
2. 1mol气体的体积约为22.4L。
(错,标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体 所含的分子数。
(错,未指明是否在相同条件)
5. 标准状况下,气体的摩尔体积都是22.4L。
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
(错,“约为”;单位应为L/mol)
判断正误
阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
8.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)分子数之比为 ;
(2)原子数之比为 ;
(3)物质的量之比为 ;
(4)摩尔质量之比为 ;
(5)质量之比为 ;
1:2
3:4
1:2
11:7
11:14
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
阿伏伽德罗定律推论
9.同温同压下,下列密度相同的气
体组是 ( )
A、CO、N2 B、NO、CH4
C、C2H4、NO D、SO2、Cl2
A
10.将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是 ( ) A、P(H2)=P(O2)=P(N2)
B、P(H2)>P(N2)>P(O2) C、P(H2)>P(O2) >P(N2)
D、P(N2)>P(O2) >P(H2)
B
11.同温同压下,等质量的SO2气体和CO2气体相比较,下列叙述中,正确的是( )
A、体积比为1:1 B、体积比为11:16
C、密度比为16:11 D、密度比为11:16
BC
计算题:标况下,6.72 L CO2气体的物质的量是多少?质量是多少?
作业
