课题2 溶解度课件 (22张PPT)
图片预览



文档简介
(共22张PPT)
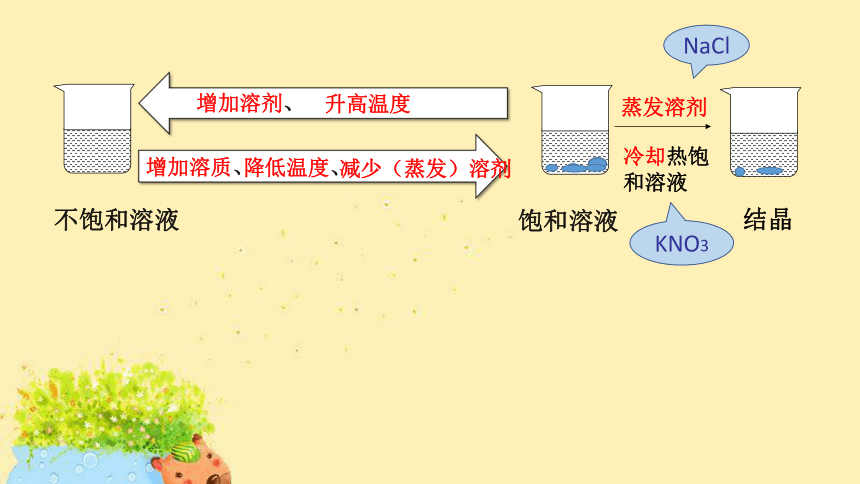
溶解度
减少(蒸发)溶剂
增加溶质、
降低温度、
增加溶剂、
升高温度
不饱和溶液
饱和溶液
结晶
蒸发溶剂
冷却热饱和溶液
NaCl
KNO3
二、溶解度
(一)、固体溶解度
在 下,某固体物质在 里达到 状态时所溶解的 ,叫这种物质在 中的溶解度。
一定温度
100g溶剂
饱和
这种溶剂
质量
一定温度下,物质溶解于一定量的溶剂中都有一定的限度
溶质种类、
影响物质溶解性的因素:
溶剂的性质、
溶剂的质量、
温度、
单位:克
状态:溶解量达最大限度
一般指水
标准:人为规定,控制溶剂质量这一变量
指明溶剂种类
条件
水
(1)
汽油
(4)
KMnO4
I2
水
(2)
汽油
(3)
KMnO4
I2
1.定义:
形成饱和溶液
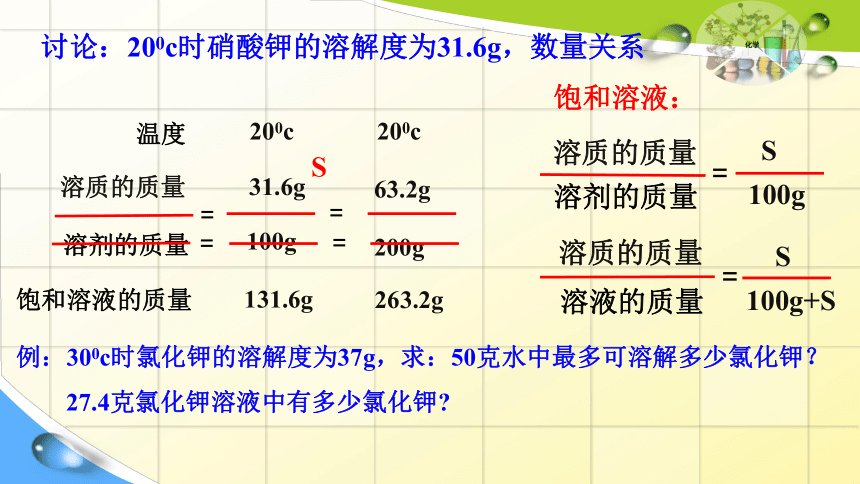
讨论:200c时硝酸钾的溶解度为31.6g,数量关系
温度
溶质的质量
溶剂的质量
饱和溶液的质量
200c
31.6g
100g
131.6g
200c
63.2g
200g
263.2g
=
=
溶质的质量
溶剂的质量
S
100g
=
溶质的质量
溶液的质量
S
100g+S
=
=
=
饱和溶液:
例:300c时氯化钾的溶解度为37g,求:50克水中最多可溶解多少氯化钾?
27.4克氯化钾溶液中有多少氯化钾?
S
:200C时,氯化钠固体的溶解度为36.0g,隐含意义
200C时,100g水中最多能溶解氯化钠固体
200C时,将水与氯化钠以 的质量比混合,可得200C时的氯化钠饱和溶液
200C时,氯化钠的饱和溶液中水与氯化钠的质量比为
200C时,从氯化钠的饱和溶液中蒸发水与析出晶体的质量比是
200C时,从足量的氯化钠饱和溶液中蒸发100g水,能析出 氯化钠晶体
200C时,36.0g氯化钠固体全部溶解至少需要 水
200C时,将36.0g氯化钠固体溶解于100g水中, 形成氯化钠的 溶液
36.0g
100:36
100:36
100:36
讨论
?
36.0g
100g
饱和
刚好
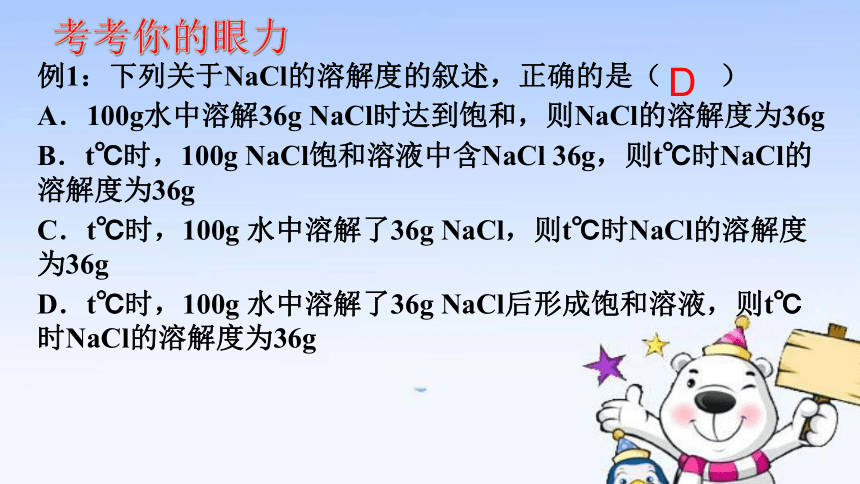
例1:下列关于NaCl的溶解度的叙述,正确的是( )
A.100g水中溶解36g NaCl时达到饱和,则NaCl的溶解度为36g
B.t℃时,100g NaCl饱和溶液中含NaCl 36g,则t℃时NaCl的溶解度为36g
C.t℃时,100g 水中溶解了36g NaCl,则t℃时NaCl的溶解度为36g
D.t℃时,100g 水中溶解了36g NaCl后形成饱和溶液,则t℃时NaCl的溶解度为36g
D
考考你的眼力
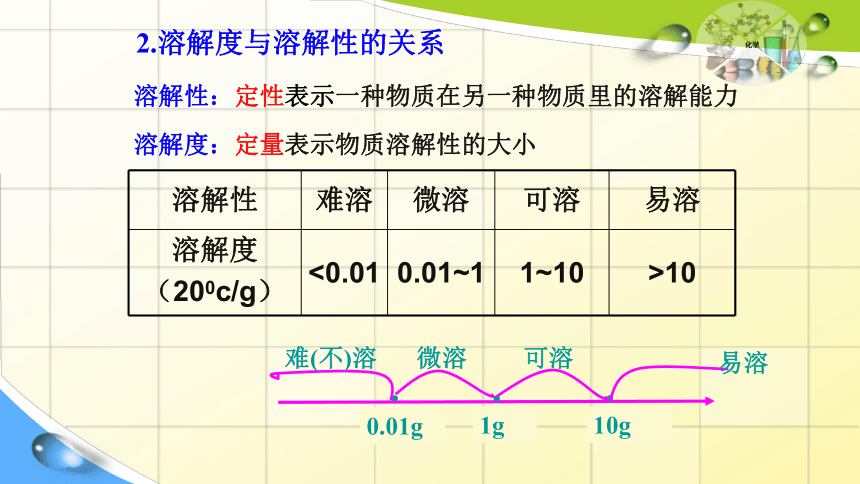
溶解性 难溶 微溶 可溶 易溶
溶解度
(200c/g) <0.01 0.01~1 1~10 >10
2.溶解度与溶解性的关系
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
溶解度:定量表示物质溶解性的大小
溶解性:定性表示一种物质在另一种物质里的溶解能力
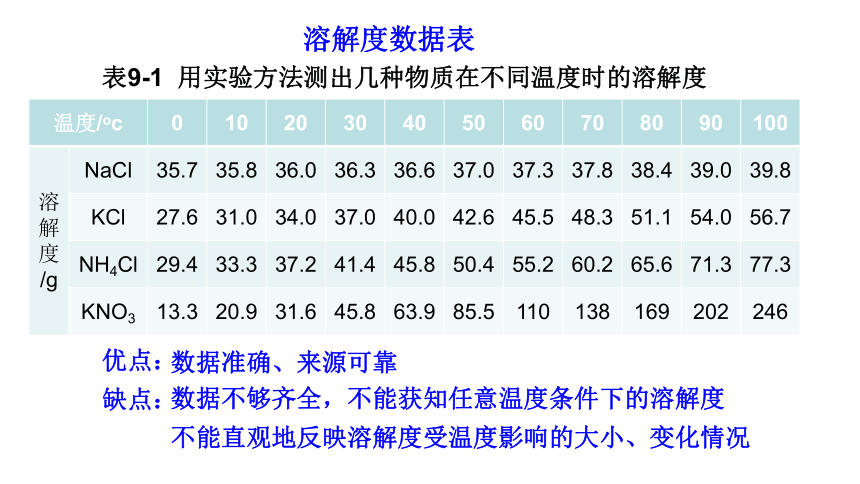
温度/oc 0 10 20 30 40 50 60 70 80 90 100
溶
解
度
/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
表9-1 用实验方法测出几种物质在不同温度时的溶解度
缺点:
不能直观地反映溶解度受温度影响的大小、变化情况
优点:
溶解度数据表
数据准确、来源可靠
数据不够齐全,不能获知任意温度条件下的溶解度
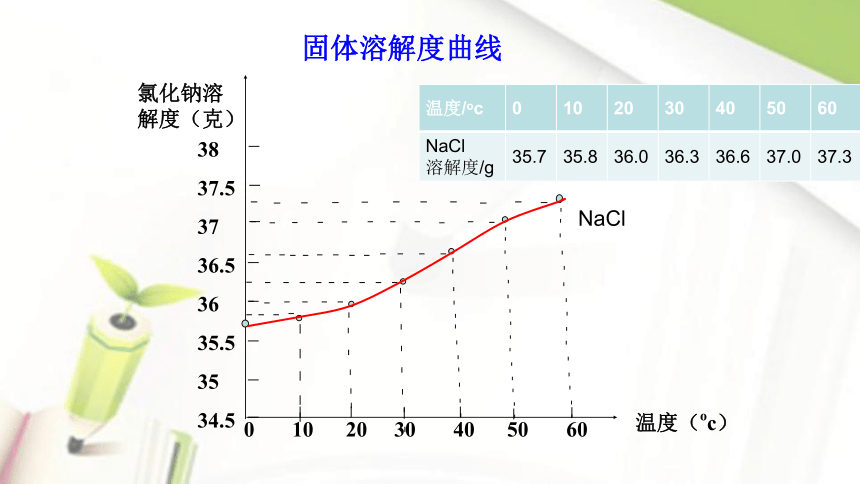
氯化钠溶解度(克)
温度(oc)
0 10 20 30 40 50 60
38
37.5
37
36.5
36
35.5
35
34.5
NaCl
固体溶解度曲线
温度/oc 0 10 20 30 40 50 60
NaCl
溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0 37.3
硝酸钾溶解度(克)
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
缺点:数据有误差
b.能直观地反应溶解度受温度影响的大小、变化情况
a.所呈现的温度范围较宽,数据齐全,能获知连续温度条件下的溶解度
固体溶解度曲线
优点:
温度/oc 0 10 20 30 40 50 60
KNO3
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
NH4NO3
KNO3
NaNO3
NH4NO3
NaCl
硼酸
图9-12 几种固体物质溶解度曲线
熟石灰溶解度
溶解度曲线用途
a.大部分固体物质的溶解度随温度升高而增大
4. 判断物质的溶解度随温度的变化规律。
2. 比较不同物质在相同温度下的溶解度大小;
3.反映物质的溶解度受温度变化影响的大小;
1. 查出物质在不同温度下的溶解度;
b.曲线越平,物质溶解度受温度影响越小,NaCl
a.曲线越陡,该物质的溶解度受温度影响越大
b.极少数物质的溶解度随温度升高而减少
比较50 ?C各物质的溶解度的大小
比较68 ?C各物质的溶解度的大小
NaNO3>KNO3>NH4NO3>NaCl>硼酸
NaNO3=KNO3>NH4NO3>NaCl>硼酸
比较溶解度时一定要指明温度
比较20 ?C各物质的溶解度的大小
NaNO3>NH4NO3>NaCl>KNO3>硼酸
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
KNO3
NaNO3
NaCl
图9-12 几种固体物质溶解度曲线
溶解度曲线用途
5. 交点:
A
刚好形成该温度下的饱和溶液
在该温度下的不饱和溶液
B
在该温度下的过饱和溶液
饱和溶液
不饱和溶液
饱和溶液
两种物质在某温度下的溶解度相同
曲线上任何一点:
曲线下方任何一点:
曲线上方任何一点:
过
有溶质剩余
C
D
E
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
KNO3
NaCl
图9-12 几种固体物质溶解度曲线
溶解度曲线用途
b. 物质溶解度受温度影响小(曲线越平缓),如氯化钠,
a. 物质的溶解度受温度影响大(曲线越陡)
A
B
6. 判断结晶方法
冷却热饱和溶液(冷却结晶)
蒸发结晶
例:右图是A.B.C三种固体物质的溶解度曲线,回答下列问题:
(1)从A饱和溶液中得到晶体宜采用的方法是
(2)从B饱和溶液中得到晶体宜采用的方法是
(3)分离B(或A)与C混合物采用的方法是
(4)除去A中混有的少量B的方法是
(5)除去B中混有的少量A的方法是
蒸发结晶,过滤
溶解,过滤,蒸发结晶
配制A的热饱和溶液,降温结晶,过滤
温度
溶解度
A
B
C
0.01克
8克
降温结晶,过滤
配制B的饱和溶液,蒸发结晶,过滤
7.确立饱和溶液与不饱和溶液之间的转化方法及浓度的变化情况
A状态
C状态
A
B
C
再增加溶质、
D
降低温度
t1 oc
t2 oc
t2 oc降温至t1 oc
饱和
B状态
饱和
不饱和
过饱和
浓度不变
(析出晶体)
升高温度
①增加溶剂
①t1 oc升温至t2 oc,
B
A
D
C
t1 oc
t2 oc
S
S
②t2 oc降温至t1 oc, 过滤析出晶体,
再升高温度
溶质 、溶剂不变
溶质不变、溶剂
溶质不变、溶剂不变
溶质 、溶剂不变
②或升温至t2 oc,再恒温蒸发溶剂
溶质不变、溶剂
溶质 、溶剂不变
①增加溶质
②恒温蒸发溶剂
溶质不变、溶剂
溶质 、溶剂不变
升高温度
降低温度
饱和
饱和
不饱和
t4 oc
t3 oc
(3)打开啤酒瓶盖时,冒泡了!
(1)汽水瓶好硬哟!
(2)汽水瓶变软了!
(4)喝下汽水打嗝了!
(6)加热水,有气泡
(5)向外拉动针筒活塞,有气泡冒出!
温度升高,气体溶解度减小;
气体溶解度减小
压强减小
压强减小,气体溶解度减小。
温度升高,气体溶解度减小;
气体的溶解度与什么有关系呢?
温度、压强、
(7)天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
(二)、气体溶解度:
气体在压强为101KPa、一定温度时,溶解在1体积水里达到饱和状态时的气体体积(是一个比值,无单位) 。
例:在00C时,氮气的溶解度为0.024。
即:在101KPa和温度为00C时,1体积水里最多能溶解0.024体积氮气。
气体溶解度一般随压强增大而增大,随压强减小而减小。
气体溶解度一般随温度升高而减小,随温度降低而增大。
气体 氧气 二氧化碳 二氧化硫 氯化氢 氨气
溶解度
(101KPa、200C) 1:0.03 1:2 1:40 1:500 1:700
1. 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压。
C
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳, 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①
D
小试牛刀
1.甲,乙两种固体纯净物的溶解度曲线如图A所示,在常温下,先在两支试管里分别装入甲,乙两种物质的饱和和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B).下列说法正确的是( )
A.乙溶液中溶质的质量增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲,乙物质的溶解度都增大
D.两支试管里剩余的固体都增多
A
学以致用
2.如图是a、b、c三种物质的溶解度曲线,回答下列问题:
①P点的含义是 ;
t2℃时a、b、c三种物质的溶解度的大小关系是 .
②t2℃时,将50ga物质放入50g水中充分溶解得到溶液的质量为 g;
将c物质的不饱和溶液变为饱和溶液的方法是 。
③a中含有少量b时,得到较纯a的方法是 .
④将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液中溶质的浓度由大到小的顺序是 .
⑤t1℃时,将盛有c的饱和溶液的小试管放入
盛水的烧杯中(如图2),向水中加入一定量
的氢氧化钠固体后,试管中的溶液变浑浊,
原因是 .
a>b>c
75
升高温度
降温结晶
b>a>c
氢氧化钠固体溶于水放热,而c物质的溶解度随温度的升高而减小,所以会有晶体析出
t1℃时,a、c两物质的溶解度相等;
四、溶解度曲线用途
4. 判断物质的溶解度随温度的变化规律。
2. 比较不同物质在相同温度下的溶解度大小;
3.反映物质的溶解度受温度变化影响的大小;
1. 查出物质在不同温度下的溶解度;
5.点、线、面所表示的溶液状态
曲线上任何一点:
曲线下方任何一点:
曲线上方任何一点:
b. 物质溶解度受温度影响小(曲线越平缓)
a. 物质的溶解度受温度影响大(曲线越陡)
6. 判断结晶方法
7.确立饱和溶液与不饱和溶液之间的转化方法及浓度的变化情况
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的的质量。
一、定义:
三、认识溶解度曲线、溶解度表
二、溶解度与溶解性的关系
交点:
a.大部分固体物质的溶解度随温度升高而增大
b.极少数物质的溶解度随温度升高而减少
溶解度 知识小结
固体溶解度
气体溶解度
一、定义:
气体在压强为101KPa、一定温度时,溶解在1体积水里达到饱和状态时的气体体积(是一个比值,无单位) 。
气体溶解度一般随压强增大而增大,随压强减小而减小。
二、规律
气体溶解度一般随温度升高而减小,随温度降低而增大。
谢谢
溶解度
减少(蒸发)溶剂
增加溶质、
降低温度、
增加溶剂、
升高温度
不饱和溶液
饱和溶液
结晶
蒸发溶剂
冷却热饱和溶液
NaCl
KNO3
二、溶解度
(一)、固体溶解度
在 下,某固体物质在 里达到 状态时所溶解的 ,叫这种物质在 中的溶解度。
一定温度
100g溶剂
饱和
这种溶剂
质量
一定温度下,物质溶解于一定量的溶剂中都有一定的限度
溶质种类、
影响物质溶解性的因素:
溶剂的性质、
溶剂的质量、
温度、
单位:克
状态:溶解量达最大限度
一般指水
标准:人为规定,控制溶剂质量这一变量
指明溶剂种类
条件
水
(1)
汽油
(4)
KMnO4
I2
水
(2)
汽油
(3)
KMnO4
I2
1.定义:
形成饱和溶液
讨论:200c时硝酸钾的溶解度为31.6g,数量关系
温度
溶质的质量
溶剂的质量
饱和溶液的质量
200c
31.6g
100g
131.6g
200c
63.2g
200g
263.2g
=
=
溶质的质量
溶剂的质量
S
100g
=
溶质的质量
溶液的质量
S
100g+S
=
=
=
饱和溶液:
例:300c时氯化钾的溶解度为37g,求:50克水中最多可溶解多少氯化钾?
27.4克氯化钾溶液中有多少氯化钾?
S
:200C时,氯化钠固体的溶解度为36.0g,隐含意义
200C时,100g水中最多能溶解氯化钠固体
200C时,将水与氯化钠以 的质量比混合,可得200C时的氯化钠饱和溶液
200C时,氯化钠的饱和溶液中水与氯化钠的质量比为
200C时,从氯化钠的饱和溶液中蒸发水与析出晶体的质量比是
200C时,从足量的氯化钠饱和溶液中蒸发100g水,能析出 氯化钠晶体
200C时,36.0g氯化钠固体全部溶解至少需要 水
200C时,将36.0g氯化钠固体溶解于100g水中, 形成氯化钠的 溶液
36.0g
100:36
100:36
100:36
讨论
?
36.0g
100g
饱和
刚好
例1:下列关于NaCl的溶解度的叙述,正确的是( )
A.100g水中溶解36g NaCl时达到饱和,则NaCl的溶解度为36g
B.t℃时,100g NaCl饱和溶液中含NaCl 36g,则t℃时NaCl的溶解度为36g
C.t℃时,100g 水中溶解了36g NaCl,则t℃时NaCl的溶解度为36g
D.t℃时,100g 水中溶解了36g NaCl后形成饱和溶液,则t℃时NaCl的溶解度为36g
D
考考你的眼力
溶解性 难溶 微溶 可溶 易溶
溶解度
(200c/g) <0.01 0.01~1 1~10 >10
2.溶解度与溶解性的关系
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
溶解度:定量表示物质溶解性的大小
溶解性:定性表示一种物质在另一种物质里的溶解能力
温度/oc 0 10 20 30 40 50 60 70 80 90 100
溶
解
度
/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
表9-1 用实验方法测出几种物质在不同温度时的溶解度
缺点:
不能直观地反映溶解度受温度影响的大小、变化情况
优点:
溶解度数据表
数据准确、来源可靠
数据不够齐全,不能获知任意温度条件下的溶解度
氯化钠溶解度(克)
温度(oc)
0 10 20 30 40 50 60
38
37.5
37
36.5
36
35.5
35
34.5
NaCl
固体溶解度曲线
温度/oc 0 10 20 30 40 50 60
NaCl
溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0 37.3
硝酸钾溶解度(克)
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
缺点:数据有误差
b.能直观地反应溶解度受温度影响的大小、变化情况
a.所呈现的温度范围较宽,数据齐全,能获知连续温度条件下的溶解度
固体溶解度曲线
优点:
温度/oc 0 10 20 30 40 50 60
KNO3
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
NH4NO3
KNO3
NaNO3
NH4NO3
NaCl
硼酸
图9-12 几种固体物质溶解度曲线
熟石灰溶解度
溶解度曲线用途
a.大部分固体物质的溶解度随温度升高而增大
4. 判断物质的溶解度随温度的变化规律。
2. 比较不同物质在相同温度下的溶解度大小;
3.反映物质的溶解度受温度变化影响的大小;
1. 查出物质在不同温度下的溶解度;
b.曲线越平,物质溶解度受温度影响越小,NaCl
a.曲线越陡,该物质的溶解度受温度影响越大
b.极少数物质的溶解度随温度升高而减少
比较50 ?C各物质的溶解度的大小
比较68 ?C各物质的溶解度的大小
NaNO3>KNO3>NH4NO3>NaCl>硼酸
NaNO3=KNO3>NH4NO3>NaCl>硼酸
比较溶解度时一定要指明温度
比较20 ?C各物质的溶解度的大小
NaNO3>NH4NO3>NaCl>KNO3>硼酸
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
KNO3
NaNO3
NaCl
图9-12 几种固体物质溶解度曲线
溶解度曲线用途
5. 交点:
A
刚好形成该温度下的饱和溶液
在该温度下的不饱和溶液
B
在该温度下的过饱和溶液
饱和溶液
不饱和溶液
饱和溶液
两种物质在某温度下的溶解度相同
曲线上任何一点:
曲线下方任何一点:
曲线上方任何一点:
过
有溶质剩余
C
D
E
溶解度(克)
温度( ?C )
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
KNO3
NaCl
图9-12 几种固体物质溶解度曲线
溶解度曲线用途
b. 物质溶解度受温度影响小(曲线越平缓),如氯化钠,
a. 物质的溶解度受温度影响大(曲线越陡)
A
B
6. 判断结晶方法
冷却热饱和溶液(冷却结晶)
蒸发结晶
例:右图是A.B.C三种固体物质的溶解度曲线,回答下列问题:
(1)从A饱和溶液中得到晶体宜采用的方法是
(2)从B饱和溶液中得到晶体宜采用的方法是
(3)分离B(或A)与C混合物采用的方法是
(4)除去A中混有的少量B的方法是
(5)除去B中混有的少量A的方法是
蒸发结晶,过滤
溶解,过滤,蒸发结晶
配制A的热饱和溶液,降温结晶,过滤
温度
溶解度
A
B
C
0.01克
8克
降温结晶,过滤
配制B的饱和溶液,蒸发结晶,过滤
7.确立饱和溶液与不饱和溶液之间的转化方法及浓度的变化情况
A状态
C状态
A
B
C
再增加溶质、
D
降低温度
t1 oc
t2 oc
t2 oc降温至t1 oc
饱和
B状态
饱和
不饱和
过饱和
浓度不变
(析出晶体)
升高温度
①增加溶剂
①t1 oc升温至t2 oc,
B
A
D
C
t1 oc
t2 oc
S
S
②t2 oc降温至t1 oc, 过滤析出晶体,
再升高温度
溶质 、溶剂不变
溶质不变、溶剂
溶质不变、溶剂不变
溶质 、溶剂不变
②或升温至t2 oc,再恒温蒸发溶剂
溶质不变、溶剂
溶质 、溶剂不变
①增加溶质
②恒温蒸发溶剂
溶质不变、溶剂
溶质 、溶剂不变
升高温度
降低温度
饱和
饱和
不饱和
t4 oc
t3 oc
(3)打开啤酒瓶盖时,冒泡了!
(1)汽水瓶好硬哟!
(2)汽水瓶变软了!
(4)喝下汽水打嗝了!
(6)加热水,有气泡
(5)向外拉动针筒活塞,有气泡冒出!
温度升高,气体溶解度减小;
气体溶解度减小
压强减小
压强减小,气体溶解度减小。
温度升高,气体溶解度减小;
气体的溶解度与什么有关系呢?
温度、压强、
(7)天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
(二)、气体溶解度:
气体在压强为101KPa、一定温度时,溶解在1体积水里达到饱和状态时的气体体积(是一个比值,无单位) 。
例:在00C时,氮气的溶解度为0.024。
即:在101KPa和温度为00C时,1体积水里最多能溶解0.024体积氮气。
气体溶解度一般随压强增大而增大,随压强减小而减小。
气体溶解度一般随温度升高而减小,随温度降低而增大。
气体 氧气 二氧化碳 二氧化硫 氯化氢 氨气
溶解度
(101KPa、200C) 1:0.03 1:2 1:40 1:500 1:700
1. 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压。
C
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳, 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①
D
小试牛刀
1.甲,乙两种固体纯净物的溶解度曲线如图A所示,在常温下,先在两支试管里分别装入甲,乙两种物质的饱和和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B).下列说法正确的是( )
A.乙溶液中溶质的质量增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲,乙物质的溶解度都增大
D.两支试管里剩余的固体都增多
A
学以致用
2.如图是a、b、c三种物质的溶解度曲线,回答下列问题:
①P点的含义是 ;
t2℃时a、b、c三种物质的溶解度的大小关系是 .
②t2℃时,将50ga物质放入50g水中充分溶解得到溶液的质量为 g;
将c物质的不饱和溶液变为饱和溶液的方法是 。
③a中含有少量b时,得到较纯a的方法是 .
④将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液中溶质的浓度由大到小的顺序是 .
⑤t1℃时,将盛有c的饱和溶液的小试管放入
盛水的烧杯中(如图2),向水中加入一定量
的氢氧化钠固体后,试管中的溶液变浑浊,
原因是 .
a>b>c
75
升高温度
降温结晶
b>a>c
氢氧化钠固体溶于水放热,而c物质的溶解度随温度的升高而减小,所以会有晶体析出
t1℃时,a、c两物质的溶解度相等;
四、溶解度曲线用途
4. 判断物质的溶解度随温度的变化规律。
2. 比较不同物质在相同温度下的溶解度大小;
3.反映物质的溶解度受温度变化影响的大小;
1. 查出物质在不同温度下的溶解度;
5.点、线、面所表示的溶液状态
曲线上任何一点:
曲线下方任何一点:
曲线上方任何一点:
b. 物质溶解度受温度影响小(曲线越平缓)
a. 物质的溶解度受温度影响大(曲线越陡)
6. 判断结晶方法
7.确立饱和溶液与不饱和溶液之间的转化方法及浓度的变化情况
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的的质量。
一、定义:
三、认识溶解度曲线、溶解度表
二、溶解度与溶解性的关系
交点:
a.大部分固体物质的溶解度随温度升高而增大
b.极少数物质的溶解度随温度升高而减少
溶解度 知识小结
固体溶解度
气体溶解度
一、定义:
气体在压强为101KPa、一定温度时,溶解在1体积水里达到饱和状态时的气体体积(是一个比值,无单位) 。
气体溶解度一般随压强增大而增大,随压强减小而减小。
二、规律
气体溶解度一般随温度升高而减小,随温度降低而增大。
谢谢
同课章节目录
