鲁教版(五四制)九年级化学 2.2碱及其性质 课件(18张PPT)
文档属性
| 名称 | 鲁教版(五四制)九年级化学 2.2碱及其性质 课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 974.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-12 16:20:59 | ||
图片预览






文档简介
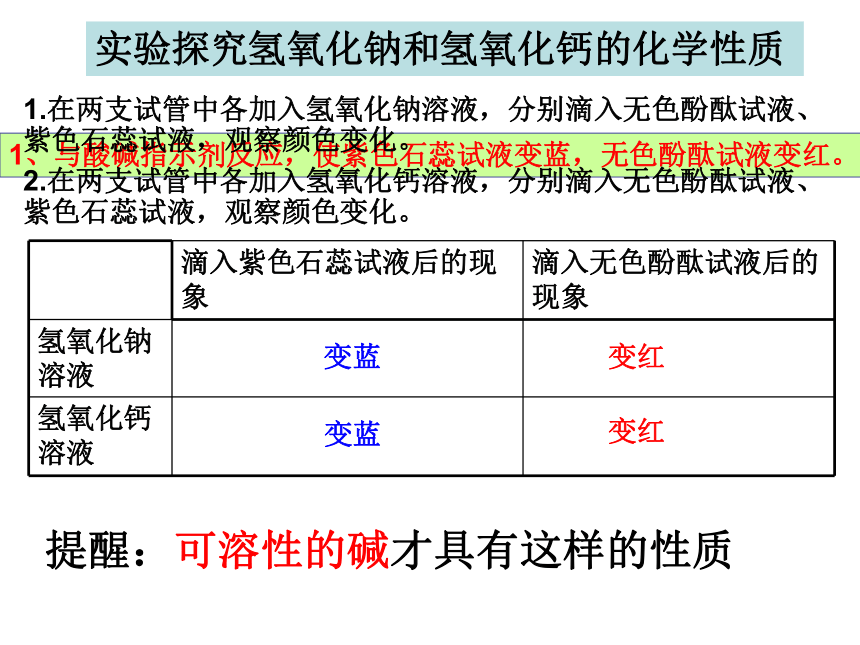
课件18张PPT。第二单元 常见的酸和碱碱及其性质第一步:回顾复习氢氧化钠氢氧化钙氢氧化钾氨水NaOHCa(OH)2KOHNH3·H2O常见的碱NH4OH第二步:新知探究实验探究氢氧化钠和氢氧化钙的化学性质变蓝变红变蓝变红1、与酸碱指示剂反应,使紫色石蕊试液变蓝,无色酚酞试液变红。提醒:可溶性的碱才具有这样的性质 将桌面上的药品(锌粒、生锈的铁钉、氯化铜溶液、碳酸钠溶液)进行分类:
锌粒属于金属单质
铁钉属于金属单质
铁锈(Fe2O3)属于金属氧化物
氯化铜、碳酸钠属于盐
实验探究氢氧化钠和氢氧化钙的化学性质氢氧化钠和氢氧化钙的化学性质 (A组)在4支试管中分别加入锌粒、生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钠溶液。观察并记录实验现象。
(B组)在4支试管中分别加入锌粒、生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钙溶液。二、碱的化学性质观察并记录实验现象。完成下列表格。无变化无变化蓝色沉淀蓝色沉淀无变化白色沉淀无变化无变化第三步:巩固练习第四步:互助提高 澄清石灰水NaOH溶液现象:变浑浊反应原理:Ca(OH)2+ CO2 = CaCO3↓ + H2O?无明显现象难道不反应?ⅠⅡ提出问题:氢氧化钠与二氧化碳反应了吗?猜想:设计实验 向装满二氧化碳气体的塑料瓶中,倒入适量的氢氧化钠溶液,立即盖紧瓶塞,振荡,观察现象。现象:
结论:二氧化碳与氢氧化钠 (填“能”或“不能”)反应,
反应的化学方程式为: 。
原理: 。 能CO2+2NaOH=Na2CO3+H2O反应NaOH溶液倒入NaOH溶液的塑料瓶 。CO2与NaOH溶液反应,使瓶内压强减小。变瘪此同学的设计方案真能说明二者发生发应吗?CO2不能,因为二氧化碳溶于水也会产生类似现象。组内讨论:设计实验证明氢氧化钠与二氧化碳反应提供的药品及仪器:
两塑料瓶瓶二氧化碳气体、氢氧化钠溶液、蒸馏水Ca(OH)2+ CO2 = CaCO3↓ + H2O矿泉水瓶变瘪矿泉水瓶变瘪,溶液变浑浊2NaOH + CO2 = Na2CO3 + H2O现象有何不同?常用浓的氢氧化钠溶液吸收二氧化碳气体。注意:常用氢氧化钙溶液检验二氧化碳气体。 为什么检验和吸收CO2的物质不同?第五步:总结归纳造纸氢氧化钠的用途化学纤维清洁剂印刷土木建筑工业上制烧碱改良酸性土壤漂白粉生产农药氢氧化钙的用途你知道生活中的碱吗?“摸起来滑滑的”“尝起来涩涩的”人之所以能,是相信能!老师寄语:
锌粒属于金属单质
铁钉属于金属单质
铁锈(Fe2O3)属于金属氧化物
氯化铜、碳酸钠属于盐
实验探究氢氧化钠和氢氧化钙的化学性质氢氧化钠和氢氧化钙的化学性质 (A组)在4支试管中分别加入锌粒、生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钠溶液。观察并记录实验现象。
(B组)在4支试管中分别加入锌粒、生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钙溶液。二、碱的化学性质观察并记录实验现象。完成下列表格。无变化无变化蓝色沉淀蓝色沉淀无变化白色沉淀无变化无变化第三步:巩固练习第四步:互助提高 澄清石灰水NaOH溶液现象:变浑浊反应原理:Ca(OH)2+ CO2 = CaCO3↓ + H2O?无明显现象难道不反应?ⅠⅡ提出问题:氢氧化钠与二氧化碳反应了吗?猜想:设计实验 向装满二氧化碳气体的塑料瓶中,倒入适量的氢氧化钠溶液,立即盖紧瓶塞,振荡,观察现象。现象:
结论:二氧化碳与氢氧化钠 (填“能”或“不能”)反应,
反应的化学方程式为: 。
原理: 。 能CO2+2NaOH=Na2CO3+H2O反应NaOH溶液倒入NaOH溶液的塑料瓶 。CO2与NaOH溶液反应,使瓶内压强减小。变瘪此同学的设计方案真能说明二者发生发应吗?CO2不能,因为二氧化碳溶于水也会产生类似现象。组内讨论:设计实验证明氢氧化钠与二氧化碳反应提供的药品及仪器:
两塑料瓶瓶二氧化碳气体、氢氧化钠溶液、蒸馏水Ca(OH)2+ CO2 = CaCO3↓ + H2O矿泉水瓶变瘪矿泉水瓶变瘪,溶液变浑浊2NaOH + CO2 = Na2CO3 + H2O现象有何不同?常用浓的氢氧化钠溶液吸收二氧化碳气体。注意:常用氢氧化钙溶液检验二氧化碳气体。 为什么检验和吸收CO2的物质不同?第五步:总结归纳造纸氢氧化钠的用途化学纤维清洁剂印刷土木建筑工业上制烧碱改良酸性土壤漂白粉生产农药氢氧化钙的用途你知道生活中的碱吗?“摸起来滑滑的”“尝起来涩涩的”人之所以能,是相信能!老师寄语:
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
