鲁教版(五四制)九年级化学第二单元 常见的酸和碱复习 课件(39张PPT)
文档属性
| 名称 | 鲁教版(五四制)九年级化学第二单元 常见的酸和碱复习 课件(39张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 501.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-13 08:22:16 | ||
图片预览








文档简介
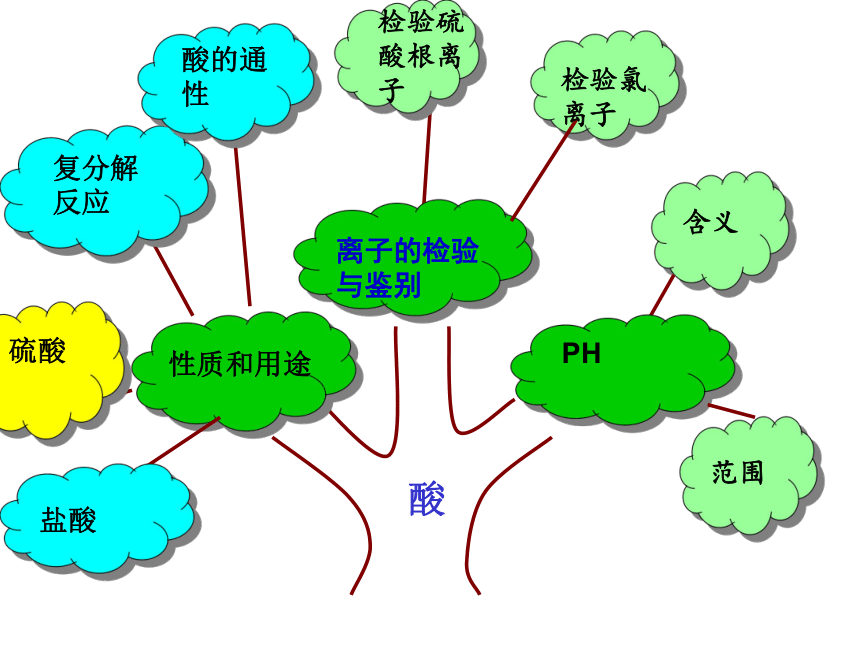
课件39张PPT。常 见 的 酸 和 碱 复 习 课 常见的酸和碱
复习课酸盐酸硫酸复分解反应酸的通性含义范围检验硫酸根离子
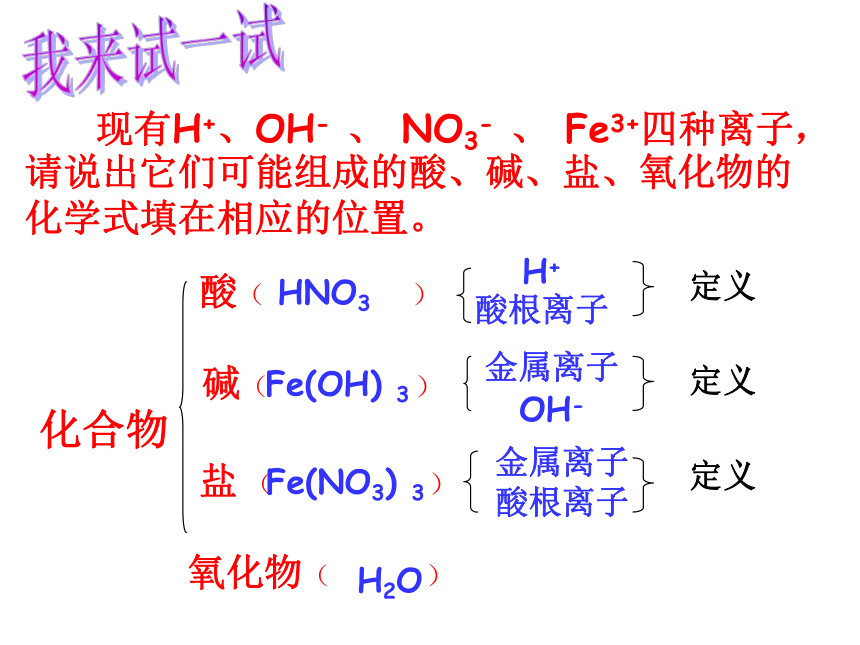
酸( )
碱( )
化合物
盐 ( )
氧化物( )
现有H+、OH- 、 NO3- 、 Fe3+四种离子,请说出它们可能组成的酸、碱、盐、氧化物的化学式填在相应的位置。H+
酸根离子金属离子
OH-金属离子
酸根离子HNO3Fe(OH) 3Fe(NO3) 3 H2O我来试一试2、下列物质具有相同酸根离子的是( )
A、Na2SO4 Na2SO3 B 、KMnO4 K2MnO4
C 、 KClO3 KCl D、 FeSO4 Fe2(SO4)3AD在线检测常见的酸无 有刺激性
液无 无
粘稠、油状液有白雾产生(有挥发性)无现象 用于金属表面除锈用于金属表面除锈
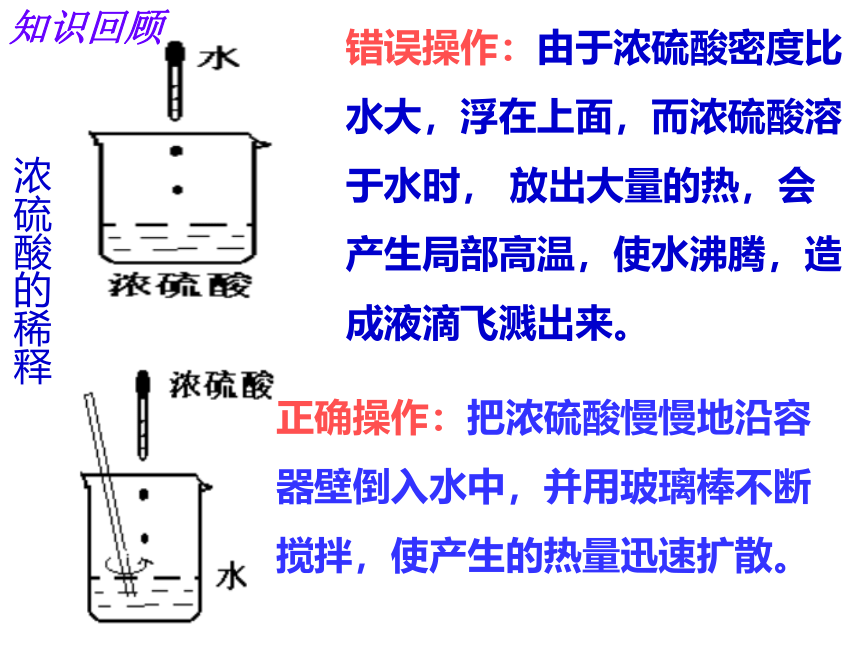
浓硫酸可作干燥剂知识回顾错误操作:由于浓硫酸密度比水大,浮在上面,而浓硫酸溶于水时, 放出大量的热,会产生局部高温,使水沸腾,造成液滴飞溅出来。正确操作:把浓硫酸慢慢地沿容器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。浓硫酸的稀释知识回顾稀盐酸的化学性质和用途能使紫色石蕊试液变红色,无色酚酞不变色Zn+2HCl=ZnCl2+H2↑实 验 室
制 氢 气Fe2O3+6HCl=2FeCl3+3H2O金 属 表
面 除 锈Al(OH)3+3HCl=AlCl3+3H2OAgNO3+HCl=AgCl ↓ +HNO3治疗胃
酸过多检 验 Cl- 知识回顾Cl-的检验方法:滴加AgNO3溶液出现白
色沉淀,再滴入稀硝酸沉淀不溶解。稀硫酸的化学性质和用途能使紫色石蕊试剂变红色,无色酚酞不变色Zn+H2SO4=ZnSO4+H2↑实 验 室
制 氢 气CuO+H2SO4=CuSO4+H2O金 属 表
面 除 锈 Ca(OH)2+H2SO4=CaSO4+2H2O改良酸性土壤
处理污水 BaCl2+H2SO4=BaSO4 ↓ +2HCl检验SO42-知识回顾SO42—的检验方法:(先加足量稀盐酸 )滴加BaCl2溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。硝酸钡 . 酸的通性:1、与指示剂反应 酸能使紫色石蕊变红,
无色酚酞不变色。4、酸+ 碱 〓 盐 + 水 5、酸+ 盐 = 新酸 + 新盐 3、酸+碱性氧化物= 盐 + 水2、酸+ 金属 = 盐 + 氢气HCl + AgNO3 = AgCl ↓ + HNO3
H2SO4 +BaCl2 = BaSO4↓ + 2HCl酸溶液具有一些相似的化学性质,是因为酸溶液中都含有H+知识小结检验Cl-或SO42-时,为什么要加稀HNO3? 检验Cl-和SO42—时,要加足量稀硝酸,目的是除去CO32—等杂质离子的干扰。因为CO32—与AgNO3或BaCl2溶液接触时,也有白色沉淀Ag2CO3、BaCO3生成,但这些沉淀都溶于稀硝酸。如 BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
Ag2CO3+2HNO3=2AgNO3+CO2↑+H2O
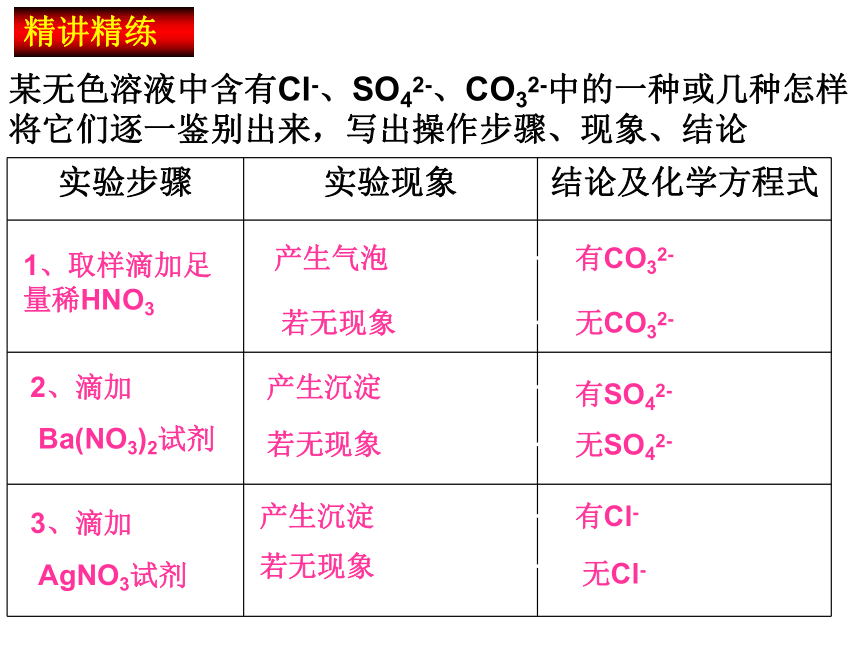
而AgCl和BaSO4则不溶于稀硝酸,所以在检验时一定要加足量稀硝酸,如果白色沉淀不溶解,才能确认有Cl-或SO42-。知识拓展溶液有可能同时存在Cl-和SO42-时,先检验哪种离子?
请分别写出HCl、H2SO4和AgNO3反应的化学方程式,借助化学方程式分析。 应该先检验SO42-,而且用Ba(NO3)2溶液和稀硝酸代替BaCl2溶液和盐酸作试剂。且需将BaSO4沉淀滤去,再往滤液中加AgNO3溶液和稀硝酸检验Cl-。因为硫酸银微溶于水,如果溶液中SO42-浓度较大,若先检验Cl-,加入AgNO3溶液时,会生成Ag2SO4(微溶)沉淀,而干扰Cl-的检验。?知识拓展某无色溶液中含有Cl-、SO42-、CO32-中的一种或几种怎样将它们逐一鉴别出来,写出操作步骤、现象、结论精讲精练1、取样滴加足量稀HNO3产生气泡有CO32-若无现象无CO32-2、滴加
Ba(NO3)2试剂产生沉淀有SO42-若无现象无SO42-3、滴加
AgNO3试剂产生沉淀有Cl-若无现象无Cl-食用松花蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋D化学与生活这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,使馒头内生成许多小洞,因此馒头疏松多孔。知识回顾 氢氧化钠的化学性质和用途能使紫色石蕊试剂变蓝色,无色酚酞变红色。CO2+2NaOH=Na2CO3+H2O吸收或除去
CO2 NaOH+HCl=NaCl+H2O化工生产2NaOH+CuSO4=Cu(OH)2↓+Na2SO4制取不
溶性碱知识回顾 氢氧化钙的化学性质和用途能使紫色石蕊试剂变蓝色,无色酚酞变红色。检验CO2Ca(OH)2+H2SO4=CaSO4+2H2O改良酸性土壤
处理污水制取不
溶性碱CO2+Ca(OH)2=CaCO3↓+H2O3Ca(OH)2+2FeCl3 = 2Fe(OH)3↓+3CaCl2知识回顾2、氢氧化钠固体或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O思 考1、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞?而是用橡皮塞或木塞。SiO2+2NaOH=Na2SiO3+H2O思考1、实验室的氢氧化钠应该如何保存?为什么?实验室氢氧化钠固体必须密封保存,因为氢氧化钠暴露在空气中,不仅易吸收空气中的水分而潮解,而且还易跟空气中的二氧化碳反应而变质。2、氢氧化钠固体具有易潮解的性质,你觉得在这方面应有什么用途?而在使用时又应注意什么?实验室根据氢氧化钠易潮解的性质,常用它来作干燥剂。但它不能干燥酸性类气体,如:CO2、SO2、H2S、HCl.(可溶性)碱的通性:1、与指示剂反应 碱溶液能使紫色石蕊变蓝,无色酚酞变红.2、碱 + 非金属氧化物 = 盐 + 水3、碱 + 酸 = 盐 + 水 (中和反应)4、碱 + 盐 = 新碱 + 新盐NaOH + HCI = NaCI + H2O2NaOH + CuCI2 = Cu(OH)2↓ + 2NaCI Ca(OH)2 + CO2 = CaCO3↓+ H2O知识小结注意:碱溶液具有一些相似
的化学性质,是因为碱溶液中都含有OH—1.不溶性碱受热易分解
碱的化学性质拓展但CuO+H2O不能反应生成Cu(OH)2 。即不
性碱不能由对应的金属氧化物与水反应生成。2.可溶性碱受热不分解如Ca(OH) 2 、NaOH受热不分解但 CaO+H2O= Ca(OH)2 Na2O+H2O= 2NaOH
即可溶性碱能由对应的金属氧化物与水反应生成。
知识拓展含义:表示溶液酸碱性强弱的物理量范围碱性增强酸性增强PH = 7,溶液呈中性PH<7,溶液呈酸性PH>7,溶液呈碱性PH知识回顾问题探究用盐酸中和NaOH溶液的过程中,可用什么方法检验酸或碱是否过量?答:可用酸碱指示剂来检验,如再滴入紫色石蕊试液变红色说明是酸过量,变蓝色,说明是碱过量.
也可以用PH试纸来检验,反应完后,若PH>7时,说明是碱过量,若PH<7时,说明是酸过量.复 分 解 反 应2.复分解反应发生的条件:两种化合物交换成分后要有沉淀或气体或水生成。
3.酸跟碱、酸跟盐反应时,反应物至少一种是可溶的。
碱跟盐、盐跟盐反应时,反应物都必须是可溶的。 1.复分解反应——由两种化合物互相交换成分,
生成另外两种化合物的反应,叫做复分解反应。
AB + CD = AD + CB知识回顾判定:MgO和H2SO4反应,生成了MgSO4和H2O(生成盐和水),这个反应是中和反应吗?答:这不是中和反应,因为中和反应应该是酸和碱作用生成盐和水的反应,不能单看生成物是盐和水,所以这个反应不是中和反应.1、中和反应定义:碱跟酸作用生成盐和水的反应叫中和反应。中和反应知识回顾2、中和反应的实质:实质是酸电离的H+与碱电离的OH-结合成中性的水。
H+ + OH- = H2O干燥剂浓 硫 酸碱性气体 如 NH3知识回顾 酸性气体 如CO2、SO2、HCl干燥装置浓硫酸用洗气瓶
氢氧化钠、生石灰、碱石灰
用球形干燥管或者U型管等知识回顾下列潮湿的气体——
不能用氢氧化钠干燥的是( ),
不能用浓硫酸干燥的是( )。
A,一氧化碳;B,氢气;C,二氧化碳;
D,氧气;E,氨气;F,氯化氢;
G,二氧化硫。问题探究 C F G E 谈一谈
你有什么收获?
还有什么困惑?酸(H+)碱(OH-)某些盐金属
氧化物指示剂活泼金属酸可以与指示剂、活泼金属、某些金属氧化物、碱、某些盐发生化学反应。知识小结碱(OH-)某些盐非金属
氧化物指示剂(可溶性)碱可以与指示剂、某些金属氧化物、碱、某些盐发生化学反应。酸(H+)知识小结 1、氢氧化钠必须密封保存是因
为 和 ,为了验证一瓶氢氧化钠是否变质,通常加入 ,原因是(用化学方程式表示)
。 吸收空气中的二氧化碳稀盐酸Na2CO3+2HCl=2NaCl+H2O+CO2 ↑潮解变质:2NaOH + CO2 = Na2CO3 + H2O当堂达标2、下列物质的名称、俗名、化学式一致的是( )
A.氢氧化钙、消石灰、CaO
B.氧化铁、铁锈、FeO
C.氢氯酸、盐酸、HClO3
D.氢氧化钠、烧碱、NaOH D当堂达标3、欲干燥二氧化碳气体,应选用的干燥剂是( )
A.氢氧化钠固体 B.浓硫酸
C.稀硫酸 D.生石灰B4、关于氢氧化钠和氢氧化钙的下列
说法中不正确的是( )
A.都是白色固体,前者易溶于水,后者微
溶于水
B.都不能敞口存放,因为都能跟空气中的
二氧化碳反应
C.两者的水溶液都显碱性,都能使酚酞变
红色、石蕊变蓝色
D.都易吸收空气中的水蒸气,可作干燥剂D当堂达标5、某物质进行下列三个实验:①滴入紫色
石蕊试液变蓝色;②滴入Cu(NO3)2溶液;
产生蓝色沉淀;③加入Na2CO3溶液产生
白色沉淀,则该物质是( )双选
A.NaOH溶液 B.Fe(OH)3
C.澄清石灰水 D.Ba(OH)2C D当堂达标6、大理石、石灰石、汉白玉、水垢、鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将生成的气体通入澄清的石灰水中,可观察到什么现象?写出有关反应的化学方程式。2HCl + CaCO3 = CaCl2 + H2O + CO2↑ Ca(OH)2 + CO2 = CaCO3 ↓ + H2O化学与生活当堂达标7.下列各组气体中,均能用固体NaOH干燥的一组是:( )A. H2、 O2 、CO; B. H2、 O2 、CO2;
C. H2、 SO2、 CO2; D. O2、 CO 、CO2。A8.为检测长期暴露在空气的氢氧化钠是否变质,可取少量样品加入 溶液,若观察到有 ,则NaOH已经变质。该反应方程式为稀盐酸气泡产生Na2CO3+2HCl=2NaCl+CO2↑+H2O当堂达标谢谢
复习课酸盐酸硫酸复分解反应酸的通性含义范围检验硫酸根离子
酸( )
碱( )
化合物
盐 ( )
氧化物( )
现有H+、OH- 、 NO3- 、 Fe3+四种离子,请说出它们可能组成的酸、碱、盐、氧化物的化学式填在相应的位置。H+
酸根离子金属离子
OH-金属离子
酸根离子HNO3Fe(OH) 3Fe(NO3) 3 H2O我来试一试2、下列物质具有相同酸根离子的是( )
A、Na2SO4 Na2SO3 B 、KMnO4 K2MnO4
C 、 KClO3 KCl D、 FeSO4 Fe2(SO4)3AD在线检测常见的酸无 有刺激性
液无 无
粘稠、油状液有白雾产生(有挥发性)无现象 用于金属表面除锈用于金属表面除锈
浓硫酸可作干燥剂知识回顾错误操作:由于浓硫酸密度比水大,浮在上面,而浓硫酸溶于水时, 放出大量的热,会产生局部高温,使水沸腾,造成液滴飞溅出来。正确操作:把浓硫酸慢慢地沿容器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。浓硫酸的稀释知识回顾稀盐酸的化学性质和用途能使紫色石蕊试液变红色,无色酚酞不变色Zn+2HCl=ZnCl2+H2↑实 验 室
制 氢 气Fe2O3+6HCl=2FeCl3+3H2O金 属 表
面 除 锈Al(OH)3+3HCl=AlCl3+3H2OAgNO3+HCl=AgCl ↓ +HNO3治疗胃
酸过多检 验 Cl- 知识回顾Cl-的检验方法:滴加AgNO3溶液出现白
色沉淀,再滴入稀硝酸沉淀不溶解。稀硫酸的化学性质和用途能使紫色石蕊试剂变红色,无色酚酞不变色Zn+H2SO4=ZnSO4+H2↑实 验 室
制 氢 气CuO+H2SO4=CuSO4+H2O金 属 表
面 除 锈 Ca(OH)2+H2SO4=CaSO4+2H2O改良酸性土壤
处理污水 BaCl2+H2SO4=BaSO4 ↓ +2HCl检验SO42-知识回顾SO42—的检验方法:(先加足量稀盐酸 )滴加BaCl2溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。硝酸钡 . 酸的通性:1、与指示剂反应 酸能使紫色石蕊变红,
无色酚酞不变色。4、酸+ 碱 〓 盐 + 水 5、酸+ 盐 = 新酸 + 新盐 3、酸+碱性氧化物= 盐 + 水2、酸+ 金属 = 盐 + 氢气HCl + AgNO3 = AgCl ↓ + HNO3
H2SO4 +BaCl2 = BaSO4↓ + 2HCl酸溶液具有一些相似的化学性质,是因为酸溶液中都含有H+知识小结检验Cl-或SO42-时,为什么要加稀HNO3? 检验Cl-和SO42—时,要加足量稀硝酸,目的是除去CO32—等杂质离子的干扰。因为CO32—与AgNO3或BaCl2溶液接触时,也有白色沉淀Ag2CO3、BaCO3生成,但这些沉淀都溶于稀硝酸。如 BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
Ag2CO3+2HNO3=2AgNO3+CO2↑+H2O
而AgCl和BaSO4则不溶于稀硝酸,所以在检验时一定要加足量稀硝酸,如果白色沉淀不溶解,才能确认有Cl-或SO42-。知识拓展溶液有可能同时存在Cl-和SO42-时,先检验哪种离子?
请分别写出HCl、H2SO4和AgNO3反应的化学方程式,借助化学方程式分析。 应该先检验SO42-,而且用Ba(NO3)2溶液和稀硝酸代替BaCl2溶液和盐酸作试剂。且需将BaSO4沉淀滤去,再往滤液中加AgNO3溶液和稀硝酸检验Cl-。因为硫酸银微溶于水,如果溶液中SO42-浓度较大,若先检验Cl-,加入AgNO3溶液时,会生成Ag2SO4(微溶)沉淀,而干扰Cl-的检验。?知识拓展某无色溶液中含有Cl-、SO42-、CO32-中的一种或几种怎样将它们逐一鉴别出来,写出操作步骤、现象、结论精讲精练1、取样滴加足量稀HNO3产生气泡有CO32-若无现象无CO32-2、滴加
Ba(NO3)2试剂产生沉淀有SO42-若无现象无SO42-3、滴加
AgNO3试剂产生沉淀有Cl-若无现象无Cl-食用松花蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋D化学与生活这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,使馒头内生成许多小洞,因此馒头疏松多孔。知识回顾 氢氧化钠的化学性质和用途能使紫色石蕊试剂变蓝色,无色酚酞变红色。CO2+2NaOH=Na2CO3+H2O吸收或除去
CO2 NaOH+HCl=NaCl+H2O化工生产2NaOH+CuSO4=Cu(OH)2↓+Na2SO4制取不
溶性碱知识回顾 氢氧化钙的化学性质和用途能使紫色石蕊试剂变蓝色,无色酚酞变红色。检验CO2Ca(OH)2+H2SO4=CaSO4+2H2O改良酸性土壤
处理污水制取不
溶性碱CO2+Ca(OH)2=CaCO3↓+H2O3Ca(OH)2+2FeCl3 = 2Fe(OH)3↓+3CaCl2知识回顾2、氢氧化钠固体或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O思 考1、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞?而是用橡皮塞或木塞。SiO2+2NaOH=Na2SiO3+H2O思考1、实验室的氢氧化钠应该如何保存?为什么?实验室氢氧化钠固体必须密封保存,因为氢氧化钠暴露在空气中,不仅易吸收空气中的水分而潮解,而且还易跟空气中的二氧化碳反应而变质。2、氢氧化钠固体具有易潮解的性质,你觉得在这方面应有什么用途?而在使用时又应注意什么?实验室根据氢氧化钠易潮解的性质,常用它来作干燥剂。但它不能干燥酸性类气体,如:CO2、SO2、H2S、HCl.(可溶性)碱的通性:1、与指示剂反应 碱溶液能使紫色石蕊变蓝,无色酚酞变红.2、碱 + 非金属氧化物 = 盐 + 水3、碱 + 酸 = 盐 + 水 (中和反应)4、碱 + 盐 = 新碱 + 新盐NaOH + HCI = NaCI + H2O2NaOH + CuCI2 = Cu(OH)2↓ + 2NaCI Ca(OH)2 + CO2 = CaCO3↓+ H2O知识小结注意:碱溶液具有一些相似
的化学性质,是因为碱溶液中都含有OH—1.不溶性碱受热易分解
碱的化学性质拓展但CuO+H2O不能反应生成Cu(OH)2 。即不
性碱不能由对应的金属氧化物与水反应生成。2.可溶性碱受热不分解如Ca(OH) 2 、NaOH受热不分解但 CaO+H2O= Ca(OH)2 Na2O+H2O= 2NaOH
即可溶性碱能由对应的金属氧化物与水反应生成。
知识拓展含义:表示溶液酸碱性强弱的物理量范围碱性增强酸性增强PH = 7,溶液呈中性PH<7,溶液呈酸性PH>7,溶液呈碱性PH知识回顾问题探究用盐酸中和NaOH溶液的过程中,可用什么方法检验酸或碱是否过量?答:可用酸碱指示剂来检验,如再滴入紫色石蕊试液变红色说明是酸过量,变蓝色,说明是碱过量.
也可以用PH试纸来检验,反应完后,若PH>7时,说明是碱过量,若PH<7时,说明是酸过量.复 分 解 反 应2.复分解反应发生的条件:两种化合物交换成分后要有沉淀或气体或水生成。
3.酸跟碱、酸跟盐反应时,反应物至少一种是可溶的。
碱跟盐、盐跟盐反应时,反应物都必须是可溶的。 1.复分解反应——由两种化合物互相交换成分,
生成另外两种化合物的反应,叫做复分解反应。
AB + CD = AD + CB知识回顾判定:MgO和H2SO4反应,生成了MgSO4和H2O(生成盐和水),这个反应是中和反应吗?答:这不是中和反应,因为中和反应应该是酸和碱作用生成盐和水的反应,不能单看生成物是盐和水,所以这个反应不是中和反应.1、中和反应定义:碱跟酸作用生成盐和水的反应叫中和反应。中和反应知识回顾2、中和反应的实质:实质是酸电离的H+与碱电离的OH-结合成中性的水。
H+ + OH- = H2O干燥剂浓 硫 酸碱性气体 如 NH3知识回顾 酸性气体 如CO2、SO2、HCl干燥装置浓硫酸用洗气瓶
氢氧化钠、生石灰、碱石灰
用球形干燥管或者U型管等知识回顾下列潮湿的气体——
不能用氢氧化钠干燥的是( ),
不能用浓硫酸干燥的是( )。
A,一氧化碳;B,氢气;C,二氧化碳;
D,氧气;E,氨气;F,氯化氢;
G,二氧化硫。问题探究 C F G E 谈一谈
你有什么收获?
还有什么困惑?酸(H+)碱(OH-)某些盐金属
氧化物指示剂活泼金属酸可以与指示剂、活泼金属、某些金属氧化物、碱、某些盐发生化学反应。知识小结碱(OH-)某些盐非金属
氧化物指示剂(可溶性)碱可以与指示剂、某些金属氧化物、碱、某些盐发生化学反应。酸(H+)知识小结 1、氢氧化钠必须密封保存是因
为 和 ,为了验证一瓶氢氧化钠是否变质,通常加入 ,原因是(用化学方程式表示)
。 吸收空气中的二氧化碳稀盐酸Na2CO3+2HCl=2NaCl+H2O+CO2 ↑潮解变质:2NaOH + CO2 = Na2CO3 + H2O当堂达标2、下列物质的名称、俗名、化学式一致的是( )
A.氢氧化钙、消石灰、CaO
B.氧化铁、铁锈、FeO
C.氢氯酸、盐酸、HClO3
D.氢氧化钠、烧碱、NaOH D当堂达标3、欲干燥二氧化碳气体,应选用的干燥剂是( )
A.氢氧化钠固体 B.浓硫酸
C.稀硫酸 D.生石灰B4、关于氢氧化钠和氢氧化钙的下列
说法中不正确的是( )
A.都是白色固体,前者易溶于水,后者微
溶于水
B.都不能敞口存放,因为都能跟空气中的
二氧化碳反应
C.两者的水溶液都显碱性,都能使酚酞变
红色、石蕊变蓝色
D.都易吸收空气中的水蒸气,可作干燥剂D当堂达标5、某物质进行下列三个实验:①滴入紫色
石蕊试液变蓝色;②滴入Cu(NO3)2溶液;
产生蓝色沉淀;③加入Na2CO3溶液产生
白色沉淀,则该物质是( )双选
A.NaOH溶液 B.Fe(OH)3
C.澄清石灰水 D.Ba(OH)2C D当堂达标6、大理石、石灰石、汉白玉、水垢、鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将生成的气体通入澄清的石灰水中,可观察到什么现象?写出有关反应的化学方程式。2HCl + CaCO3 = CaCl2 + H2O + CO2↑ Ca(OH)2 + CO2 = CaCO3 ↓ + H2O化学与生活当堂达标7.下列各组气体中,均能用固体NaOH干燥的一组是:( )A. H2、 O2 、CO; B. H2、 O2 、CO2;
C. H2、 SO2、 CO2; D. O2、 CO 、CO2。A8.为检测长期暴露在空气的氢氧化钠是否变质,可取少量样品加入 溶液,若观察到有 ,则NaOH已经变质。该反应方程式为稀盐酸气泡产生Na2CO3+2HCl=2NaCl+CO2↑+H2O当堂达标谢谢
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
