人教版高中化学必修一第四章第四节氨 硝酸 硫酸 课件(共35张PPT)
文档属性
| 名称 | 人教版高中化学必修一第四章第四节氨 硝酸 硫酸 课件(共35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-10 15:52:01 | ||
图片预览











文档简介
(共35张PPT)
§4.4第四节 氨 硝酸 硫酸
【学习目标】
【重点难点】
浓硫酸的吸水性、脱水性和强氧化性。
掌握浓硫酸的特性(吸水性、脱水性、强氧化性)。
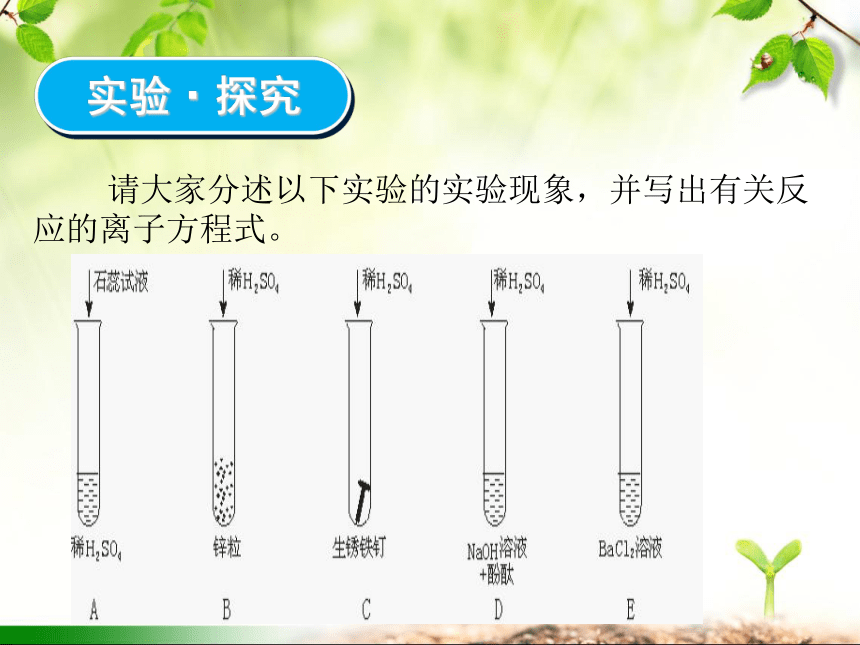
实验·探究
请大家分述以下实验的实验现象,并写出有关反应的离子方程式。
思考·交流
现有失去标签的浓硫酸、浓盐酸各一瓶(瓶相同,酸体积相同),不用化学方法如何鉴别?根据是什么? 注意观察、对比。根据物理性质的区别。
归纳·整理
1.物理性质
浓硫酸是一种无色油状液体。高沸点难挥发的强酸,密度大,极易溶于水。
现象:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
实验
在试管中放入
少量胆矾,再加
入少量浓硫酸
实验·探究
反应:
固体由蓝色变为灰白色,溶液仍为无色。
实验·探究
实验·探究
用玻璃棒蘸取浓硫酸滴兰色石蕊试纸上
(试纸先变红后变黑)
思考·交流
石蕊试纸先变红,后变黑,黑色的物质是什么?这种现象体现浓硫酸何种特性?这两个实验体现浓硫酸的何种性质?
2、浓硫酸的特性
⑴ 吸水性
用途:可以作干燥剂, 可以干燥的气体,如
H2、O2、Cl2、CO2、CO、CH4、SO2、 N2、NO2、NO、HCl。
浓硫酸吸收物质本来就有的水,直接与水分子结合。
不能干燥:NH3、H2S、HBr、HI。
思考·交流
拓展·提高
在胆矾晶体由兰色变为白色体现浓硫酸的吸水性。石蕊试纸先变红后变黑,黑色物质为炭,浓硫酸使它逐渐变黑的现象称为“炭化”。这是浓H2SO4酸性和脱水性的体现。
新闻事件
实验·探究
蔗糖与浓H2SO4的反应
视频
null
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
蔗糖
反应如下:
C12H22O11 12C+11H2O
浓硫酸
实验·探究
⑵ 脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
归纳·总结
问题·探究
蔗糖遇浓H2SO4炭化,生成黑色物质体积膨胀为疏松多孔状,说明有气体产生,那么气体是哪一种,如何形成的?这体现浓硫酸的什么性质?
思考·交流
吸水性和脱水性有何区别?
吸水是指吸收物质中本来就有的湿存水(或水蒸气),脱水是指将化合物(主要是有机物)分子中的氢、氧两种元素按原子个数比2∶1(即按水的组成比例)脱去。浓硫酸的腐蚀性就缘于它的脱水性。
思考·交流
1.碳能与浓硫酸在加热条件下反应,那么金属呢?稀H2SO4具有酸的通性,稀H2SO4能否和铜反应?为什么?
2.浓H2SO4能否与铜反应呢
实验·探究
浓硫酸与铜的反应
视频
实验·分析
铜与浓硫酸反应需什么条件? 请描述实验现象,据实验现象推测反应生成物,试管Ⅱ口部棉团的作用,试写出反应方程式。
反应物 条件 现象 结论
有使品红褪色
的气体产生
产物为SO2
溶液变蓝
产物有铜盐
不加热
加热
不加热
加热
铜和
稀硫酸
铜和
浓硫酸
无变化
常温下不反应
无变化
常温下不反应
无变化
加热也不反应
铜分别和浓、稀硫酸反应比较
实验·探究
①与不活泼金属反应
Cu + 2H2SO4(浓) == CuSO4+ SO2↑+ 2H2O
若铜过量,硫酸能否完全反应?为什么?
(3)氧化性
实验·探究
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
归纳·整理
运硫酸的铁罐车
科学视野
②与某些非金属反应
气态的CO2、SO2从炭的空隙中冲出,导致了炭内形成无数个分布不均的孔洞,使炭呈多孔蓬松状。
实验·探究
如何用实验方法证明木炭与浓硫酸反应的产物?
提供以下试剂与装置(装置可多次使用):
品红
KMnO4溶液
饱和NaHCO3
澄清石灰水
无水硫酸铜
仪器连接如下:
说明:应首先用无水硫酸铜验证水,然后用品红验证二氧化硫,再用高锰酸钾氧化多余的二氧化硫,接着再次验证二氧化硫是否全部被氧化吸收,最后才验证二氧化碳。
③与活泼金属
常温下,与铁和铝等接触发生钝化
受热时,能跟绝大多数金属发生反应
实验·探究
浓硫酸具有强氧化性,稀硫酸是否有氧化性?如果有,其氧化性与浓硫酸的氧化性有何不同?
浓硫酸与稀硫酸比较:
稀硫酸:弱氧化性(由H+体现)——H2
浓硫酸:强氧化性(由 S体现)——SO2
思考·交流
练习:下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑.
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(1)脱水性;(2) 吸水性;(3) 酸性;
(4)酸性和强氧化性;(5)难挥发性;
(6)强氧化性;(7)强酸性。
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
交流·研讨
3、硫酸的用途:
①高沸点——制取挥发性酸。
②吸水性——做干燥剂。
③脱水性——做催化剂。
④酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥。
⑤强氧化性——制炸药。
硫酸的产量被视为一个国家无机化工工业发展水平的标志
思考·交流
1、难挥发性
一、浓硫酸的特性
2、吸水性
3、脱水性
4、强氧化性
本节小结
二、硫酸的用途
再 见
§4.4第四节 氨 硝酸 硫酸
【学习目标】
【重点难点】
浓硫酸的吸水性、脱水性和强氧化性。
掌握浓硫酸的特性(吸水性、脱水性、强氧化性)。
实验·探究
请大家分述以下实验的实验现象,并写出有关反应的离子方程式。
思考·交流
现有失去标签的浓硫酸、浓盐酸各一瓶(瓶相同,酸体积相同),不用化学方法如何鉴别?根据是什么? 注意观察、对比。根据物理性质的区别。
归纳·整理
1.物理性质
浓硫酸是一种无色油状液体。高沸点难挥发的强酸,密度大,极易溶于水。
现象:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
实验
在试管中放入
少量胆矾,再加
入少量浓硫酸
实验·探究
反应:
固体由蓝色变为灰白色,溶液仍为无色。
实验·探究
实验·探究
用玻璃棒蘸取浓硫酸滴兰色石蕊试纸上
(试纸先变红后变黑)
思考·交流
石蕊试纸先变红,后变黑,黑色的物质是什么?这种现象体现浓硫酸何种特性?这两个实验体现浓硫酸的何种性质?
2、浓硫酸的特性
⑴ 吸水性
用途:可以作干燥剂, 可以干燥的气体,如
H2、O2、Cl2、CO2、CO、CH4、SO2、 N2、NO2、NO、HCl。
浓硫酸吸收物质本来就有的水,直接与水分子结合。
不能干燥:NH3、H2S、HBr、HI。
思考·交流
拓展·提高
在胆矾晶体由兰色变为白色体现浓硫酸的吸水性。石蕊试纸先变红后变黑,黑色物质为炭,浓硫酸使它逐渐变黑的现象称为“炭化”。这是浓H2SO4酸性和脱水性的体现。
新闻事件
实验·探究
蔗糖与浓H2SO4的反应
视频
null
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
蔗糖
反应如下:
C12H22O11 12C+11H2O
浓硫酸
实验·探究
⑵ 脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
归纳·总结
问题·探究
蔗糖遇浓H2SO4炭化,生成黑色物质体积膨胀为疏松多孔状,说明有气体产生,那么气体是哪一种,如何形成的?这体现浓硫酸的什么性质?
思考·交流
吸水性和脱水性有何区别?
吸水是指吸收物质中本来就有的湿存水(或水蒸气),脱水是指将化合物(主要是有机物)分子中的氢、氧两种元素按原子个数比2∶1(即按水的组成比例)脱去。浓硫酸的腐蚀性就缘于它的脱水性。
思考·交流
1.碳能与浓硫酸在加热条件下反应,那么金属呢?稀H2SO4具有酸的通性,稀H2SO4能否和铜反应?为什么?
2.浓H2SO4能否与铜反应呢
实验·探究
浓硫酸与铜的反应
视频
实验·分析
铜与浓硫酸反应需什么条件? 请描述实验现象,据实验现象推测反应生成物,试管Ⅱ口部棉团的作用,试写出反应方程式。
反应物 条件 现象 结论
有使品红褪色
的气体产生
产物为SO2
溶液变蓝
产物有铜盐
不加热
加热
不加热
加热
铜和
稀硫酸
铜和
浓硫酸
无变化
常温下不反应
无变化
常温下不反应
无变化
加热也不反应
铜分别和浓、稀硫酸反应比较
实验·探究
①与不活泼金属反应
Cu + 2H2SO4(浓) == CuSO4+ SO2↑+ 2H2O
若铜过量,硫酸能否完全反应?为什么?
(3)氧化性
实验·探究
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
归纳·整理
运硫酸的铁罐车
科学视野
②与某些非金属反应
气态的CO2、SO2从炭的空隙中冲出,导致了炭内形成无数个分布不均的孔洞,使炭呈多孔蓬松状。
实验·探究
如何用实验方法证明木炭与浓硫酸反应的产物?
提供以下试剂与装置(装置可多次使用):
品红
KMnO4溶液
饱和NaHCO3
澄清石灰水
无水硫酸铜
仪器连接如下:
说明:应首先用无水硫酸铜验证水,然后用品红验证二氧化硫,再用高锰酸钾氧化多余的二氧化硫,接着再次验证二氧化硫是否全部被氧化吸收,最后才验证二氧化碳。
③与活泼金属
常温下,与铁和铝等接触发生钝化
受热时,能跟绝大多数金属发生反应
实验·探究
浓硫酸具有强氧化性,稀硫酸是否有氧化性?如果有,其氧化性与浓硫酸的氧化性有何不同?
浓硫酸与稀硫酸比较:
稀硫酸:弱氧化性(由H+体现)——H2
浓硫酸:强氧化性(由 S体现)——SO2
思考·交流
练习:下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑.
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(1)脱水性;(2) 吸水性;(3) 酸性;
(4)酸性和强氧化性;(5)难挥发性;
(6)强氧化性;(7)强酸性。
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
交流·研讨
3、硫酸的用途:
①高沸点——制取挥发性酸。
②吸水性——做干燥剂。
③脱水性——做催化剂。
④酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥。
⑤强氧化性——制炸药。
硫酸的产量被视为一个国家无机化工工业发展水平的标志
思考·交流
1、难挥发性
一、浓硫酸的特性
2、吸水性
3、脱水性
4、强氧化性
本节小结
二、硫酸的用途
再 见
