人教版高中化学必修一第二章第三节氧化还原反应 课件(共33张PPT)
文档属性
| 名称 | 人教版高中化学必修一第二章第三节氧化还原反应 课件(共33张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 803.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-11 09:37:15 | ||
图片预览











文档简介
(共33张PPT)
第二章 化学物质及其变化
§2.3 氧化还原反应
(1)CaO+H2O = Ca(OH)2
(2)NaOH+HCl = NaCl+H2O
(3)Fe+CuSO4 = FeSO4+Cu
(4)CaCO3 = CaO+CO2↑
(5)Fe2O3+3CO = 2Fe+3CO2
(化合反应)
(置换反应)
(复分解反应)
(分解反应)
高温
?
下列反应属于什么类型?
失氧被还原,发生还原反应
得氧被氧化,发生氧化反应
同时发生
得氧被氧化,发生氧化反应
CuO + H2 == Cu + H2O
失氧被还原,发生还原反应
Fe2O3
Fe
CO
CO2
CuO
Cu
H2
H2O
该反应为氧化还原反应
以上反应在得氧失氧的同时,元素的化合价在反应前后是否发生了变化?
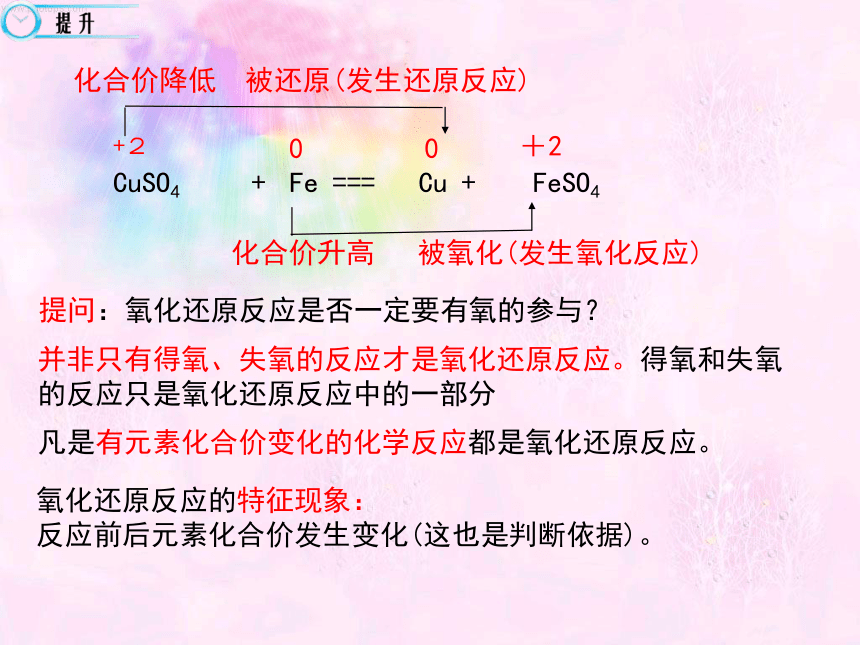
CuSO4 + Fe === Cu + FeSO4
化合价降低 被还原(发生还原反应)
+2
0
0
+2
化合价升高 被氧化(发生氧化反应)
并非只有得氧、失氧的反应才是氧化还原反应。得氧和失氧的反应只是氧化还原反应中的一部分
凡是有元素化合价变化的化学反应都是氧化还原反应。
提问:氧化还原反应是否一定要有氧的参与?
氧化还原反应的特征现象:
反应前后元素化合价发生变化(这也是判断依据)。
化学反应(反应条件未标) 氧化还原反应
CaCO3==CaO+CO2↑
H2O+ CaO == Ca(OH)2
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl +BaSO4
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
2H2O=2H2↑+O2↑
非氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
0
0
+1
-1
2e-
化合价升降的原因:
电子的得失
元素的化合价为什么会发生变化?化合价的升降是什么原因引起的?
Cl
Cl-
Na+
H Cl
+17
+1
H Cl
+1 -1
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
+1
H
+17
Cl
氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应的特征现象:
反应前后元素化合价发生变化(这也是判断依据)。
升失氧是还原剂
降得还是氧化剂
高 原 氧
低 氧 还
失电子
化合价升高
做还原剂
被氧化
剂氧化
得电子
化合价降低
被还原
剂还原
做氧化剂
失电子,化合价升高
被氧化剂氧化,发生氧化反应
得电子,化合价降低
被还原剂还原,发生还原反应
还原剂
氧化剂
反应物
氧化产物
还原产物
生成物
氧化
反应
氧化产物
还原
反应
还原产物
电子转移的表示方法----"双线桥"法
步骤:
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”及相应的电子数
注意:失电子总数=得电子总数
2Na+ Cl2 = 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2 e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
2Na+ Cl2 = 2NaCl
0
0
+1
-1
价态变化原子个数 × 每个原子得失电子数
用双线桥法分析下列反应:
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
化合价升高,失去2×3e- ,被氧化
化合价降低,得到2×3e- ,被还原
0
+3
0
+3
-2
-1
0
+5
化合价降低,得到2×6e- ,被还原
化合价升高,失去6×2e- ,被氧化
表示反应过程中电子在反应物之间的转移情况。
注意:①单线桥必须画在反应物中,且箭号从还原剂某元素中指向氧化剂某元素中。
②箭号表示电子转移的方向,线桥不必注明得失。
③数字表示某原子失去电子(也是另一元素得到电子)的总数。
单线桥法:
2CuO + C 2 Cu + CO2
高温
4e-
+2 0 0 +4
氧化剂 还原剂
化学反应(反应条件未标) 基本类型 氧化还原反应
CaCO3==CaO+CO2↑
H2O+ CaO == Ca(OH)2
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl +BaSO4
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
2H2O=2H2↑+O2↑
分解反应
分解反应
复分解反应
化合反应
化合反应
置换反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
复分解反应
化合反应、分解反应 氧化还原反应;
置换反应 氧化还原反应;
复分解反应 氧化还原反应;
不一定是
一定是
一定不是
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
氧化还原反应在日常生活中、工农业生产中都有广泛的应用
日常生活中:煤、煤气、天然气的燃烧、酿酒、食物在人体中被消化、人和动物的呼吸等。
工业生产中:金属的冶炼、石油化工、日用化工、电镀、干电池、蓄电池等。
农业生产中:植物的光合作用、农药的制取等。
但也有些是对人类不利于的,如:
(1)易燃物的自燃
(2)食物的腐败
(3)钢铁的锈蚀
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O B.2Na+2H2O=2NaOH+H2
C.Zn+CuSO4=ZnSO4+Cu D.Ca(OH)2+CO2=CaCO3 + H2O
BC
+4 -2 +1-1 +2 -1 +1-2 0
2.在反应MnO2 + 4HCl = MnCl2 + 2H2O+ Cl2↑,
元素化合价升高,被 (填"氧化"或"还原"),发生 (填"氧化"或"还原")反应;
元素化合价降低,被 (填"氧化"或"还原"),发生 (填"氧化"或"还原")反应。
Cl
氧化
Mn
氧化
还原
还原
常见元素主要化合价口诀
钾钠银氢正一价;钙镁钡锌正二价;
氟氯溴碘负一价;通常氧是负二价;
铜正一二铝正三;铁正二三硅正四;
碳有正二和正四;硫有负二正四六;
负三正五氮和磷;锰为正二四六七。
H2、Cu、CuO、
HCl、HClO、 KClO3 、HClO4、
KMnO4、K2MnO4、NaOH、Na2O2
单质分子中,元素的化合价为0
在化合物里,正负化合价的代数和为零
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0
0
+1
-1
2e-
化合价升降的原因:
电子的得失
用于表示反应中反应物电子转移方向和数目的单箭头——单线桥
还原剂
氧化剂
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
单线桥——用于表示反应中反应物电子转移方向和数目
还原剂
氧化剂
失电子
化合价升高
被氧化剂氧化
得电子
化合价降低
被还原剂还原
(本质判据)
( 特征判据)
氧化反应
还原反应
氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应
升失氧(氧化反应)
降得还(还原反应)
高 原 低 氧
(还原剂) (氧化剂)
做还原剂
做氧化剂
2Na+Cl2 == 2Na Cl
0
0
+1 -1
化合价升高,失去电子,被氧化,发生氧化反应
化合价降低,得到电子,被还原,发生还原反应
失去2×e-,
得到2×e-,
定义3:有电子转移(得失或偏移)的化学反应都是氧化还原反应
还原剂
氧化剂
H2 + Cl2 === 2 H Cl
0
0
+1 -1
化合价升高,电子对偏离,被氧化,发生氧化反应
化合价降低,电子对偏向,被还原, 发生还原反应
失去2×e-,
得到2×e-,
还原剂
氧化剂
双线桥——用于表示反应中反应物和生成物同种元素的化合价前后变化情况和电子得失(或转移)数目
正确判断各反应物、生成物各元素的化合价及其变化。
两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应化合价发生变化的同种元素。
电子符号用"e-"来表示。
得失电子总数表示:
价态变化原子个数 × 每个原子得失电子数。
2×3e- 6×e- 1×e- (e-) 1×2e- (2e-)
注意:反应中失去电子的总数等于得到电子的总数。
电子转移的表示方法(双线桥)
电子转移的表示方法----"双线桥"法
步骤:
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”的电子数
注意:失电子总数=得电子总数
2Na+ Cl2 = 2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化
得到2 × e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
2Na+ Cl2 = 2NaCl
0
0
+1
-1
价态变化原子个数 × 每个原子得失电子数
用双线桥法分析下列反应:
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
化合价升高,失去2×3e- ,被氧化
化合价降低,得到2×3e- ,被还原
0
+3
0
+3
-2
-1
0
+5
化合价降低,得到2×6e- ,被还原
化合价升高,失去6×2e- ,被氧化
(2)6KOH + 3Cl2 === 5KCl + KClO3 + 3H2O
(3) 3CuS + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 3S↓+4H2O
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1)2FeCl3 + Cu = 2FeCl2 +CuCl2
(4)H2S + H2SO4(浓) ==== S ↓ + SO2 + 2H2O
(5)KClO3 + 6HCl === KCl + 3Cl2↑+ 3H2O
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
①每生成3molCl2需要转移的电子的物质的量?
②当电子转移为4mol时,生成的氯气标况下体积为多少?
(2) 2H2O ==== 2H2 + O2↑
①每生成3molO2需要转移的电子的物质的量?
②当电子转移为4mol时,生成的氢气标况下体积为多少?
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1)H2S + H2SO4(浓) ==== S ↓ + SO2 + 2H2O
(2)KClO3 + 6HCl === KCl + 3Cl2↑+ 3H2O
氧化还原反应的规律
1.电子守恒规律
还原剂失电子总数=氧化剂得电子总数
或氧化剂化合价降低的总数=还原剂化合价升高的总数。
2.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
从初中得氧失氧的角度分析
Fe2O3 失氧被还原,发生还原反应
CO 得氧被氧化,发生氧化反应
同时发生对立统一缺一不可
定义1: 一种物质被还原,同时另一种物质被氧化的反 应叫氧化还原反应
得到氧,被氧化(发生氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(发生还原反应)
还原剂
氧化剂
配平的步骤:
1)标变价:正确标出反应前后化合价有变化的元素的化合价。
2)列变化:列出元素化合价升高和降低的数值
3)求总数:求元素化合价升高和降低的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
4)配系数:用观察法配平其他各物质的化学计量数。
5)细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。
氧化还原反应方程式的配平方法
-----化合价升降法
氧化还原反应的计算
MnO2+ HCl--- MnCl2+ Cl2+ H2O
1.配平该反应
2.生成1molCl2,转移电子的物质的量是多少?
3.生成2molCl2,转移电子的数目是多少?
4.反应消耗1.5molMnO2,转移电子的物质的量是多少?
5.生成1molCl2,消耗的HCl的物质的量是多少?
6.生成1molCl2,被氧化的HCl的物质的量是多少?
例题:将0.195g锌粉加入到20ml的0.1mol/LMO2+的溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO+
电子守恒:还原剂失去电子总数==氧化剂得到电子的总数
如何列电子守恒:
1mol还原剂转移的电子数 X n还原剂== 1mol氧化剂剂转移的电子数 X n氧化剂
练习:现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
第二章 化学物质及其变化
§2.3 氧化还原反应
(1)CaO+H2O = Ca(OH)2
(2)NaOH+HCl = NaCl+H2O
(3)Fe+CuSO4 = FeSO4+Cu
(4)CaCO3 = CaO+CO2↑
(5)Fe2O3+3CO = 2Fe+3CO2
(化合反应)
(置换反应)
(复分解反应)
(分解反应)
高温
?
下列反应属于什么类型?
失氧被还原,发生还原反应
得氧被氧化,发生氧化反应
同时发生
得氧被氧化,发生氧化反应
CuO + H2 == Cu + H2O
失氧被还原,发生还原反应
Fe2O3
Fe
CO
CO2
CuO
Cu
H2
H2O
该反应为氧化还原反应
以上反应在得氧失氧的同时,元素的化合价在反应前后是否发生了变化?
CuSO4 + Fe === Cu + FeSO4
化合价降低 被还原(发生还原反应)
+2
0
0
+2
化合价升高 被氧化(发生氧化反应)
并非只有得氧、失氧的反应才是氧化还原反应。得氧和失氧的反应只是氧化还原反应中的一部分
凡是有元素化合价变化的化学反应都是氧化还原反应。
提问:氧化还原反应是否一定要有氧的参与?
氧化还原反应的特征现象:
反应前后元素化合价发生变化(这也是判断依据)。
化学反应(反应条件未标) 氧化还原反应
CaCO3==CaO+CO2↑
H2O+ CaO == Ca(OH)2
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl +BaSO4
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
2H2O=2H2↑+O2↑
非氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
0
0
+1
-1
2e-
化合价升降的原因:
电子的得失
元素的化合价为什么会发生变化?化合价的升降是什么原因引起的?
Cl
Cl-
Na+
H Cl
+17
+1
H Cl
+1 -1
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
+1
H
+17
Cl
氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应的特征现象:
反应前后元素化合价发生变化(这也是判断依据)。
升失氧是还原剂
降得还是氧化剂
高 原 氧
低 氧 还
失电子
化合价升高
做还原剂
被氧化
剂氧化
得电子
化合价降低
被还原
剂还原
做氧化剂
失电子,化合价升高
被氧化剂氧化,发生氧化反应
得电子,化合价降低
被还原剂还原,发生还原反应
还原剂
氧化剂
反应物
氧化产物
还原产物
生成物
氧化
反应
氧化产物
还原
反应
还原产物
电子转移的表示方法----"双线桥"法
步骤:
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”及相应的电子数
注意:失电子总数=得电子总数
2Na+ Cl2 = 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2 e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
2Na+ Cl2 = 2NaCl
0
0
+1
-1
价态变化原子个数 × 每个原子得失电子数
用双线桥法分析下列反应:
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
化合价升高,失去2×3e- ,被氧化
化合价降低,得到2×3e- ,被还原
0
+3
0
+3
-2
-1
0
+5
化合价降低,得到2×6e- ,被还原
化合价升高,失去6×2e- ,被氧化
表示反应过程中电子在反应物之间的转移情况。
注意:①单线桥必须画在反应物中,且箭号从还原剂某元素中指向氧化剂某元素中。
②箭号表示电子转移的方向,线桥不必注明得失。
③数字表示某原子失去电子(也是另一元素得到电子)的总数。
单线桥法:
2CuO + C 2 Cu + CO2
高温
4e-
+2 0 0 +4
氧化剂 还原剂
化学反应(反应条件未标) 基本类型 氧化还原反应
CaCO3==CaO+CO2↑
H2O+ CaO == Ca(OH)2
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl +BaSO4
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
2H2O=2H2↑+O2↑
分解反应
分解反应
复分解反应
化合反应
化合反应
置换反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
氧化还原反应
复分解反应
化合反应、分解反应 氧化还原反应;
置换反应 氧化还原反应;
复分解反应 氧化还原反应;
不一定是
一定是
一定不是
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
氧化还原反应在日常生活中、工农业生产中都有广泛的应用
日常生活中:煤、煤气、天然气的燃烧、酿酒、食物在人体中被消化、人和动物的呼吸等。
工业生产中:金属的冶炼、石油化工、日用化工、电镀、干电池、蓄电池等。
农业生产中:植物的光合作用、农药的制取等。
但也有些是对人类不利于的,如:
(1)易燃物的自燃
(2)食物的腐败
(3)钢铁的锈蚀
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O B.2Na+2H2O=2NaOH+H2
C.Zn+CuSO4=ZnSO4+Cu D.Ca(OH)2+CO2=CaCO3 + H2O
BC
+4 -2 +1-1 +2 -1 +1-2 0
2.在反应MnO2 + 4HCl = MnCl2 + 2H2O+ Cl2↑,
元素化合价升高,被 (填"氧化"或"还原"),发生 (填"氧化"或"还原")反应;
元素化合价降低,被 (填"氧化"或"还原"),发生 (填"氧化"或"还原")反应。
Cl
氧化
Mn
氧化
还原
还原
常见元素主要化合价口诀
钾钠银氢正一价;钙镁钡锌正二价;
氟氯溴碘负一价;通常氧是负二价;
铜正一二铝正三;铁正二三硅正四;
碳有正二和正四;硫有负二正四六;
负三正五氮和磷;锰为正二四六七。
H2、Cu、CuO、
HCl、HClO、 KClO3 、HClO4、
KMnO4、K2MnO4、NaOH、Na2O2
单质分子中,元素的化合价为0
在化合物里,正负化合价的代数和为零
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0
0
+1
-1
2e-
化合价升降的原因:
电子的得失
用于表示反应中反应物电子转移方向和数目的单箭头——单线桥
还原剂
氧化剂
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
单线桥——用于表示反应中反应物电子转移方向和数目
还原剂
氧化剂
失电子
化合价升高
被氧化剂氧化
得电子
化合价降低
被还原剂还原
(本质判据)
( 特征判据)
氧化反应
还原反应
氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应
升失氧(氧化反应)
降得还(还原反应)
高 原 低 氧
(还原剂) (氧化剂)
做还原剂
做氧化剂
2Na+Cl2 == 2Na Cl
0
0
+1 -1
化合价升高,失去电子,被氧化,发生氧化反应
化合价降低,得到电子,被还原,发生还原反应
失去2×e-,
得到2×e-,
定义3:有电子转移(得失或偏移)的化学反应都是氧化还原反应
还原剂
氧化剂
H2 + Cl2 === 2 H Cl
0
0
+1 -1
化合价升高,电子对偏离,被氧化,发生氧化反应
化合价降低,电子对偏向,被还原, 发生还原反应
失去2×e-,
得到2×e-,
还原剂
氧化剂
双线桥——用于表示反应中反应物和生成物同种元素的化合价前后变化情况和电子得失(或转移)数目
正确判断各反应物、生成物各元素的化合价及其变化。
两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应化合价发生变化的同种元素。
电子符号用"e-"来表示。
得失电子总数表示:
价态变化原子个数 × 每个原子得失电子数。
2×3e- 6×e- 1×e- (e-) 1×2e- (2e-)
注意:反应中失去电子的总数等于得到电子的总数。
电子转移的表示方法(双线桥)
电子转移的表示方法----"双线桥"法
步骤:
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”的电子数
注意:失电子总数=得电子总数
2Na+ Cl2 = 2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化
得到2 × e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
2Na+ Cl2 = 2NaCl
0
0
+1
-1
价态变化原子个数 × 每个原子得失电子数
用双线桥法分析下列反应:
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
化合价升高,失去2×3e- ,被氧化
化合价降低,得到2×3e- ,被还原
0
+3
0
+3
-2
-1
0
+5
化合价降低,得到2×6e- ,被还原
化合价升高,失去6×2e- ,被氧化
(2)6KOH + 3Cl2 === 5KCl + KClO3 + 3H2O
(3) 3CuS + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 3S↓+4H2O
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1)2FeCl3 + Cu = 2FeCl2 +CuCl2
(4)H2S + H2SO4(浓) ==== S ↓ + SO2 + 2H2O
(5)KClO3 + 6HCl === KCl + 3Cl2↑+ 3H2O
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
①每生成3molCl2需要转移的电子的物质的量?
②当电子转移为4mol时,生成的氯气标况下体积为多少?
(2) 2H2O ==== 2H2 + O2↑
①每生成3molO2需要转移的电子的物质的量?
②当电子转移为4mol时,生成的氢气标况下体积为多少?
用双线桥标出电子转移的方向和数目,并指出氧化剂与还原剂
(1)H2S + H2SO4(浓) ==== S ↓ + SO2 + 2H2O
(2)KClO3 + 6HCl === KCl + 3Cl2↑+ 3H2O
氧化还原反应的规律
1.电子守恒规律
还原剂失电子总数=氧化剂得电子总数
或氧化剂化合价降低的总数=还原剂化合价升高的总数。
2.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
从初中得氧失氧的角度分析
Fe2O3 失氧被还原,发生还原反应
CO 得氧被氧化,发生氧化反应
同时发生对立统一缺一不可
定义1: 一种物质被还原,同时另一种物质被氧化的反 应叫氧化还原反应
得到氧,被氧化(发生氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(发生还原反应)
还原剂
氧化剂
配平的步骤:
1)标变价:正确标出反应前后化合价有变化的元素的化合价。
2)列变化:列出元素化合价升高和降低的数值
3)求总数:求元素化合价升高和降低的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
4)配系数:用观察法配平其他各物质的化学计量数。
5)细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。
氧化还原反应方程式的配平方法
-----化合价升降法
氧化还原反应的计算
MnO2+ HCl--- MnCl2+ Cl2+ H2O
1.配平该反应
2.生成1molCl2,转移电子的物质的量是多少?
3.生成2molCl2,转移电子的数目是多少?
4.反应消耗1.5molMnO2,转移电子的物质的量是多少?
5.生成1molCl2,消耗的HCl的物质的量是多少?
6.生成1molCl2,被氧化的HCl的物质的量是多少?
例题:将0.195g锌粉加入到20ml的0.1mol/LMO2+的溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO+
电子守恒:还原剂失去电子总数==氧化剂得到电子的总数
如何列电子守恒:
1mol还原剂转移的电子数 X n还原剂== 1mol氧化剂剂转移的电子数 X n氧化剂
练习:现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
