苏教版高中化学必修一1.1.1 物质的分类及转化(26张PPT)
文档属性
| 名称 | 苏教版高中化学必修一1.1.1 物质的分类及转化(26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-11 18:17:32 | ||
图片预览







文档简介
(共26张PPT)
组织建设
化学 · 必修1
物质分类与转化
学习目标
初步认识物质的科学分类方法,学会从不同角度对常见物质进行分类。
掌握四种基本反应类型,能根据化合价的变化判断是否属于氧化还原反应。
认识基本反应类型与氧化还原反应之间的关系。
情景设计
你了解这些物质的组成吗?
为何能在书架上快速找到需要的书本?
为何能在货架上快速找到需要的物品?
情景设计
你为何能从网站上快速提取需要的信息?
情景设计
一、物质的分类
交流与讨论
■分类:根据事物的共同特点分别归类
分类没有唯一性,它会根据分类的标准不同而不同.
在我们的日常生活中,常会接触到下列物质:
空气、乙醇、水、硫酸铵、铜、碘酒、碘、氧气、石墨、食盐水。
请将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
归纳小结
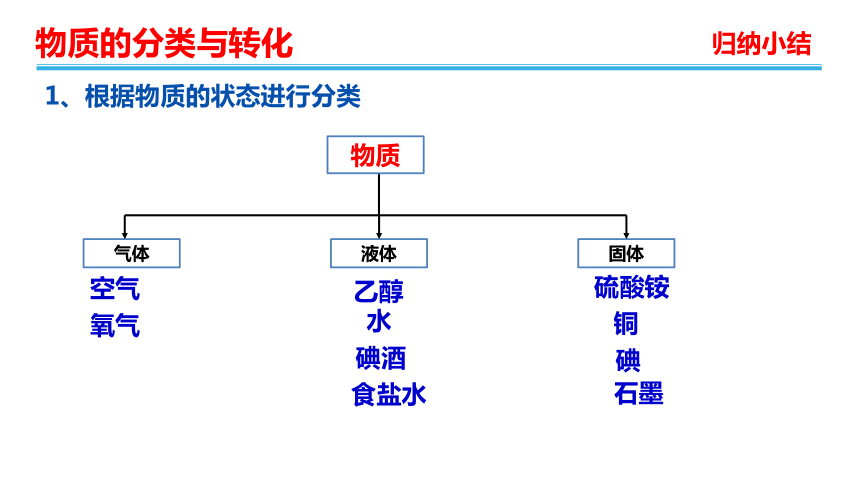
1、根据物质的状态进行分类
液体
固体
气体
物质
空气
乙醇
水
硫酸铵
铜
碘酒
氧气
碘
石墨
食盐水
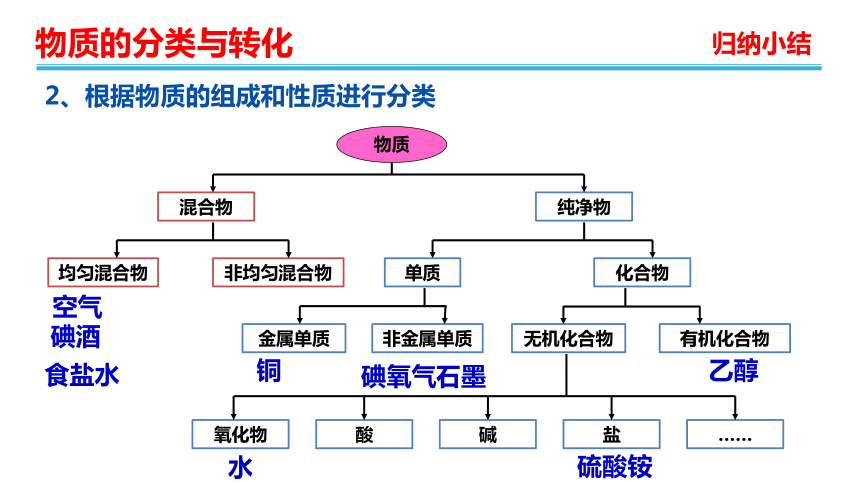
均匀混合物
非均匀混合物
单质
化合物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
氧化物
纯净物
混合物
物质
2、根据物质的组成和性质进行分类
空气
乙醇
水
硫酸铵
铜
碘酒
氧气
碘
石墨
食盐水
归纳小结
实验室中有下列物质,请根据物质的组成对它们进行分类。
钠(Na)、氯气(Cl2)、氯化铁(FeCl3 )溶液、硫酸(H2SO4)、碳酸钙(CaCO3)、氧化钙(CaO)、氢氧化钠(NaOH)、葡萄糖(C6H12O6)。
问题解决
根据物质在组成、性质上的差异,可将氧化物、酸、碱、盐等无机化合物进行更为细致的分类。
氧化物
根据化学性质
根据组成元素
金属氧化物
非金属氧化物
碱性氧化物
酸性氧化物
两性氧化物
不成盐氧化物
Na2O
CO2
Na2O
CO2
Al2O3
CO
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
酸
根据一个酸分子电离的H+个数
根据组成元素是否含氧
无氧酸
含氧酸
一元酸
二元酸
多元酸
HCl
HNO3
根据沸点高低
易挥发性酸
难挥发性酸
根据水溶性
可溶性酸
难溶性酸
HCl
H2SO4
H3PO4
HNO3
HCl
H2SO4
H3PO4
HNO3
H2SO4
H2SiO3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
碱
根据碱在水中最多能电离的OH-数
根据水溶性
可溶性碱
难溶性碱
一元碱
二元碱
多元碱
NaOH
Mg(OH)2
NaOH
Ba(OH)2
Al(OH)3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
盐
根据水溶性
根据酸根
无氧酸盐
含氧酸盐
可溶性盐
微溶性盐
难溶性盐
KCl
KNO3
根据组成盐的阴阳离子
正盐
酸式盐
NaCl
CaSO4
BaSO4
Na2CO3
NaHCO3
碱式盐
Cu2(OH)2CO3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
物质分类的方法:组成、状态、性能……
归纳小结
如对Na2O2的研究,从组成上看,Na2O2应属于金属氧化物中的碱性氧化物,但在实验验证时却发现,它与一般的碱性氧化物(如Na2O)不同,它与水反应时多生成了一种物质——O2,而且向它与水反应后的溶液中滴加酚酞试液,溶液先变红后褪色。因此,应当将其划分为氧化物中的另一类——过氧化物。
4、物质分类的应用
(1)应用物质分类思想研究物质的共性,在研究共性中发现特性。
归纳小结
如用Na、Cl、Mg、O、Cu、S、H、Ca、C九种元素组成尽可能多的物质。如果这几种元素之间漫无规律地组合,可能只能组成我们已知的十几种物质,倘若正确地运用物质分类的思想,一类一类地“对号入座”,将会发现仅这9种元素所能组成的物质,就远远超出我们的想像。
(2)用物质分类思想发现“新物质”。
归纳小结
4、物质分类的应用
某种物质的性质在某一类别中是特性,但在另一类别中,就可能是共性。如根据在水溶液中或熔融状态下是否能导电,可将酸、碱、盐归类为电解质,并由此研究离子反应发生的条件、离子方程式的书写等。
(3)应用不同的分类标准对物质进行分类研究。
归纳小结
4、物质分类的应用
KOH属于碱,CO2和SO2是酸性氧化物。请写出足量KOH溶液分别与CO2、SO2 反应的化学方程式。
问题解决
2KOH+CO2=K2CO3+H2O
2KOH+SO2=K2SO3+H2O
请写出绿色植物光合作用的化学方程式。
6CO2+6H2O C6H12O6+6O2
光照
■物质发生转化往往需要一定的条件。
常见的反应条件有(光照、点燃、加热、高温等)。
二、物质的转化
在初中阶段,我们已经学习了一些物质转化的知识。请举例说明下表中所列物质的转化类型,并将你所知道的其他转化类型补充到列表中。
物质的转化类型 化学方程式
单质→化合物
金属氧化物→氢氧化物
酸→盐
H2+Cl2 2HCl
光照
CaO+H2O=Ca(OH)2
HCl+NaOH=H2O+NaCl
2HCl+Na2CO3=H2O+2NaCl+CO2↑
交流与讨论
图1-3钙及化合物转化
CaCO3
Ca
CaCl2
Ca(OH)2
CaO
交流与讨论
1.表1-2 化学反应几种类型
反应类型 实例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+BC
化合反应
分解反应
置换反应
复分解反应
CaO+H2O=Ca(OH)2
CaCO3 CaO+CO2↑
△
Ca+2H2O=Ca(OH)2+H2↑
CaCO3+2HCl=CaCl2+CO2↑+H2O
归纳小结
图1-3钙及化合物转化
CaCO3
Ca
CaCl2
Ca(OH)2
CaO
+2
0
+2
+2
+2
交流与讨论
氧化还原反应
有元素化合价发生变化的反应
Ca+2H2O=Ca(OH)2+H2↑
+2
0
氧化还原反应和其他反应类型关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
归纳小结
+1
0
课时小结
1.领悟4类化合物(氧化物、酸、碱、盐)从不同角度的分类。
2.理解5种物质(单质、氧化物、酸、碱、盐)之间的反应和相互转化反应。
3.领会氧化还原反应与非氧化还原反应
4.领会4种无机反应基本类型及其与氧化还原反应的关系。
当堂巩固
1、下列4组物质均有一种物质的类别与其他3种不同:
(1)以上四组物质中分类与其他物质不同的物质依次是(填化学式):
A________;B________;C________;D________。
D.HCl、H2O、H2SO4、HNO3
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应________氧化还原反应(填“是”或“否”)。
是
CO2
Cu
O2
H2O
当堂巩固
2、下列反应中,不属于四种基本反应类型但属于氧化还原反应的是______;属于四种基本反应类型但不属于氧化还原反应的是______。
D.H2SO4+Ba(OH)2=BaSO4↓+2H2O
A.2KMnO4 =K2MnO4+MnO2+O2↑
△
B.2Na+Cl2 = 2NaCl
点燃
F.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(生产漂白粉)
C.Zn+CuSO4=ZnSO4+Cu
E.3NO2+H2O=2HNO3+NO
D
E、F
组织建设
化学 · 必修1
物质分类与转化
学习目标
初步认识物质的科学分类方法,学会从不同角度对常见物质进行分类。
掌握四种基本反应类型,能根据化合价的变化判断是否属于氧化还原反应。
认识基本反应类型与氧化还原反应之间的关系。
情景设计
你了解这些物质的组成吗?
为何能在书架上快速找到需要的书本?
为何能在货架上快速找到需要的物品?
情景设计
你为何能从网站上快速提取需要的信息?
情景设计
一、物质的分类
交流与讨论
■分类:根据事物的共同特点分别归类
分类没有唯一性,它会根据分类的标准不同而不同.
在我们的日常生活中,常会接触到下列物质:
空气、乙醇、水、硫酸铵、铜、碘酒、碘、氧气、石墨、食盐水。
请将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
归纳小结
1、根据物质的状态进行分类
液体
固体
气体
物质
空气
乙醇
水
硫酸铵
铜
碘酒
氧气
碘
石墨
食盐水
均匀混合物
非均匀混合物
单质
化合物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
氧化物
纯净物
混合物
物质
2、根据物质的组成和性质进行分类
空气
乙醇
水
硫酸铵
铜
碘酒
氧气
碘
石墨
食盐水
归纳小结
实验室中有下列物质,请根据物质的组成对它们进行分类。
钠(Na)、氯气(Cl2)、氯化铁(FeCl3 )溶液、硫酸(H2SO4)、碳酸钙(CaCO3)、氧化钙(CaO)、氢氧化钠(NaOH)、葡萄糖(C6H12O6)。
问题解决
根据物质在组成、性质上的差异,可将氧化物、酸、碱、盐等无机化合物进行更为细致的分类。
氧化物
根据化学性质
根据组成元素
金属氧化物
非金属氧化物
碱性氧化物
酸性氧化物
两性氧化物
不成盐氧化物
Na2O
CO2
Na2O
CO2
Al2O3
CO
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
酸
根据一个酸分子电离的H+个数
根据组成元素是否含氧
无氧酸
含氧酸
一元酸
二元酸
多元酸
HCl
HNO3
根据沸点高低
易挥发性酸
难挥发性酸
根据水溶性
可溶性酸
难溶性酸
HCl
H2SO4
H3PO4
HNO3
HCl
H2SO4
H3PO4
HNO3
H2SO4
H2SiO3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
碱
根据碱在水中最多能电离的OH-数
根据水溶性
可溶性碱
难溶性碱
一元碱
二元碱
多元碱
NaOH
Mg(OH)2
NaOH
Ba(OH)2
Al(OH)3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
盐
根据水溶性
根据酸根
无氧酸盐
含氧酸盐
可溶性盐
微溶性盐
难溶性盐
KCl
KNO3
根据组成盐的阴阳离子
正盐
酸式盐
NaCl
CaSO4
BaSO4
Na2CO3
NaHCO3
碱式盐
Cu2(OH)2CO3
■同一类物质在组成和性能方面往往具有一定的相似性。
归纳小结
2、根据物质的组成和性质进行分类
物质分类的方法:组成、状态、性能……
归纳小结
如对Na2O2的研究,从组成上看,Na2O2应属于金属氧化物中的碱性氧化物,但在实验验证时却发现,它与一般的碱性氧化物(如Na2O)不同,它与水反应时多生成了一种物质——O2,而且向它与水反应后的溶液中滴加酚酞试液,溶液先变红后褪色。因此,应当将其划分为氧化物中的另一类——过氧化物。
4、物质分类的应用
(1)应用物质分类思想研究物质的共性,在研究共性中发现特性。
归纳小结
如用Na、Cl、Mg、O、Cu、S、H、Ca、C九种元素组成尽可能多的物质。如果这几种元素之间漫无规律地组合,可能只能组成我们已知的十几种物质,倘若正确地运用物质分类的思想,一类一类地“对号入座”,将会发现仅这9种元素所能组成的物质,就远远超出我们的想像。
(2)用物质分类思想发现“新物质”。
归纳小结
4、物质分类的应用
某种物质的性质在某一类别中是特性,但在另一类别中,就可能是共性。如根据在水溶液中或熔融状态下是否能导电,可将酸、碱、盐归类为电解质,并由此研究离子反应发生的条件、离子方程式的书写等。
(3)应用不同的分类标准对物质进行分类研究。
归纳小结
4、物质分类的应用
KOH属于碱,CO2和SO2是酸性氧化物。请写出足量KOH溶液分别与CO2、SO2 反应的化学方程式。
问题解决
2KOH+CO2=K2CO3+H2O
2KOH+SO2=K2SO3+H2O
请写出绿色植物光合作用的化学方程式。
6CO2+6H2O C6H12O6+6O2
光照
■物质发生转化往往需要一定的条件。
常见的反应条件有(光照、点燃、加热、高温等)。
二、物质的转化
在初中阶段,我们已经学习了一些物质转化的知识。请举例说明下表中所列物质的转化类型,并将你所知道的其他转化类型补充到列表中。
物质的转化类型 化学方程式
单质→化合物
金属氧化物→氢氧化物
酸→盐
H2+Cl2 2HCl
光照
CaO+H2O=Ca(OH)2
HCl+NaOH=H2O+NaCl
2HCl+Na2CO3=H2O+2NaCl+CO2↑
交流与讨论
图1-3钙及化合物转化
CaCO3
Ca
CaCl2
Ca(OH)2
CaO
交流与讨论
1.表1-2 化学反应几种类型
反应类型 实例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+BC
化合反应
分解反应
置换反应
复分解反应
CaO+H2O=Ca(OH)2
CaCO3 CaO+CO2↑
△
Ca+2H2O=Ca(OH)2+H2↑
CaCO3+2HCl=CaCl2+CO2↑+H2O
归纳小结
图1-3钙及化合物转化
CaCO3
Ca
CaCl2
Ca(OH)2
CaO
+2
0
+2
+2
+2
交流与讨论
氧化还原反应
有元素化合价发生变化的反应
Ca+2H2O=Ca(OH)2+H2↑
+2
0
氧化还原反应和其他反应类型关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
归纳小结
+1
0
课时小结
1.领悟4类化合物(氧化物、酸、碱、盐)从不同角度的分类。
2.理解5种物质(单质、氧化物、酸、碱、盐)之间的反应和相互转化反应。
3.领会氧化还原反应与非氧化还原反应
4.领会4种无机反应基本类型及其与氧化还原反应的关系。
当堂巩固
1、下列4组物质均有一种物质的类别与其他3种不同:
(1)以上四组物质中分类与其他物质不同的物质依次是(填化学式):
A________;B________;C________;D________。
D.HCl、H2O、H2SO4、HNO3
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应________氧化还原反应(填“是”或“否”)。
是
CO2
Cu
O2
H2O
当堂巩固
2、下列反应中,不属于四种基本反应类型但属于氧化还原反应的是______;属于四种基本反应类型但不属于氧化还原反应的是______。
D.H2SO4+Ba(OH)2=BaSO4↓+2H2O
A.2KMnO4 =K2MnO4+MnO2+O2↑
△
B.2Na+Cl2 = 2NaCl
点燃
F.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(生产漂白粉)
C.Zn+CuSO4=ZnSO4+Cu
E.3NO2+H2O=2HNO3+NO
D
E、F
