课课练2.3重要的碱第1课时(知识梳理+夯实基础+真题再现)
文档属性
| 名称 | 课课练2.3重要的碱第1课时(知识梳理+夯实基础+真题再现) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-08-16 14:41:32 | ||
图片预览


文档简介
第3节 重要的碱(第1课时)
1. 氢氧化钠俗称: 、 或 ,白色块状固体,极易溶于水,溶解时 (填“放”或“吸”)热;有强烈的 性,如不慎沾到皮肤上,要用较多水冲洗,再涂上 溶液。
2. 氢氧化钠暴露在空气中易 ,可用作干燥剂(但不能干燥酸性气体),还易与空气中的 反应而变质,化学方程式 。
3. 存放氢氧化钠的试剂瓶不宜用玻璃塞,原因:SiO2+2NaOH===Na2SiO3(粘合剂)+H2O。
4. 氢氧化钙俗称: 、 ,也是石灰浆、石灰乳的主要成分。氢氧化钙是白色粉末,微溶于水,水溶液俗称 。
5. 氢氧化钙可由 与 反应得到,反应时会 (填“放”或“吸”)热,化学方程式 。
1.下列各组物质的名称、俗称、化学式表示同一物质的是( )
A.氢氧化钠,纯碱,NaOH B.氯化钠,食盐,KCl
C.氢氧化钙,消石灰,Ca(OH)2 D.碳酸钙,生石灰,CaCO3
2.一瓶NaOH溶液在空气中完全变质,图中小球分别表示在变质前后溶液中存在的主要离子,其中“●”表示的微粒是()
A.Na+ B.OH- C.CO32- D.H+
3.小金做了一个实验,如图:若关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀打开Ⅱ阀,紫色小花不变红。则甲瓶中所盛的试剂可能是( )
① 浓 ② 浓溶液 ③ 饱和溶液
A.只有① B.只有② C.① ② D.① ② ③
4.下列各组物质在给定的条件下能大量共存的是( )
A.在PH=1的溶液中:NaCl Na2SO4 Na2CO3 B.在PH=2的溶液中:KCl Na2SO4 HNO3
C.在PH=13的溶液中:BaCl2 Na2CO3 NaOH D.在PH=14的溶液中:FeCl3 Ba(NO3)2 CaCl2
5.下列图像能正确反映所对应叙述关系的是
A.①向pH=9的NaOH溶液中不断加水
B.②向CaCl2和HCl混合溶液中加入Na2CO3
C.③分别向等质量的Fe和Zn中加入等浓度的稀硫酸
D.④向盐酸和氯化铜混合溶液中加入氢氧化钠溶液
6.下图是物质间发生化学反应的颜色变化,其中X是( )
A.稀盐酸 B.稀硫酸 C.硫酸钠溶液 D.澄清石灰水
7.在反应A+3B=====2C+3D中,已知A和B 的相对分子质量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则C的质量为( )
A.8.8g B.9.6g C.6.8g D.4.4g
8.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水
C.能与Na2S04溶液反应生成BaS04沉淀 D.能与CO2反应生成水
9.实验室有一包由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中镁离子的质量分数为( )
A.4% B.12% C.20% D.24%
10.在元旦晚会上小明表演了—个魔术:他拿出一把装满“水”的“宝壶”,分别向编号为ABCDEF六只烧杯(装有少量不同试剂)中倒“水”,结果A杯无色透明,B杯看似红墨水,C杯看似蓝墨水,D杯看似牛奶,E杯看似红褐色涂料,F杯看似蓝色果冻。则宝壶中的“水”可能是( )
A、H2O2 溶液 B、HCl溶液 C、AgNO3溶液 D、NaOH溶液
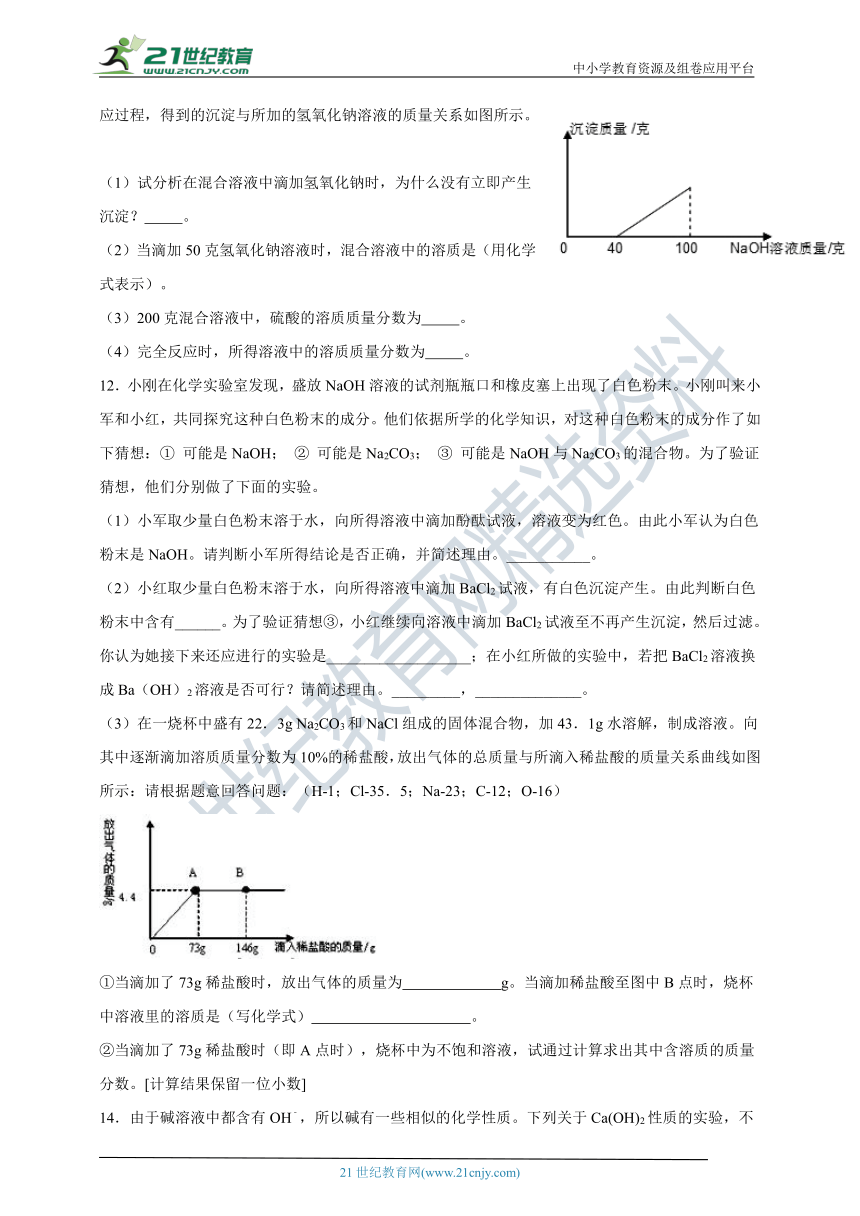
11.在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应。记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。
(1)试分析在混合溶液中滴加氢氧化钠时,为什么没有立即产生沉淀? 。
(2)当滴加50克氢氧化钠溶液时,混合溶液中的溶质是(用化学式表示)。
(3)200克混合溶液中,硫酸的溶质质量分数为 。
(4)完全反应时,所得溶液中的溶质质量分数为 。
12.小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。为了验证猜想,他们分别做了下面的实验。
(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小军所得结论是否正确,并简述理由。___________。
(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有______。为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。你认为她接下来还应进行的实验是___________________;在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由。_________,______________。
(3)在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加43.1g水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题:(H-1;Cl-35.5;Na-23;C-12;O-16)
①当滴加了73g稀盐酸时,放出气体的质量为 g。当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式) 。
②当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数。[计算结果保留一位小数]
14.由于碱溶液中都含有OH﹣,所以碱有一些相似的化学性质。下列关于Ca(OH)2性质的实验,不能体现碱相似的化学性质的是_______
16.氢氧化钠是一种重要的化工原料,俗称______。氢氧化钠易吸收水分可用作某些气体的______剂,向它的水溶液中滴入几滴酚酞试液,振荡,可以看到______;它的溶液也能与气体二氧化碳反应,发生化学反应的方程为______,因此,氢氧化钠应______保存。
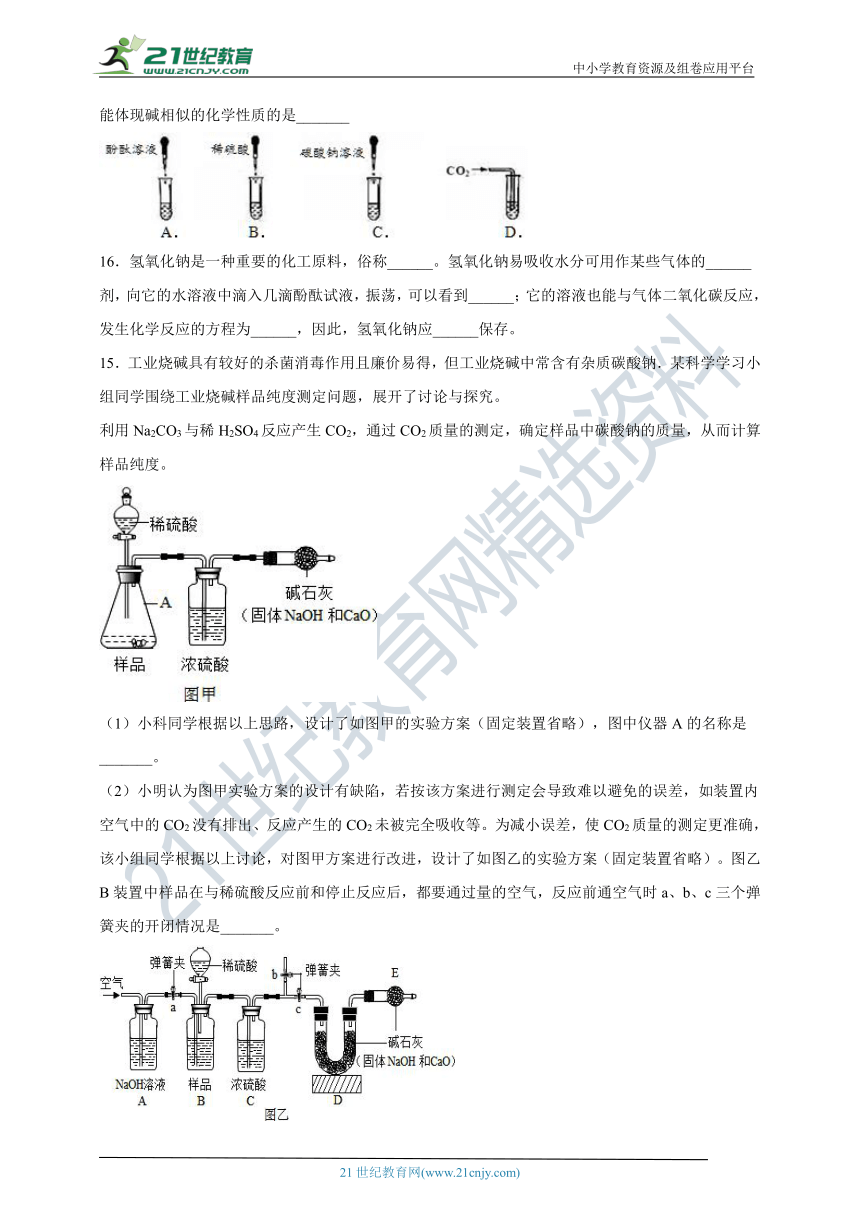
15.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
(1)小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略),图中仪器A的名称是_______。
(2)小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差,如装置内空气中的CO2没有排出、反应产生的CO2未被完全吸收等。为减小误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是_______。
(3)若撤去图乙中的C装置,则测得工业烧碱的纯度将_______(填“偏高”、“偏低”或“无影响”)。
(4)已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成_______。
1、(2019?福建)t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的pH>7.关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2的溶解度随温度升高而减小;②Ca(OH)2与空气中的CO2反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冰水冷却,恢复至t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入Na2CO3溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
2、 (2019?扬州)下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
3、(2019?陕西)向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列有关说法不正确的是( )
A.b点时所加试剂一定是稀盐酸
B.加入试剂总体积为V1时,溶液中不存在NaOH
C.c点时溶液中的溶质都是盐
D.a点时溶液中一定不存在Cu2+
4、(2019?滨州)某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。 (1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成? ; (2)性质②的反应为中和反应,试写出NaOH与盐酸反应的化学方程式
; (3)为了验证性质③,该同学可选择的物质是 (填序号)。 A.Na2CO3????? B.CO2??????? C.FeCl2????? D.Ba(NO3)2
5、(2019?杭州)某兴趣小组做了如下实验: ①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中,充分反应后,试管B留下的溶液也显红色; ②打开止水夹K2,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。 回答: (1)步骤①中,充分反应后,试管B里的CO2最终转化为 (填化学式)和水。 (2)解释步骤②中“风哨振动鸣叫”的原因? 。 (3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:
a% ?b%(选填“>”“=”“<”)
第3节 重要的碱(第1课时)
1. 火碱 烧碱 苛性钠 放 腐蚀 硼酸
2. 潮解 CO2 CO2+2NaOHNa2CO3+H2O
4. 熟石灰 消石灰 石灰水
5. 生石灰 水 放 CaO+H2OCa(OH)2
1.C
2.C
3.C
4.B
5.B
6.B
7.A
8.C
9.A
10.D
11.(1)氢氧化铜与硫酸不能共存;(2)Na2SO4、CuSO4(3)9.8%(4)26.2%
12.(1)不正确;因为Na2CO3的水溶液也显碱性 (2)Na2CO3;取上层清液,向里面滴加无色酚酞溶液,观察现象;不行;因为如换成Ba(OH)2溶液,就鉴别不出是否含有NaOH了 (3)①4.4; NaCl和HCl ②17.5%
13.C
14.烧碱、火碱、苛性钠 干燥 酚酞试液变红 2NaOH+CO2=Na2CO3+H2O 密封
15.锥形瓶 打开弹簧夹a和b,关闭弹簧夹c 偏低 硫酸钠;硫酸钠和硫酸;硫酸钠和碳酸氢钠
C
C
D
4、:(1)红色。(2)NaOH+HCl═NaCl+H2O。(3)C。
5、(1)Na2CO3。(2) B中二氧化碳和氢氧化钠反应而减少,导致气压减小,小于外界大气压,空气进入C中 (3)>
1. 氢氧化钠俗称: 、 或 ,白色块状固体,极易溶于水,溶解时 (填“放”或“吸”)热;有强烈的 性,如不慎沾到皮肤上,要用较多水冲洗,再涂上 溶液。
2. 氢氧化钠暴露在空气中易 ,可用作干燥剂(但不能干燥酸性气体),还易与空气中的 反应而变质,化学方程式 。
3. 存放氢氧化钠的试剂瓶不宜用玻璃塞,原因:SiO2+2NaOH===Na2SiO3(粘合剂)+H2O。
4. 氢氧化钙俗称: 、 ,也是石灰浆、石灰乳的主要成分。氢氧化钙是白色粉末,微溶于水,水溶液俗称 。
5. 氢氧化钙可由 与 反应得到,反应时会 (填“放”或“吸”)热,化学方程式 。
1.下列各组物质的名称、俗称、化学式表示同一物质的是( )
A.氢氧化钠,纯碱,NaOH B.氯化钠,食盐,KCl
C.氢氧化钙,消石灰,Ca(OH)2 D.碳酸钙,生石灰,CaCO3
2.一瓶NaOH溶液在空气中完全变质,图中小球分别表示在变质前后溶液中存在的主要离子,其中“●”表示的微粒是()
A.Na+ B.OH- C.CO32- D.H+
3.小金做了一个实验,如图:若关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀打开Ⅱ阀,紫色小花不变红。则甲瓶中所盛的试剂可能是( )
① 浓 ② 浓溶液 ③ 饱和溶液
A.只有① B.只有② C.① ② D.① ② ③
4.下列各组物质在给定的条件下能大量共存的是( )
A.在PH=1的溶液中:NaCl Na2SO4 Na2CO3 B.在PH=2的溶液中:KCl Na2SO4 HNO3
C.在PH=13的溶液中:BaCl2 Na2CO3 NaOH D.在PH=14的溶液中:FeCl3 Ba(NO3)2 CaCl2
5.下列图像能正确反映所对应叙述关系的是
A.①向pH=9的NaOH溶液中不断加水
B.②向CaCl2和HCl混合溶液中加入Na2CO3
C.③分别向等质量的Fe和Zn中加入等浓度的稀硫酸
D.④向盐酸和氯化铜混合溶液中加入氢氧化钠溶液
6.下图是物质间发生化学反应的颜色变化,其中X是( )
A.稀盐酸 B.稀硫酸 C.硫酸钠溶液 D.澄清石灰水
7.在反应A+3B=====2C+3D中,已知A和B 的相对分子质量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则C的质量为( )
A.8.8g B.9.6g C.6.8g D.4.4g
8.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水
C.能与Na2S04溶液反应生成BaS04沉淀 D.能与CO2反应生成水
9.实验室有一包由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中镁离子的质量分数为( )
A.4% B.12% C.20% D.24%
10.在元旦晚会上小明表演了—个魔术:他拿出一把装满“水”的“宝壶”,分别向编号为ABCDEF六只烧杯(装有少量不同试剂)中倒“水”,结果A杯无色透明,B杯看似红墨水,C杯看似蓝墨水,D杯看似牛奶,E杯看似红褐色涂料,F杯看似蓝色果冻。则宝壶中的“水”可能是( )
A、H2O2 溶液 B、HCl溶液 C、AgNO3溶液 D、NaOH溶液
11.在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应。记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。
(1)试分析在混合溶液中滴加氢氧化钠时,为什么没有立即产生沉淀? 。
(2)当滴加50克氢氧化钠溶液时,混合溶液中的溶质是(用化学式表示)。
(3)200克混合溶液中,硫酸的溶质质量分数为 。
(4)完全反应时,所得溶液中的溶质质量分数为 。
12.小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。为了验证猜想,他们分别做了下面的实验。
(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小军所得结论是否正确,并简述理由。___________。
(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有______。为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。你认为她接下来还应进行的实验是___________________;在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由。_________,______________。
(3)在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加43.1g水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题:(H-1;Cl-35.5;Na-23;C-12;O-16)
①当滴加了73g稀盐酸时,放出气体的质量为 g。当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式) 。
②当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数。[计算结果保留一位小数]
14.由于碱溶液中都含有OH﹣,所以碱有一些相似的化学性质。下列关于Ca(OH)2性质的实验,不能体现碱相似的化学性质的是_______
16.氢氧化钠是一种重要的化工原料,俗称______。氢氧化钠易吸收水分可用作某些气体的______剂,向它的水溶液中滴入几滴酚酞试液,振荡,可以看到______;它的溶液也能与气体二氧化碳反应,发生化学反应的方程为______,因此,氢氧化钠应______保存。
15.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
(1)小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略),图中仪器A的名称是_______。
(2)小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差,如装置内空气中的CO2没有排出、反应产生的CO2未被完全吸收等。为减小误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是_______。
(3)若撤去图乙中的C装置,则测得工业烧碱的纯度将_______(填“偏高”、“偏低”或“无影响”)。
(4)已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成_______。
1、(2019?福建)t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的pH>7.关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2的溶解度随温度升高而减小;②Ca(OH)2与空气中的CO2反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冰水冷却,恢复至t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入Na2CO3溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
2、 (2019?扬州)下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
3、(2019?陕西)向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列有关说法不正确的是( )
A.b点时所加试剂一定是稀盐酸
B.加入试剂总体积为V1时,溶液中不存在NaOH
C.c点时溶液中的溶质都是盐
D.a点时溶液中一定不存在Cu2+
4、(2019?滨州)某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。 (1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成? ; (2)性质②的反应为中和反应,试写出NaOH与盐酸反应的化学方程式
; (3)为了验证性质③,该同学可选择的物质是 (填序号)。 A.Na2CO3????? B.CO2??????? C.FeCl2????? D.Ba(NO3)2
5、(2019?杭州)某兴趣小组做了如下实验: ①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中,充分反应后,试管B留下的溶液也显红色; ②打开止水夹K2,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。 回答: (1)步骤①中,充分反应后,试管B里的CO2最终转化为 (填化学式)和水。 (2)解释步骤②中“风哨振动鸣叫”的原因? 。 (3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:
a% ?b%(选填“>”“=”“<”)
第3节 重要的碱(第1课时)
1. 火碱 烧碱 苛性钠 放 腐蚀 硼酸
2. 潮解 CO2 CO2+2NaOHNa2CO3+H2O
4. 熟石灰 消石灰 石灰水
5. 生石灰 水 放 CaO+H2OCa(OH)2
1.C
2.C
3.C
4.B
5.B
6.B
7.A
8.C
9.A
10.D
11.(1)氢氧化铜与硫酸不能共存;(2)Na2SO4、CuSO4(3)9.8%(4)26.2%
12.(1)不正确;因为Na2CO3的水溶液也显碱性 (2)Na2CO3;取上层清液,向里面滴加无色酚酞溶液,观察现象;不行;因为如换成Ba(OH)2溶液,就鉴别不出是否含有NaOH了 (3)①4.4; NaCl和HCl ②17.5%
13.C
14.烧碱、火碱、苛性钠 干燥 酚酞试液变红 2NaOH+CO2=Na2CO3+H2O 密封
15.锥形瓶 打开弹簧夹a和b,关闭弹簧夹c 偏低 硫酸钠;硫酸钠和硫酸;硫酸钠和碳酸氢钠
C
C
D
4、:(1)红色。(2)NaOH+HCl═NaCl+H2O。(3)C。
5、(1)Na2CO3。(2) B中二氧化碳和氢氧化钠反应而减少,导致气压减小,小于外界大气压,空气进入C中 (3)>
