京改版九年级上册化学 2.3 氧气的性质 课件(18张PPT)
文档属性
| 名称 | 京改版九年级上册化学 2.3 氧气的性质 课件(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 42.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-20 00:00:00 | ||
图片预览






文档简介
课件18张PPT。氧气的性质
①色、味、态:无色无味气体(标准状况)
②密度:略大于空气
③水溶性:
④熔沸点:
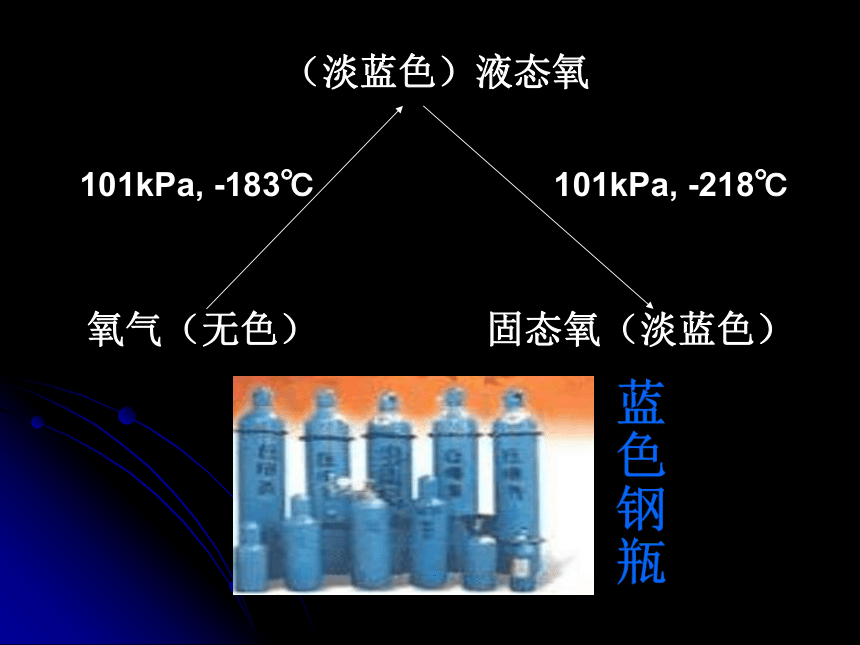
一般指颜色、状态、气味、熔点、沸点、硬度和密度、是否溶于水等。不易溶于水一、物理性质蓝色钢瓶氧气的化学性质实验2-2:带火星的木条伸入集气瓶中,注意观察现象。实验结论:(1)氧气可使带火星的木条复燃。(即氧气能支持燃烧 ) 【说明】 物质在空气中燃烧主要是与空气中的氧气反应,反应的剧烈程度取决于氧气的含量,氧气含量越高,燃烧越剧烈。硫磺淡黄色固体微弱的淡蓝色火焰,放热,生成有刺激性气味的气体剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体。【实验2-3】硫在空气中燃烧,再伸入氧气中硫在空气中燃烧发出淡蓝色的火焰,放出热量,生成一种有刺激性气味的气体。硫在氧气中燃烧发出蓝紫色的火焰,放出热量,生成一种有刺激性气味的气体。硫 + 氧气 → 二氧化硫 点燃 S O2 SO2
木炭 黑色固体燃烧发红,
放出热量,
生成能使
澄清石灰
水变浑浊
的气体剧烈燃烧,
发出白光,
放出热量,
生成能使
澄清石灰
水变浑浊
的气体.
碳跟氧气反应的文字表达式为:碳+氧气 二氧化碳点燃(3)木炭燃烧实验木炭在空气中燃烧与在氧气中燃烧剧烈程度明显不同,原因是什么?问不倒 由于氧气浓度的不同,使得木炭燃烧的剧烈程度不一样,在氧气里燃烧更剧烈,发出白光。铁丝燃烧步骤:
1.把铁丝绕城螺旋状(目的:充分预热,增大与氧气的接触面积。
2.用砂纸擦掉铁丝表面的铁锈和油漆。
3.瓶中加入少量的水或铺一层沙(目的:防止生成物融化溅落下来,炸裂瓶底)铁丝银白色
固体无剧烈燃烧,
火星四射,
放出大量
的热,生成黑色固体若本实验失败请分析原因1.氧气不纯
2.温度达不到
3.表面有铁锈
4.火柴刚点燃就伸进集气瓶【思考】上述几个变化中,有什么共同的特征? 红磷、
氧气硫、
氧气铁、
氧气五氧化二磷二氧化硫四氧化三铁3. 化合反应与氧化反应(1)化合反应:由两种或两种以上的物质生成一种物质的反应。A+B=AB铝+氧气 点燃 氧化铝
Al O2 Al2O3(2)氧化反应:物质跟氧发生的反应。
氧化反应的生成物即氧化物。(3)缓慢氧化:进行得很慢,不容易被察觉的氧化叫缓慢氧化。氧化物的特征:含有氧元素
只有两种元素
是化合物小结:
氧气的化学性质比较活泼,许多物质能够在氧气中燃烧放出热量,它能支持燃烧,具有助燃性,此外,它具有氧化性,属于氧化剂.教学反思:
首先我把这节课的整体思路作一简要说明:
1、 氧气,学生熟而能详,但对它了解得并不深入。因此我就在教学中用设问、实验或影像资料引入课题,造成悬念,激发学生的求知欲望,帮助学生认识氧气的性质和用途。
2、 由于学生缺乏感性认识,学习氧气的物理性质就显得较为抽象,因此我在使用教学方法和手段时注意了直观性。讲氧气的三态,让学生观看有关液态氧、固态氧的影像资料。
3、 学习氧气的化学性质时,结合生动的演示实验。演示物质在氧气中的燃烧实验,要把学生注意力放在引导学生观察、比较几种可燃物在空气、氧气中的燃烧现象,从中归纳出氧气的化学性质。
4、 学习氧气的用途时,让学生体会到物质的性质决定它的用途。
考虑了以上几点,我在课前做了充分的备课。我的脑海中始终贯穿一个思想,那就是学生是课堂的主人。所以只要学生知道的知识就让他们说。如:你知道氧气有哪些性质吗?举例说明。什么事实能证明自然界的水中有氧气?学生积极发言,我不断鼓励,使他们觉得自己很了不起,从而增强了自信心。学生喜欢化学的一个重要的原因是可以做实验,因此我就想借此再次增加学生的学习兴趣,尽量让学生动手实验,以满足他们的好奇心。以前,木炭、铁丝、蜡烛在氧气中燃烧的实验都是教师演示,而我把这几个都安排了学生实验。对此,我也很担心学生能否成功,心里没底,但没想到他们做的非常好,学生高兴,我也高兴。这也使我感到今后要充分的相信学生,不要再束缚他们的手脚,他们其实很了不起。
一节课总是会有一些遗憾,如:学生探究问题时的时间没有合理安排好,什么时候探究,什么时候讨论,讨论到什么程度,还需仔细考虑。再有,当学生提出问题时,点拨的不够深入,对此我的想法就是要不断学习,提高自己。
①色、味、态:无色无味气体(标准状况)
②密度:略大于空气
③水溶性:
④熔沸点:
一般指颜色、状态、气味、熔点、沸点、硬度和密度、是否溶于水等。不易溶于水一、物理性质蓝色钢瓶氧气的化学性质实验2-2:带火星的木条伸入集气瓶中,注意观察现象。实验结论:(1)氧气可使带火星的木条复燃。(即氧气能支持燃烧 ) 【说明】 物质在空气中燃烧主要是与空气中的氧气反应,反应的剧烈程度取决于氧气的含量,氧气含量越高,燃烧越剧烈。硫磺淡黄色固体微弱的淡蓝色火焰,放热,生成有刺激性气味的气体剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体。【实验2-3】硫在空气中燃烧,再伸入氧气中硫在空气中燃烧发出淡蓝色的火焰,放出热量,生成一种有刺激性气味的气体。硫在氧气中燃烧发出蓝紫色的火焰,放出热量,生成一种有刺激性气味的气体。硫 + 氧气 → 二氧化硫 点燃 S O2 SO2
木炭 黑色固体燃烧发红,
放出热量,
生成能使
澄清石灰
水变浑浊
的气体剧烈燃烧,
发出白光,
放出热量,
生成能使
澄清石灰
水变浑浊
的气体.
碳跟氧气反应的文字表达式为:碳+氧气 二氧化碳点燃(3)木炭燃烧实验木炭在空气中燃烧与在氧气中燃烧剧烈程度明显不同,原因是什么?问不倒 由于氧气浓度的不同,使得木炭燃烧的剧烈程度不一样,在氧气里燃烧更剧烈,发出白光。铁丝燃烧步骤:
1.把铁丝绕城螺旋状(目的:充分预热,增大与氧气的接触面积。
2.用砂纸擦掉铁丝表面的铁锈和油漆。
3.瓶中加入少量的水或铺一层沙(目的:防止生成物融化溅落下来,炸裂瓶底)铁丝银白色
固体无剧烈燃烧,
火星四射,
放出大量
的热,生成黑色固体若本实验失败请分析原因1.氧气不纯
2.温度达不到
3.表面有铁锈
4.火柴刚点燃就伸进集气瓶【思考】上述几个变化中,有什么共同的特征? 红磷、
氧气硫、
氧气铁、
氧气五氧化二磷二氧化硫四氧化三铁3. 化合反应与氧化反应(1)化合反应:由两种或两种以上的物质生成一种物质的反应。A+B=AB铝+氧气 点燃 氧化铝
Al O2 Al2O3(2)氧化反应:物质跟氧发生的反应。
氧化反应的生成物即氧化物。(3)缓慢氧化:进行得很慢,不容易被察觉的氧化叫缓慢氧化。氧化物的特征:含有氧元素
只有两种元素
是化合物小结:
氧气的化学性质比较活泼,许多物质能够在氧气中燃烧放出热量,它能支持燃烧,具有助燃性,此外,它具有氧化性,属于氧化剂.教学反思:
首先我把这节课的整体思路作一简要说明:
1、 氧气,学生熟而能详,但对它了解得并不深入。因此我就在教学中用设问、实验或影像资料引入课题,造成悬念,激发学生的求知欲望,帮助学生认识氧气的性质和用途。
2、 由于学生缺乏感性认识,学习氧气的物理性质就显得较为抽象,因此我在使用教学方法和手段时注意了直观性。讲氧气的三态,让学生观看有关液态氧、固态氧的影像资料。
3、 学习氧气的化学性质时,结合生动的演示实验。演示物质在氧气中的燃烧实验,要把学生注意力放在引导学生观察、比较几种可燃物在空气、氧气中的燃烧现象,从中归纳出氧气的化学性质。
4、 学习氧气的用途时,让学生体会到物质的性质决定它的用途。
考虑了以上几点,我在课前做了充分的备课。我的脑海中始终贯穿一个思想,那就是学生是课堂的主人。所以只要学生知道的知识就让他们说。如:你知道氧气有哪些性质吗?举例说明。什么事实能证明自然界的水中有氧气?学生积极发言,我不断鼓励,使他们觉得自己很了不起,从而增强了自信心。学生喜欢化学的一个重要的原因是可以做实验,因此我就想借此再次增加学生的学习兴趣,尽量让学生动手实验,以满足他们的好奇心。以前,木炭、铁丝、蜡烛在氧气中燃烧的实验都是教师演示,而我把这几个都安排了学生实验。对此,我也很担心学生能否成功,心里没底,但没想到他们做的非常好,学生高兴,我也高兴。这也使我感到今后要充分的相信学生,不要再束缚他们的手脚,他们其实很了不起。
一节课总是会有一些遗憾,如:学生探究问题时的时间没有合理安排好,什么时候探究,什么时候讨论,讨论到什么程度,还需仔细考虑。再有,当学生提出问题时,点拨的不够深入,对此我的想法就是要不断学习,提高自己。
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
