苏教版高中化学必修1同步教学课件:专题2 从海水中获得的化学物质 专题优化总结
文档属性
| 名称 | 苏教版高中化学必修1同步教学课件:专题2 从海水中获得的化学物质 专题优化总结 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-21 10:31:54 | ||
图片预览







文档简介
课件22张PPT。专题2 从海水中获得的化学物质溴、碘的提取与性质
溴、碘性质的考查①卤素间置换反应,②卤素离子(Cl-、Br-、I-)还原性强弱比较,③卤素离子检验,④碘的存在及检验方法,⑤如何提取溴、碘等,特别是与之有关的实验题,更是各类考试的热点。 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________________________________。
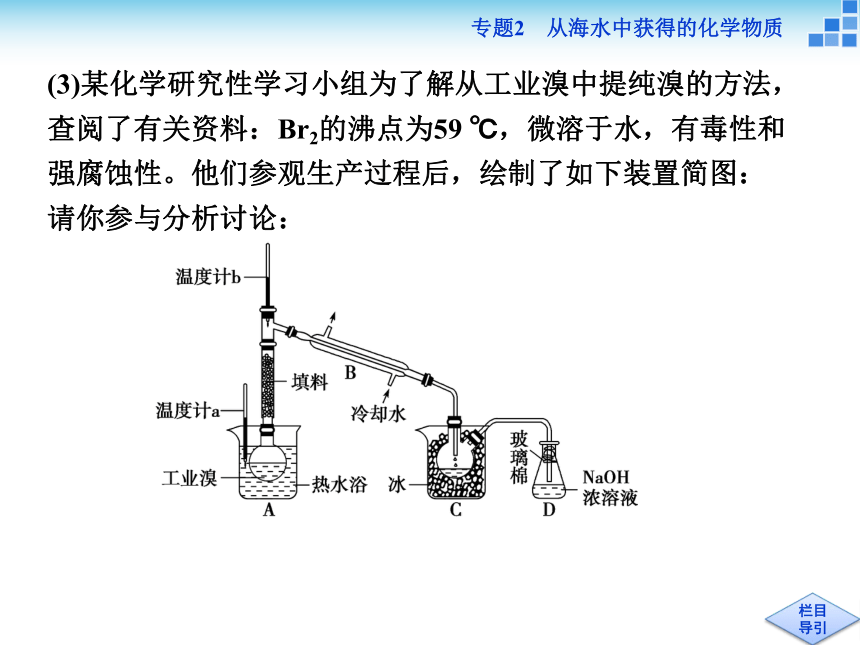
Cl2NaOHNaClO富集溴元素(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:__________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_________。冷凝管Br2腐蚀橡胶控制温度计b的温度,并收集59 ℃时的馏分深红棕色分液[解析] (1)电解NaCl溶液的产物有H2、Cl2、NaOH,若发生反应Cl2+2NaOH===NaCl+NaClO+H2O,则产物为H2和NaClO。(3)提纯溴的实验中,要注意Br2的沸点高低,溴的沸点低于100 ℃,应采用水浴加热,并通过温度计控制温度。除去Br2(液)中少量Cl2,加NaBr溶液后,Br2在水中溶解度不大,出现分层现象,可分液得到纯溴,亦可采用再次蒸馏的方法。
氯、溴、碘及其化合物钠及其化合物镁及其化合物氧化还原反应离子反应2.(2011·高考天津卷)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
3.(2011·高考上海卷)120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
解析:若碳酸钠与盐酸恰好完全反应生成碳酸氢钠,则盐酸浓度为1 mol·L-1;若碳酸钠和盐酸恰好生成二氧化碳,则盐酸浓度为2 mol·L-1,由于最终产生气体体积不同,所以盐酸浓度在1~2 mol·L-1之间。B4.(2012·高考上海卷改编题)钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠?钾合金可在核反应堆中用作热交换液。5.05 g钠?钾合金溶于200 mL水生成0.075 mol氢气。
①溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)为________________________;
②经计算知该钠?钾合金的化学式为__________________。780.75 mol·L-1NaK2(3)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,得出的结论为_____________________________________________________
__________________________________________________。实验①所取氢氧化钠样品是NaOH;实验②和实验③所取氢氧化钠样品是NaOH·H2O本部分内容讲解结束按ESC键退出全屏播放
溴、碘性质的考查①卤素间置换反应,②卤素离子(Cl-、Br-、I-)还原性强弱比较,③卤素离子检验,④碘的存在及检验方法,⑤如何提取溴、碘等,特别是与之有关的实验题,更是各类考试的热点。 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________________________________。
Cl2NaOHNaClO富集溴元素(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:__________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_________。冷凝管Br2腐蚀橡胶控制温度计b的温度,并收集59 ℃时的馏分深红棕色分液[解析] (1)电解NaCl溶液的产物有H2、Cl2、NaOH,若发生反应Cl2+2NaOH===NaCl+NaClO+H2O,则产物为H2和NaClO。(3)提纯溴的实验中,要注意Br2的沸点高低,溴的沸点低于100 ℃,应采用水浴加热,并通过温度计控制温度。除去Br2(液)中少量Cl2,加NaBr溶液后,Br2在水中溶解度不大,出现分层现象,可分液得到纯溴,亦可采用再次蒸馏的方法。
氯、溴、碘及其化合物钠及其化合物镁及其化合物氧化还原反应离子反应2.(2011·高考天津卷)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
3.(2011·高考上海卷)120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
解析:若碳酸钠与盐酸恰好完全反应生成碳酸氢钠,则盐酸浓度为1 mol·L-1;若碳酸钠和盐酸恰好生成二氧化碳,则盐酸浓度为2 mol·L-1,由于最终产生气体体积不同,所以盐酸浓度在1~2 mol·L-1之间。B4.(2012·高考上海卷改编题)钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠?钾合金可在核反应堆中用作热交换液。5.05 g钠?钾合金溶于200 mL水生成0.075 mol氢气。
①溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)为________________________;
②经计算知该钠?钾合金的化学式为__________________。780.75 mol·L-1NaK2(3)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,得出的结论为_____________________________________________________
__________________________________________________。实验①所取氢氧化钠样品是NaOH;实验②和实验③所取氢氧化钠样品是NaOH·H2O本部分内容讲解结束按ESC键退出全屏播放
