京改版九年级上册化学 7.3 依据化学方程式的简单计算 课件(34张PPT)
文档属性
| 名称 | 京改版九年级上册化学 7.3 依据化学方程式的简单计算 课件(34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 99.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-23 00:00:00 | ||
图片预览










文档简介
课件34张PPT。课题3 根据化学方程式的简单计算学习目标1、在理解化学方程式涵义的基础上,掌握有关反应物、生成物质量的计算。
2、通过有关化学方程式计算,掌握化学方程式计算的书写格式,同时培养、提高思维能力和解题能力。学习重点1、掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
2、根据化学方程式计算的书写格式规范化。复习提问
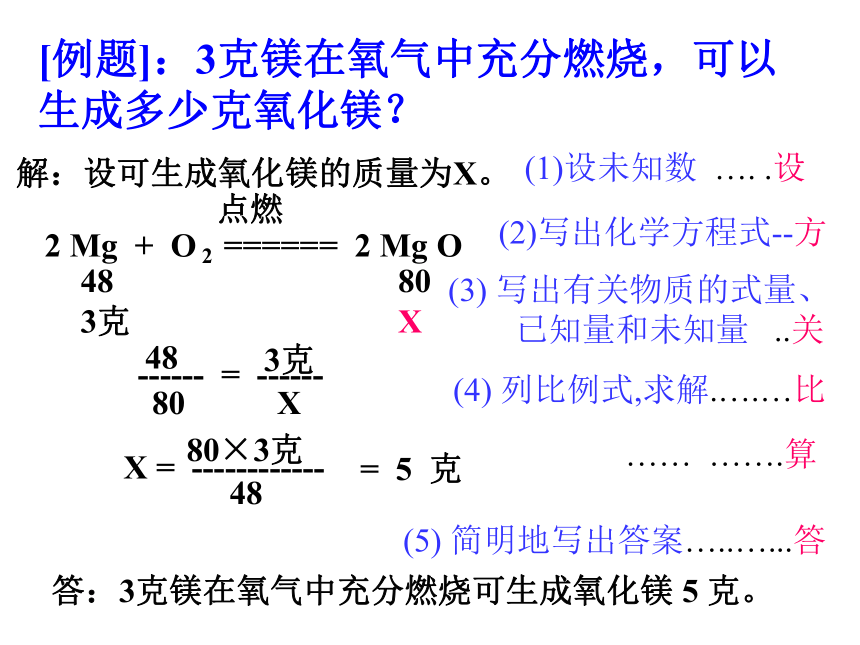
以镁在空气中燃烧为例说明化学方程式的涵义。镁在空气中燃烧反应中反应物与生成物之间的质量比可表示为:2Mg + O2 ====== 2 Mg O 2×24 :16×2 : (24+16)×2 48 : 32 : 80若: 48克 : ( )克 : ( ) 克点燃若:( )克 : ( )克 : 4 0 克32802416说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应(或生成物)的质量,可求生成物(反应物)。[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?解:设可生成氧化镁的质量为X。(1)设未知数 …. .设2 Mg + O 2 ====== 2 Mg O点燃48 80
3克 X (2)写出化学方程式--方 (3) 写出有关物质的式量、
已知量和未知量 ..关48
------ = ------803克X(4) 列比例式,求解.….…比X = ------------ 80×3克48= 5 克答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。…… …….算 (5) 简明地写出答案…..…...答根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
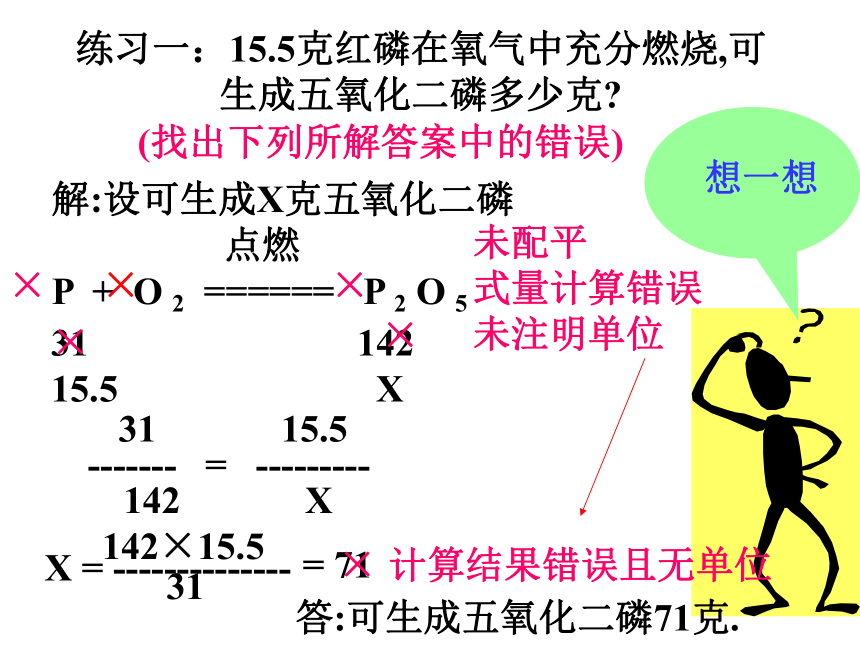
(3)注意单位的书写要求。练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5------- = ---------142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.想一想××××未配平
式量计算错误
未注明单位计算结果错误且无单位××[练习二]:加热分解12.25克氯酸钾,可得到多少
克的氧气?同时生成氯化钾多少克?解:设:可得到氧气的质量为X,===2459612.25克X245-------96=12.25克-------XX =96×5.8克--------------245= 2.3 克答:5.8克氯酸钾可得到氧气 2.3克.149
Y245 12.25克------- = ----------149 YY = ------------
245149×12.25克= 7.45克 可生成氯化钾7.45克.氯化钾的质量为Y。 解:设:需要氯酸钾的质量为X。MnO224596△4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克.讨论制取4.8克氧气,需要氯酸钾多少克?课堂小节:
根据化学方程式进行计算的步骤(1)设未知数 ……………....…设 (2)写出化学方程式 …...….方 (3) 写出有关物质的式量、
已知量和未知量 .....…...关(4) 列比例式,求解 …...….…..比(5) 简明地写出答案 ….…...答………………….….算根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
(3)注意单位的书写要求。A:代入化学方程式计算的量必须是纯净物的质量,若是不纯物,则需转换.
纯净物的质量=不纯物质质量×纯度 =不纯物质质量×(1-杂质的质量分数).
纯度:为该物质在混合物中的质量分数.
B:如果为气体体积,则按下式将其换算成气体质量.
气体质量(克)=气体体积(升)×密度(克/升)
同理: 液体质量(克)=液体体积(毫升)×密度(克/毫升) 例1、足量的镁与质量分数为20%的稀硫酸100克完全反应,制得氢气多少克?
例2、看书本39页例3有关不纯反应物或生成物的计算例3:含杂质质量分数为5%的锌粒6.84克,
与足量稀硫酸充分反应,可生成氢气
多少克?(杂质不跟稀硫酸反应)解:设可生成氢气质量为x。6.84克×(1—5%)=6.5克Zn + H2SO4 = Zn + H2 X = 0.2(克)答:可产生0.2克H2。 2
6.5 x1、用氢气还原铁矿石中的氧化铁,生产含杂质为4%的生铁5.6吨,需含氧化铁80%的铁矿石多少吨?练习2、表面部分被氧化了的镁条5.60克,与足量的稀硫酸完全作用,产生0.4克氢气,则该镁条中单质镁的质量分数为( )
A.88% B.90%
C.94% D.85.7% D3.25克铁跟足量的稀硫酸反应,生成氢气的体积(氢气密度取0.09克/升)约是( )
A. 0.045升 B. 1.29升
C. 0.56升 D. 2.24升
( Fe-56, H-1 )
B根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
(3)注意单位的书写要求,在同一计算中注意单位的统一。
(4)代入化学方程式计算的量必须是纯净物的质量,若是不纯物,则需转换.如果为气体体积,则将其换算成气体质量.例1、足量锌与49克10%的稀硫酸充分反应,制得氢气可还原氧化铜多少克?
Zn-65, H-1, Cu-64, O-16分步计算19.5克金属锌与足量的盐酸反应生成的氢气,全部用来与三氧化钨(WO3)反应.理论上可还原多少克钨?
W-184, Zn-65, H-1, O-16练习
铁可在纯氧中燃烧生成四氧化三铁.氧气由高锰酸钾受热分解获得.现要制取2.32克四氧化三铁,则需要多少克高锰酸钾?
Fe-56,O-16,Mn-55,K-39练习
13克锌与足量的盐酸反应生成的氢气,能与多少克氧气恰好完全反应生成水?如果这些氧气用加热分解高锰酸钾的方法制取,需要多少高锰酸钾?
Zn-65,O-16,Mn-55,K-39, H-1练习根据质量守恒定律宏观表现计算
例1:有氯酸钾和二氧化锰混合物15克,加热使它完全反应,结果发现试管内固体物质为10.2克,试回答: (1)生成多少克氧气? (2)充分反应后,试管内含有那些固体物质?其质量分别为少克?
例:把干燥纯净的氯酸钾和二氧化锰混合物
19.6克放入大试管,给试管加热来制取氧气,在反应不再发生后,等试管冷却称量,得14.8克固体物质,问:
(1) 制得氧气多少克?
(2) 14.8克固体物质里含有哪些物质?
各为多少克?(1) 4.8克
(2) 氯化钾7.45克,二氧化锰7.35克练习:实验室利用加热氯酸钾和二氧化锰的混合物来制氧气,反应前二氧化锰占混合物的质量分数为25%,当加热反应到二氧化锰在混合物中的质量分数为30%时,已分解的氯酸钾占总的氯酸钾的质量分数是多少?
K-39, Cl-35.5, O-16(根据质量守恒定律微观表现计算)
某化学反应可表示为2A+2B=3C,若8克A与4克B恰好完全反应,生成C的质量为多少?若要生成5克C,需要A、B各多少克?
在化学反应A2+2AB2=4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的式量之比为 [ ]
A.3:4 B.4:3
C.1:2 D.2:1 C1、氢气和氧气的混合物10克,点燃后生成水
,并剩余1克氢气,则原混合物气体中,
氢气和氧气的质量分别为( )
A 2克氢气和8克氧气 B 1克氢气和9克氧气
C 5克氢气和5克氧气 D 4克氢气和6克氧气A1克兴趣练习3、13克锌与足量的盐酸反应生成的氢气,能
与多少克氧气恰好完全反应生成水?3.2克4、某二价金属3克恰好和2克氧气完全反应,
则所生成氧化物的相对分子质量是_____。5、下列金属各m克,分别与足量的稀盐酸反应
,放出氢气最多的是( )
A Fe B Mg C Ca D Zn40BAl>Mg>Ca>Na>Fe>Zn18B1.实验室用7.9克高锰酸钾放在试管中加热,反应后称得剩余物质的质量为7.1克,那么剩余物质是( )
A.MnO2和K2MnO4
B.K2MnO4
C.KMnO4和K2MnO4
D.MnO2,KMnO4 兴趣练习2.还原某金属M的氧化物重41.6克,可得金属M36.8克.若M的原子量为184,则此氧化物的化学式为( )
A. MO3 B. MO2
C. M2O3 D. MO
3.质量为2.4克含一种杂质的镁条,与足量的盐酸完全反应后,得到氢气0.21克,则镁条中可能含有下列金属中的(提示:Cu不与盐酸反应)( )
A.Cu B.Zn C.Fe D.Al
4.在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡.分别向两边烧杯中各加入5克镁和5锌,镁和锌全部反应而消失后,天平的指针( )
A.偏向加锌的一边.
B.偏向加镁的一边.
C.仍停留在原来位置.
D.左右摆动,不能停止.
2、通过有关化学方程式计算,掌握化学方程式计算的书写格式,同时培养、提高思维能力和解题能力。学习重点1、掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
2、根据化学方程式计算的书写格式规范化。复习提问
以镁在空气中燃烧为例说明化学方程式的涵义。镁在空气中燃烧反应中反应物与生成物之间的质量比可表示为:2Mg + O2 ====== 2 Mg O 2×24 :16×2 : (24+16)×2 48 : 32 : 80若: 48克 : ( )克 : ( ) 克点燃若:( )克 : ( )克 : 4 0 克32802416说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应(或生成物)的质量,可求生成物(反应物)。[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?解:设可生成氧化镁的质量为X。(1)设未知数 …. .设2 Mg + O 2 ====== 2 Mg O点燃48 80
3克 X (2)写出化学方程式--方 (3) 写出有关物质的式量、
已知量和未知量 ..关48
------ = ------803克X(4) 列比例式,求解.….…比X = ------------ 80×3克48= 5 克答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。…… …….算 (5) 简明地写出答案…..…...答根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
(3)注意单位的书写要求。练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5------- = ---------142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.想一想××××未配平
式量计算错误
未注明单位计算结果错误且无单位××[练习二]:加热分解12.25克氯酸钾,可得到多少
克的氧气?同时生成氯化钾多少克?解:设:可得到氧气的质量为X,===2459612.25克X245-------96=12.25克-------XX =96×5.8克--------------245= 2.3 克答:5.8克氯酸钾可得到氧气 2.3克.149
Y245 12.25克------- = ----------149 YY = ------------
245149×12.25克= 7.45克 可生成氯化钾7.45克.氯化钾的质量为Y。 解:设:需要氯酸钾的质量为X。MnO224596△4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克.讨论制取4.8克氧气,需要氯酸钾多少克?课堂小节:
根据化学方程式进行计算的步骤(1)设未知数 ……………....…设 (2)写出化学方程式 …...….方 (3) 写出有关物质的式量、
已知量和未知量 .....…...关(4) 列比例式,求解 …...….…..比(5) 简明地写出答案 ….…...答………………….….算根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
(3)注意单位的书写要求。A:代入化学方程式计算的量必须是纯净物的质量,若是不纯物,则需转换.
纯净物的质量=不纯物质质量×纯度 =不纯物质质量×(1-杂质的质量分数).
纯度:为该物质在混合物中的质量分数.
B:如果为气体体积,则按下式将其换算成气体质量.
气体质量(克)=气体体积(升)×密度(克/升)
同理: 液体质量(克)=液体体积(毫升)×密度(克/毫升) 例1、足量的镁与质量分数为20%的稀硫酸100克完全反应,制得氢气多少克?
例2、看书本39页例3有关不纯反应物或生成物的计算例3:含杂质质量分数为5%的锌粒6.84克,
与足量稀硫酸充分反应,可生成氢气
多少克?(杂质不跟稀硫酸反应)解:设可生成氢气质量为x。6.84克×(1—5%)=6.5克Zn + H2SO4 = Zn + H2 X = 0.2(克)答:可产生0.2克H2。 2
6.5 x1、用氢气还原铁矿石中的氧化铁,生产含杂质为4%的生铁5.6吨,需含氧化铁80%的铁矿石多少吨?练习2、表面部分被氧化了的镁条5.60克,与足量的稀硫酸完全作用,产生0.4克氢气,则该镁条中单质镁的质量分数为( )
A.88% B.90%
C.94% D.85.7% D3.25克铁跟足量的稀硫酸反应,生成氢气的体积(氢气密度取0.09克/升)约是( )
A. 0.045升 B. 1.29升
C. 0.56升 D. 2.24升
( Fe-56, H-1 )
B根据化学方程式计算的注意事项:
(1)根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2) 解题格式的书写要规范化。
(3)注意单位的书写要求,在同一计算中注意单位的统一。
(4)代入化学方程式计算的量必须是纯净物的质量,若是不纯物,则需转换.如果为气体体积,则将其换算成气体质量.例1、足量锌与49克10%的稀硫酸充分反应,制得氢气可还原氧化铜多少克?
Zn-65, H-1, Cu-64, O-16分步计算19.5克金属锌与足量的盐酸反应生成的氢气,全部用来与三氧化钨(WO3)反应.理论上可还原多少克钨?
W-184, Zn-65, H-1, O-16练习
铁可在纯氧中燃烧生成四氧化三铁.氧气由高锰酸钾受热分解获得.现要制取2.32克四氧化三铁,则需要多少克高锰酸钾?
Fe-56,O-16,Mn-55,K-39练习
13克锌与足量的盐酸反应生成的氢气,能与多少克氧气恰好完全反应生成水?如果这些氧气用加热分解高锰酸钾的方法制取,需要多少高锰酸钾?
Zn-65,O-16,Mn-55,K-39, H-1练习根据质量守恒定律宏观表现计算
例1:有氯酸钾和二氧化锰混合物15克,加热使它完全反应,结果发现试管内固体物质为10.2克,试回答: (1)生成多少克氧气? (2)充分反应后,试管内含有那些固体物质?其质量分别为少克?
例:把干燥纯净的氯酸钾和二氧化锰混合物
19.6克放入大试管,给试管加热来制取氧气,在反应不再发生后,等试管冷却称量,得14.8克固体物质,问:
(1) 制得氧气多少克?
(2) 14.8克固体物质里含有哪些物质?
各为多少克?(1) 4.8克
(2) 氯化钾7.45克,二氧化锰7.35克练习:实验室利用加热氯酸钾和二氧化锰的混合物来制氧气,反应前二氧化锰占混合物的质量分数为25%,当加热反应到二氧化锰在混合物中的质量分数为30%时,已分解的氯酸钾占总的氯酸钾的质量分数是多少?
K-39, Cl-35.5, O-16(根据质量守恒定律微观表现计算)
某化学反应可表示为2A+2B=3C,若8克A与4克B恰好完全反应,生成C的质量为多少?若要生成5克C,需要A、B各多少克?
在化学反应A2+2AB2=4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的式量之比为 [ ]
A.3:4 B.4:3
C.1:2 D.2:1 C1、氢气和氧气的混合物10克,点燃后生成水
,并剩余1克氢气,则原混合物气体中,
氢气和氧气的质量分别为( )
A 2克氢气和8克氧气 B 1克氢气和9克氧气
C 5克氢气和5克氧气 D 4克氢气和6克氧气A1克兴趣练习3、13克锌与足量的盐酸反应生成的氢气,能
与多少克氧气恰好完全反应生成水?3.2克4、某二价金属3克恰好和2克氧气完全反应,
则所生成氧化物的相对分子质量是_____。5、下列金属各m克,分别与足量的稀盐酸反应
,放出氢气最多的是( )
A Fe B Mg C Ca D Zn40BAl>Mg>Ca>Na>Fe>Zn18B1.实验室用7.9克高锰酸钾放在试管中加热,反应后称得剩余物质的质量为7.1克,那么剩余物质是( )
A.MnO2和K2MnO4
B.K2MnO4
C.KMnO4和K2MnO4
D.MnO2,KMnO4 兴趣练习2.还原某金属M的氧化物重41.6克,可得金属M36.8克.若M的原子量为184,则此氧化物的化学式为( )
A. MO3 B. MO2
C. M2O3 D. MO
3.质量为2.4克含一种杂质的镁条,与足量的盐酸完全反应后,得到氢气0.21克,则镁条中可能含有下列金属中的(提示:Cu不与盐酸反应)( )
A.Cu B.Zn C.Fe D.Al
4.在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡.分别向两边烧杯中各加入5克镁和5锌,镁和锌全部反应而消失后,天平的指针( )
A.偏向加锌的一边.
B.偏向加镁的一边.
C.仍停留在原来位置.
D.左右摆动,不能停止.
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
