粤教版九上化学 4.3 质量守恒定律 课件 (36张PPT)
文档属性
| 名称 | 粤教版九上化学 4.3 质量守恒定律 课件 (36张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-23 17:53:10 | ||
图片预览











文档简介
(共36张PPT)
广告:水变成汽
油、柴油,经济
收入惊人,技术
转让,欢迎有识
之士加盟。
4.3 质量守恒定律
1﹑水通电分解的文字表达式?
2﹑分子与原子的主要区别?化学反应的实质?
在化学变化中,分子可以再分,而原子不能再分; 实质是分子分成原子,原子重新组合成新的分子.
水 氧气+氢气
通电
学习目标
1、通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系;
2、能够从宏观和微观的角度理解质量守恒定律;
3、能够运用质量守恒定律解释一些实验现象。
当物质发生化学变化并生成新物质时,反应物的质量总和跟生成物的质量总和相比较,存在什么关系呢
思考
硫酸铜+氢氧化钠 氢氧化铜+硫酸钠
CuSO4
NaOH
Cu(OH)2
Na2SO4
铁 + 硫酸铜 硫酸亚铁 + 铜
Fe
FeSO4
Cu
CuSO4
方案一
探究活动:
方案二
称量硫酸铜溶液和氢氧化钠溶液反应前后的质量是否相等
称量铁钉和硫酸铜溶液反应前后的质量是否相等
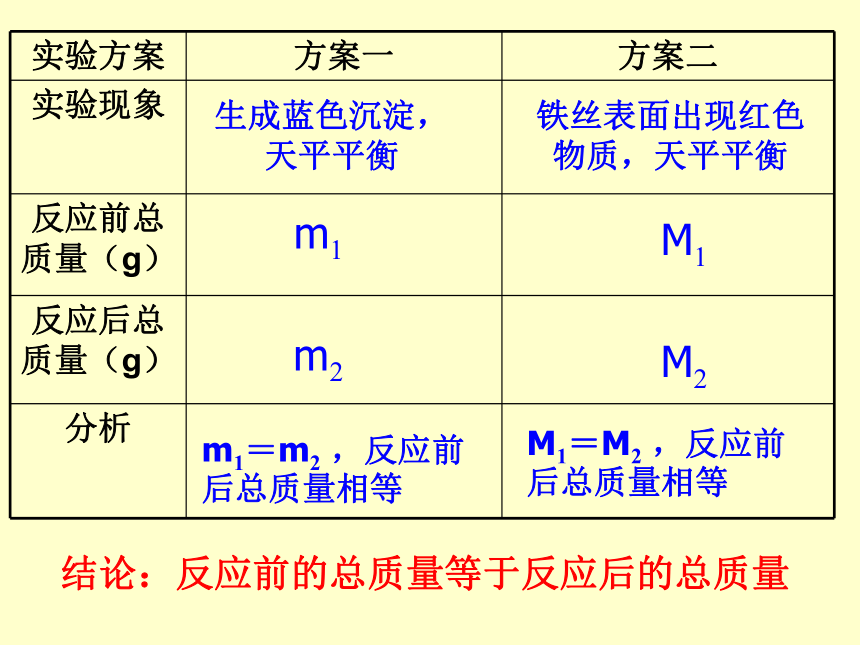
实验方案 方案一 方案二
实验现象
反应前总质量(g)
反应后总质量(g)
分析
m1
铁丝表面出现红色
物质,天平平衡
m2
M1
M2
m1=m2 ,反应前后总质量相等
M1=M2 ,反应前后总质量相等
生成蓝色沉淀,
天平平衡
结论:反应前的总质量等于反应后的总质量
质量守恒定律
参加反应的
各物质的质
量总和
生成的各物质的质量
总和
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
1756年俄国化学家罗蒙诺索夫把锡放在密闭的容器里煅烧后生成氧化锡,在煅烧前后容器内总质量并没有发生变化。经过反复的实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。但这一发现当时没有引起科学家的注意,直到1777年法国的拉瓦锡做了同样的实验,也得到同样的结论,这一定律才获得公认。1908年德国化学家朗道耳特及1912年英国化学家曼莱做了精确度极高的实验,反应前后质量的变化小于一千万分之一。这个差别在实验误差范围之内,因此科学家一致承认了这一定律。
1.有下列事实:
①蜡烛燃烧后其质量减小了。
②铁制品生锈后质量增加了。
③湿衣服晾干后,其质量比湿的时候减少。
④石灰水放在敞口的容器中,其质量增加。
遵守质量守恒定律的是 。
①②④
2.对质量守恒定律的理解,最确切的是( ) A.10 g冰受热融化成10 g水 B.参加反应的氢气和氧气的体积,
一定等于生成水的体积 C.反应物的质量等于生成物的质量 D.参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
D
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
适用范围:化学变化。
为什么反应前后质量不变呢?
以水通电分解为例:水 氢气+氧气
通电
分子 分化 原子 重新组合 新分子 聚集 新物质
符号表达式: H20 H2 + O2
通电
电解水的微观过程
从分子和原子观点来看
在一切化学反应中,反应前后的原子种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以反应前后各物质的质量总和必然相等。
原子数目没有增减
原子种类没有改变
原子质量没有变化
化学反应前后质量守恒的原因
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
原子数目
原子质量
原子种类
微观
物质的总质量
元素质量
元素种类
六不变
物质的种类
分子的种类
改变
宏观
分子个数可能发生改变
质量守恒定律参加化学反应前后
探究三
探究活动:
往装有碳酸钠粉末的烧杯中滴加稀盐酸,观察天平会发生什么变化?
探究四
在空气中点燃镁条,观察天平会发生什么变化?
在探究反应物与生成物的质量关系时,反应要在 的容器中进行
问:小气球的作用?
防止因瓶内气压增大而导致的胶塞弹出
密闭
学了该定律,对我们有什么用?
可运用定律 1.推测一些物质的组成
2.解释一些实验事实
3.进行有关的计算
质量守恒定律的应用
已知蜡烛的的主要成分是石蜡。由蜡烛燃烧后生成水和二氧化碳的实验事实,判断石蜡中一定含有哪些元素?
答案:蜡烛燃烧后生成了H2O和CO2,根据质量守恒定律,产物中有C、H、O三种元素,说明反应物中也应含有这三种元素。反应物是石蜡和氧气,氧气由氧元素组成,那么石蜡中肯定含有碳和氢两种元素。
一:推断出一些物质的组成
练习:
1.某化合物通电完全分解后生成氢气(H2)和氧气(O2),试推断该化合物的组成元素中一定有______元素。
氢、氧
2. 某化合物X在催化剂的作用下被氧化的方程式为;4X+5O2 ==4NO+6H2O,根据质量守恒定律,X的化学式为( )
A.N2H2 B.NH2 C.NH4 D.NH3
D
1.下列现象可用质量守恒定律解释的是( )
A、10g水受热变成10g水蒸气
B、纸在空气中燃烧后化为灰烬.灰烬的质量比纸的质量小
C、铁在空气中灼烧后,质量增加
D、蜡烛受热熔化,冷却后质量不变
2.根据质量守恒定律可以推知,铁丝在氧气中燃烧后,生成物的质量( )
A、一定等于铁丝的质量 B、—定小于铁丝的质量
C、—定大于铁丝的质量 D、无法确定质量大小
BC
C
3.A+B=C+D, 已知12gA和18gB恰好完全反应生成28gC,则生成的D的质量是( )
A、30g B、58g C、2g D、无法确定
C
二:根据质量守恒定律解释下列实验现象
4. 不能用质量守恒定律解释的是( )
A. 潮湿的衣服在阳光下晒干
B. 蜡烛燃烧越来越短
C. 铁丝烧后质量增加
D. 高锰酸钾受热后质量减小
A
判断题:
1.氯酸钾受热分解后,剩余固体比原反应物
轻,这不符合质量守恒定律 。 ( )
×
2.根据质量守恒定律,水变成水蒸气,
质量保持不变。 ( )
3.煤球燃烧后质量减轻,这不符合质量守恒
定律( )
×
×
5.镁条在空气中燃烧后,生成的白色粉末的质量比原来镁条的质量增加。
答:镁条在空气中燃烧后,生成物了氧化镁。
根据质量守恒定律,镁条的质量和氧气的质量
总和等于氧化镁的质量。所以氧化镁的质量比
原来镁条的质量增加。
练习:1.
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
2. 6克碳与一定量的氧气恰好完全反应,
生成二氧化碳22克,有______克氧气
参加了反应。
16
三:根据质量守定律进行有关计算
1.加热10g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52g,则生成氧气的质量为_____g。
课堂发散题
0.48
2.已知反应3A+2B==2C+D,A、B两种物质完全反应时质量比为3:4,若生成C和D共140克,则该反应消耗B的质量为 .
80
1、在A+B=C+D反应中,5gA和4gB恰好完全反应生成3gC,则生成D的质量为( ) A 5g B.3g C.6g D.4g
C
2.已知一反应:2A2+3B2→2C,A,B为两元素
符号,则C的化学式为( )
A. AB B. A2B3 C. A4B6 D. A3B2
D
3.物质X是一种主要的阻燃剂。工业上用三氧化二锑(Sb2O3)生产X的化学方程式为Sb2O3+2H2O2=X+2H2O。根据质量守恒定律,推断X的化学式为( )
A.SbO2 B.Sb2O5
C.H2SbO4 D.HSbO3
B
点燃
4.该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为:______ 。
2∶1∶2
5.将4.6克某化合物放入氧气中完全燃烧,生成8.8克二氧化碳和5.4克水.问:这种化合物有哪几种元素组成
4.6克化合物中各元素的质量分别是多少
C、H、O
C:2.4g, H:0.6g, O:2.6g
6.加热氯酸钾与二氧化锰的混合物,剩余的固体质量减少了。
答:氯酸钾受热分解生成氯化钾和氧气。根据质量守恒定律,氯酸钾的质量等于氯化钾和氧气的质量总和。所以氯化钾的质量比反应前的氯酸钾轻。
7.如何验证酒精的成分里一定含有碳元素和氢元素(步骤、现象、结论)?
原子数目没有增减
原子种类没有改变
原子质量没有变化
推测一些物质的组成
进行有关的计算
解释一些实验事实
内容
内容
原因
原因
应用
应用
质量守恒定律
质量守恒定律
小结
小结
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
广告:水变成汽
油、柴油,经济
收入惊人,技术
转让,欢迎有识
之士加盟。
4.3 质量守恒定律
1﹑水通电分解的文字表达式?
2﹑分子与原子的主要区别?化学反应的实质?
在化学变化中,分子可以再分,而原子不能再分; 实质是分子分成原子,原子重新组合成新的分子.
水 氧气+氢气
通电
学习目标
1、通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系;
2、能够从宏观和微观的角度理解质量守恒定律;
3、能够运用质量守恒定律解释一些实验现象。
当物质发生化学变化并生成新物质时,反应物的质量总和跟生成物的质量总和相比较,存在什么关系呢
思考
硫酸铜+氢氧化钠 氢氧化铜+硫酸钠
CuSO4
NaOH
Cu(OH)2
Na2SO4
铁 + 硫酸铜 硫酸亚铁 + 铜
Fe
FeSO4
Cu
CuSO4
方案一
探究活动:
方案二
称量硫酸铜溶液和氢氧化钠溶液反应前后的质量是否相等
称量铁钉和硫酸铜溶液反应前后的质量是否相等
实验方案 方案一 方案二
实验现象
反应前总质量(g)
反应后总质量(g)
分析
m1
铁丝表面出现红色
物质,天平平衡
m2
M1
M2
m1=m2 ,反应前后总质量相等
M1=M2 ,反应前后总质量相等
生成蓝色沉淀,
天平平衡
结论:反应前的总质量等于反应后的总质量
质量守恒定律
参加反应的
各物质的质
量总和
生成的各物质的质量
总和
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
1756年俄国化学家罗蒙诺索夫把锡放在密闭的容器里煅烧后生成氧化锡,在煅烧前后容器内总质量并没有发生变化。经过反复的实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。但这一发现当时没有引起科学家的注意,直到1777年法国的拉瓦锡做了同样的实验,也得到同样的结论,这一定律才获得公认。1908年德国化学家朗道耳特及1912年英国化学家曼莱做了精确度极高的实验,反应前后质量的变化小于一千万分之一。这个差别在实验误差范围之内,因此科学家一致承认了这一定律。
1.有下列事实:
①蜡烛燃烧后其质量减小了。
②铁制品生锈后质量增加了。
③湿衣服晾干后,其质量比湿的时候减少。
④石灰水放在敞口的容器中,其质量增加。
遵守质量守恒定律的是 。
①②④
2.对质量守恒定律的理解,最确切的是( ) A.10 g冰受热融化成10 g水 B.参加反应的氢气和氧气的体积,
一定等于生成水的体积 C.反应物的质量等于生成物的质量 D.参加化学反应的各物质的质量总和,
等于反应后生成的各物质的质量总和
D
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
适用范围:化学变化。
为什么反应前后质量不变呢?
以水通电分解为例:水 氢气+氧气
通电
分子 分化 原子 重新组合 新分子 聚集 新物质
符号表达式: H20 H2 + O2
通电
电解水的微观过程
从分子和原子观点来看
在一切化学反应中,反应前后的原子种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以反应前后各物质的质量总和必然相等。
原子数目没有增减
原子种类没有改变
原子质量没有变化
化学反应前后质量守恒的原因
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
原子数目
原子质量
原子种类
微观
物质的总质量
元素质量
元素种类
六不变
物质的种类
分子的种类
改变
宏观
分子个数可能发生改变
质量守恒定律参加化学反应前后
探究三
探究活动:
往装有碳酸钠粉末的烧杯中滴加稀盐酸,观察天平会发生什么变化?
探究四
在空气中点燃镁条,观察天平会发生什么变化?
在探究反应物与生成物的质量关系时,反应要在 的容器中进行
问:小气球的作用?
防止因瓶内气压增大而导致的胶塞弹出
密闭
学了该定律,对我们有什么用?
可运用定律 1.推测一些物质的组成
2.解释一些实验事实
3.进行有关的计算
质量守恒定律的应用
已知蜡烛的的主要成分是石蜡。由蜡烛燃烧后生成水和二氧化碳的实验事实,判断石蜡中一定含有哪些元素?
答案:蜡烛燃烧后生成了H2O和CO2,根据质量守恒定律,产物中有C、H、O三种元素,说明反应物中也应含有这三种元素。反应物是石蜡和氧气,氧气由氧元素组成,那么石蜡中肯定含有碳和氢两种元素。
一:推断出一些物质的组成
练习:
1.某化合物通电完全分解后生成氢气(H2)和氧气(O2),试推断该化合物的组成元素中一定有______元素。
氢、氧
2. 某化合物X在催化剂的作用下被氧化的方程式为;4X+5O2 ==4NO+6H2O,根据质量守恒定律,X的化学式为( )
A.N2H2 B.NH2 C.NH4 D.NH3
D
1.下列现象可用质量守恒定律解释的是( )
A、10g水受热变成10g水蒸气
B、纸在空气中燃烧后化为灰烬.灰烬的质量比纸的质量小
C、铁在空气中灼烧后,质量增加
D、蜡烛受热熔化,冷却后质量不变
2.根据质量守恒定律可以推知,铁丝在氧气中燃烧后,生成物的质量( )
A、一定等于铁丝的质量 B、—定小于铁丝的质量
C、—定大于铁丝的质量 D、无法确定质量大小
BC
C
3.A+B=C+D, 已知12gA和18gB恰好完全反应生成28gC,则生成的D的质量是( )
A、30g B、58g C、2g D、无法确定
C
二:根据质量守恒定律解释下列实验现象
4. 不能用质量守恒定律解释的是( )
A. 潮湿的衣服在阳光下晒干
B. 蜡烛燃烧越来越短
C. 铁丝烧后质量增加
D. 高锰酸钾受热后质量减小
A
判断题:
1.氯酸钾受热分解后,剩余固体比原反应物
轻,这不符合质量守恒定律 。 ( )
×
2.根据质量守恒定律,水变成水蒸气,
质量保持不变。 ( )
3.煤球燃烧后质量减轻,这不符合质量守恒
定律( )
×
×
5.镁条在空气中燃烧后,生成的白色粉末的质量比原来镁条的质量增加。
答:镁条在空气中燃烧后,生成物了氧化镁。
根据质量守恒定律,镁条的质量和氧气的质量
总和等于氧化镁的质量。所以氧化镁的质量比
原来镁条的质量增加。
练习:1.
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
2. 6克碳与一定量的氧气恰好完全反应,
生成二氧化碳22克,有______克氧气
参加了反应。
16
三:根据质量守定律进行有关计算
1.加热10g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52g,则生成氧气的质量为_____g。
课堂发散题
0.48
2.已知反应3A+2B==2C+D,A、B两种物质完全反应时质量比为3:4,若生成C和D共140克,则该反应消耗B的质量为 .
80
1、在A+B=C+D反应中,5gA和4gB恰好完全反应生成3gC,则生成D的质量为( ) A 5g B.3g C.6g D.4g
C
2.已知一反应:2A2+3B2→2C,A,B为两元素
符号,则C的化学式为( )
A. AB B. A2B3 C. A4B6 D. A3B2
D
3.物质X是一种主要的阻燃剂。工业上用三氧化二锑(Sb2O3)生产X的化学方程式为Sb2O3+2H2O2=X+2H2O。根据质量守恒定律,推断X的化学式为( )
A.SbO2 B.Sb2O5
C.H2SbO4 D.HSbO3
B
点燃
4.该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为:______ 。
2∶1∶2
5.将4.6克某化合物放入氧气中完全燃烧,生成8.8克二氧化碳和5.4克水.问:这种化合物有哪几种元素组成
4.6克化合物中各元素的质量分别是多少
C、H、O
C:2.4g, H:0.6g, O:2.6g
6.加热氯酸钾与二氧化锰的混合物,剩余的固体质量减少了。
答:氯酸钾受热分解生成氯化钾和氧气。根据质量守恒定律,氯酸钾的质量等于氯化钾和氧气的质量总和。所以氯化钾的质量比反应前的氯酸钾轻。
7.如何验证酒精的成分里一定含有碳元素和氢元素(步骤、现象、结论)?
原子数目没有增减
原子种类没有改变
原子质量没有变化
推测一些物质的组成
进行有关的计算
解释一些实验事实
内容
内容
原因
原因
应用
应用
质量守恒定律
质量守恒定律
小结
小结
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
