京改版九年级上册化学 7.3 依据化学方程式的简单计算 课件(23张PPT)
文档属性
| 名称 | 京改版九年级上册化学 7.3 依据化学方程式的简单计算 课件(23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 130.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-26 15:43:07 | ||
图片预览








文档简介
课件23张PPT。7-3依据化学方程式的简单计算 ( 第1课时 ) 【学习目标】:1. 在正确书写化学方程式的基础上,进行简单的计算。
2. 认识化学计算对于解决实际问题的重要意义,进一步了解化学定量研究的实际应用。【知识回顾】:计算下列化学式的相对分子质量(或总和)
H2O
=_____________________________________
2H2O
=_____________________________________
KMnO4
=_____________________________________
2KMnO4
=_____________________________________1 X 2 + 16 =18(1 X 2 + 16 ) X 2 =3639 + 55 + 16 X 4 =158(39 + 55 + 16 X 4) X 2 =316环节一 理解利用化学方程式进行计算的依据是化学方程式中各物质的质量关系。例:铝在氧气中燃烧生成氧化铝。反应的化学方程式是__________________________
相对原子质量Al-27,O-16,在这个反应中,铝、氧气、氧化铝的质量比是( )
化学计量数之比是( )
27︰32︰102 B. 27︰24︰43
C. 4︰3︰2 D.108︰96︰204 Al + O2 --- Al2O3324点燃DC注意:
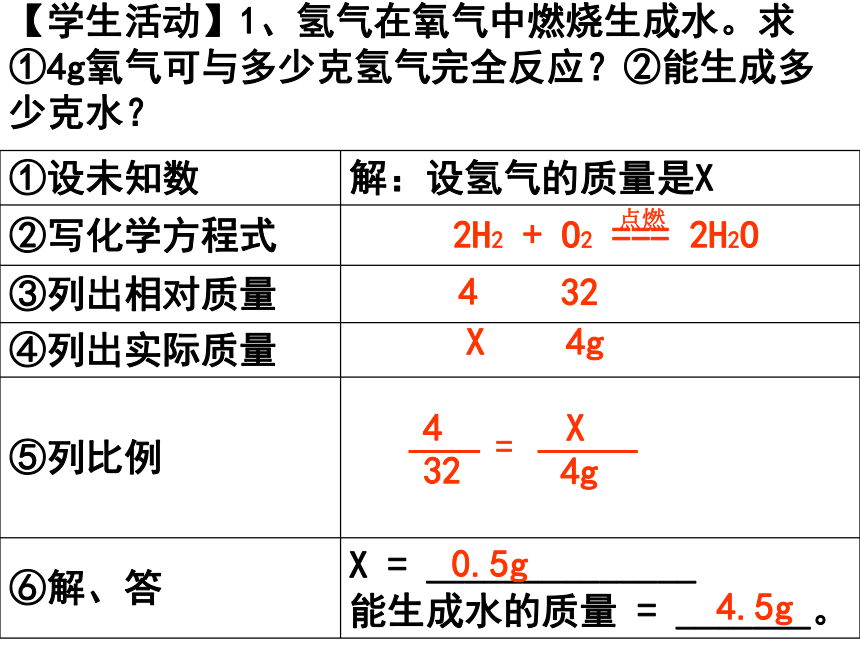
化学方程式中的反应物、生成物之间的质量比,等于每种物质的相对分子质量X各自的化学计量数的比,这一比例是我们利用化学方程式进行计算的依据。区分各物质质量比与化学计量数比的概念。环节二: 认识到“正确书写化学方程式以及找出已知和未知量”是进行化学方程式计算的重要思路,初步学会规范的解题格式。课本P102例1: 解:设得到氧气的质量为X。2KmnO4 === K2MnO4 + MnO2 + O2↑△316326.3gX3166.3g=32XX =32 X 6.3g316= 0.6g答:可以得到氧气的质量是0.6g。课本P102例2:解:设需要碳酸钙的质量为X。CaCO3 === CaO + CO2↑高温10056X5.6t10056=X5.6tX =100X5.6t56=10t答:需要碳酸钙的质量为10t。【学生活动】1、氢气在氧气中燃烧生成水。求①4g氧气可与多少克氢气完全反应?②能生成多少克水?2H2 + O2 === 2H2O点燃3244gX432=X4g0.5g4.5g【练习】:1. 某工厂需要100kg氧气做原料,若用电解水的方法制取这些氧气,消耗水的质量是多少?同时可以得到氢气的质量是多少? (相对原子质量H:1 O:16)
解:设消耗水的质量是X
H2O ---
同时可以得到氢气的质量=2H2↑+ O2↑2通电3632X100kg3632=X100kgX =36 X 100kg32=112.5kg112.5kg–100kg=12.5kg2. 锌与稀盐酸HCl反应可制得氢气,同时生成氯化锌ZnCl2 。现将6.5克锌粒放入足量的稀盐酸中,可得到多少克氢气? (相对原子质量H:1 Cl:35.5 Zn:65 )
解:设得到氢气质量是X
Zn + HCl ---ZnCl2 + H2↑26526.5克X652=6.5克XX =2X 6.5克65=0.2克答:可得到0.2克氢气。3.(相对原子质量Fe:56 O:16)铁在氧气中燃烧生成四氧化三铁。在这个反应中,Fe、O2、
Fe3O4的质量比是( ),化学计量数之比是( )
A.56∶32∶88 B.168∶64∶232
C.3∶2∶1 D.4∶3∶2
4.高锰酸钾受热分解的化学方程式_________________________________________。加热4g KMnO4,一段时间后停止加热,称得剩余物的质量为3.6 g,则生成氧气的质量是_____ g,剩余物是________(纯净物 / 混合物 / 化合物),其中所含的物质有___________________________。BCKMnO4 --- K2MnO4 +MnO2 + O22△0.4混合物K2MnO4和MnO2【提高题】:5.某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:若反应后,双氧水分解完全且氧气全部逸出,该同
学得出的结论中,不合理的是 ( )
A.反应速率逐渐加快。 B.最多得到氧气的质量为1.6g。 C.催化剂二氧化锰的质量为0.3g 。
D.反应得到水和氧气的质量比为9∶8。A6.一定条件下,在密闭器内发生某反应,测得反应前后各物质的质量如下表,说法正确的是( )A.该反应属于化合反应 B.W是一种由碳、氢两种元素组成的化合物
C.W是一种由碳、氢、氧三种元素组成的化合D.X的值为44C7-3依据化学方程式的简单计算 ( 第2课时 ) 例1:碳酸氢钠NaHCO3受热不稳定,会分解得到碳酸钠Na2CO3、二氧化碳和水,其反应的的化学方程式__________________________________。试计算多少克NaHCO3完全生成4.4克CO2?
2NaHCO3? === Na2CO3+CO2↑+H2O △2NaHCO3? === Na2CO3+CO2↑+H2O △2X8444X4.4g168X=444.4gX =16.8g例2:(2006年广州中考)分解过氧化氢H2O2溶液也可制得氧气。H2O2的相对分子质量是 ,其中氢元素与氧元素的质量比是 。氧元素的质量分数是 (用分数表示)。34g过氧化氢中氧元素的质量m1= g,34g过氧化氢完全分解后,放出氧气的质量m2= g 。请回答,根据质量守恒定律,(m1-m2)能表示什么物质的质量? 341:1694.1%321634g过氧化氢完全分解后,生成的水中氧元素质量。【练习】:1.某补钙剂标签上对所含的成分有如下说明:每片含主要成分碳酸钙1.5g(相当于钙600mg)。某同学要探究该钙片的主要成分含量是否正确,他取出10片钙片,加入足量的稀盐酸,充分反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),收集到6.6g二氧化碳。试计算:
(1)每片补钙剂与盐酸充分反应能得到二氧化碳的质量是________g,含碳酸钙的质量是______g
(2)每片补钙剂含钙元素的质量是____________
(3)通过计算,你判断该标签上钙片的主要成分含量说明___________(正确 / 不正确)0.661.50.6g正确2.(2008·广州中考)煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气。某工厂有含硫0.8%的煤5000t,问答下列问题:( 相对原子质量:H—1 O—16 S—32)
①5000t含硫0.8%的煤中,所含硫的质量是_______ t;硫燃烧的化学方程式___________________。
②二氧化硫的相对分子质量为 ,上述煤如果不经处理直接完全燃烧,产生二氧化硫的质量是 t;
③二氧化硫可用于生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4 。参加反应的SO2与生成的H2SO4的质量比是 ,如果将上述SO2全部转化,可得到H2SO4的质量为________t (精确到0.1)。 40S + O2 === SO2点燃32+16X2=648032:49122.53.煤气中加人有特殊气味的乙硫醇可提示煤气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为:2X+9O2 === 4CO2十2SO2十6H2O,则X是( )
C4H12S2 B. C2H6S
C. C2H6O2 D. C2H6
4.铝在氧气中燃烧生成氧化铝。反应的化学方程式是_____________________________________,
在这个反应中,Al、O2、Al2O3的质量比是
( )化学计量数之比是( )
( 相对原子质量Al-27,O-16 )
27︰32︰102 B. 27︰24︰43
C. 4︰3︰2 D.108︰96︰204点燃B4Al + 3O2 === 2Al2O3点燃DC5.在化学反应A + B=C + D中,8g A和16g B恰好完全反应生成10g C,若12g A参加反应,生成D的质量是( )
A.20 g B.24 g
C.15 g D.21 g
6.在化学反应A+2B=C+2D中,4gA和16gB完全反应,若A的相对分子质量是16,则B的相对分子质量是 ( )
A.64 B.32 C.16 D.8
7.A和B的混合物212g恰好完全反应生成C和D,已知2A + 5B=4C + 2D,测得C和D的质量比为
44︰9,则生成的C的质量为_________________。DB176g【提高题】:8.在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,根据所给数据回答问题:(1)根据质量守恒定律,x =____________;
(2)尝试写出上述反应的符号表达式
__________________________________________
(3)物质W中一定含有__________________元素,
可能含有_____________________元素。OW + O2 === CO2 + H2O一定条件C、HO 9.煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气。某工厂有含硫0.8%的煤5000t,问答下列问题:S:32
①5000t含硫0.8%的煤中,所含硫的质量是 t;硫燃烧的表达式
②二氧化硫的相对分子质量为 ,上述煤如果不经处理直接完全燃烧,产生二氧化硫的质量是 t;
③二氧化硫可用于生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4。参加反应的SO2与生成的H2SO4的质量比是 ,如果将上述SO2全部转化,可得到H2SO4的质量为 t(精确到0.1)。
?40S + O2 === SO2点燃648032:49122.510.如图所示是某反应前后的微观示意图,“ ”和“ ”表示两种不同的原子。则该反应( )
A.是化合反应
B.有单质生成
C.反应前后分子种类不变
D.参加反应的两种分子个数比为4:1
“A
2. 认识化学计算对于解决实际问题的重要意义,进一步了解化学定量研究的实际应用。【知识回顾】:计算下列化学式的相对分子质量(或总和)
H2O
=_____________________________________
2H2O
=_____________________________________
KMnO4
=_____________________________________
2KMnO4
=_____________________________________1 X 2 + 16 =18(1 X 2 + 16 ) X 2 =3639 + 55 + 16 X 4 =158(39 + 55 + 16 X 4) X 2 =316环节一 理解利用化学方程式进行计算的依据是化学方程式中各物质的质量关系。例:铝在氧气中燃烧生成氧化铝。反应的化学方程式是__________________________
相对原子质量Al-27,O-16,在这个反应中,铝、氧气、氧化铝的质量比是( )
化学计量数之比是( )
27︰32︰102 B. 27︰24︰43
C. 4︰3︰2 D.108︰96︰204 Al + O2 --- Al2O3324点燃DC注意:
化学方程式中的反应物、生成物之间的质量比,等于每种物质的相对分子质量X各自的化学计量数的比,这一比例是我们利用化学方程式进行计算的依据。区分各物质质量比与化学计量数比的概念。环节二: 认识到“正确书写化学方程式以及找出已知和未知量”是进行化学方程式计算的重要思路,初步学会规范的解题格式。课本P102例1: 解:设得到氧气的质量为X。2KmnO4 === K2MnO4 + MnO2 + O2↑△316326.3gX3166.3g=32XX =32 X 6.3g316= 0.6g答:可以得到氧气的质量是0.6g。课本P102例2:解:设需要碳酸钙的质量为X。CaCO3 === CaO + CO2↑高温10056X5.6t10056=X5.6tX =100X5.6t56=10t答:需要碳酸钙的质量为10t。【学生活动】1、氢气在氧气中燃烧生成水。求①4g氧气可与多少克氢气完全反应?②能生成多少克水?2H2 + O2 === 2H2O点燃3244gX432=X4g0.5g4.5g【练习】:1. 某工厂需要100kg氧气做原料,若用电解水的方法制取这些氧气,消耗水的质量是多少?同时可以得到氢气的质量是多少? (相对原子质量H:1 O:16)
解:设消耗水的质量是X
H2O ---
同时可以得到氢气的质量=2H2↑+ O2↑2通电3632X100kg3632=X100kgX =36 X 100kg32=112.5kg112.5kg–100kg=12.5kg2. 锌与稀盐酸HCl反应可制得氢气,同时生成氯化锌ZnCl2 。现将6.5克锌粒放入足量的稀盐酸中,可得到多少克氢气? (相对原子质量H:1 Cl:35.5 Zn:65 )
解:设得到氢气质量是X
Zn + HCl ---ZnCl2 + H2↑26526.5克X652=6.5克XX =2X 6.5克65=0.2克答:可得到0.2克氢气。3.(相对原子质量Fe:56 O:16)铁在氧气中燃烧生成四氧化三铁。在这个反应中,Fe、O2、
Fe3O4的质量比是( ),化学计量数之比是( )
A.56∶32∶88 B.168∶64∶232
C.3∶2∶1 D.4∶3∶2
4.高锰酸钾受热分解的化学方程式_________________________________________。加热4g KMnO4,一段时间后停止加热,称得剩余物的质量为3.6 g,则生成氧气的质量是_____ g,剩余物是________(纯净物 / 混合物 / 化合物),其中所含的物质有___________________________。BCKMnO4 --- K2MnO4 +MnO2 + O22△0.4混合物K2MnO4和MnO2【提高题】:5.某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:若反应后,双氧水分解完全且氧气全部逸出,该同
学得出的结论中,不合理的是 ( )
A.反应速率逐渐加快。 B.最多得到氧气的质量为1.6g。 C.催化剂二氧化锰的质量为0.3g 。
D.反应得到水和氧气的质量比为9∶8。A6.一定条件下,在密闭器内发生某反应,测得反应前后各物质的质量如下表,说法正确的是( )A.该反应属于化合反应 B.W是一种由碳、氢两种元素组成的化合物
C.W是一种由碳、氢、氧三种元素组成的化合D.X的值为44C7-3依据化学方程式的简单计算 ( 第2课时 ) 例1:碳酸氢钠NaHCO3受热不稳定,会分解得到碳酸钠Na2CO3、二氧化碳和水,其反应的的化学方程式__________________________________。试计算多少克NaHCO3完全生成4.4克CO2?
2NaHCO3? === Na2CO3+CO2↑+H2O △2NaHCO3? === Na2CO3+CO2↑+H2O △2X8444X4.4g168X=444.4gX =16.8g例2:(2006年广州中考)分解过氧化氢H2O2溶液也可制得氧气。H2O2的相对分子质量是 ,其中氢元素与氧元素的质量比是 。氧元素的质量分数是 (用分数表示)。34g过氧化氢中氧元素的质量m1= g,34g过氧化氢完全分解后,放出氧气的质量m2= g 。请回答,根据质量守恒定律,(m1-m2)能表示什么物质的质量? 341:1694.1%321634g过氧化氢完全分解后,生成的水中氧元素质量。【练习】:1.某补钙剂标签上对所含的成分有如下说明:每片含主要成分碳酸钙1.5g(相当于钙600mg)。某同学要探究该钙片的主要成分含量是否正确,他取出10片钙片,加入足量的稀盐酸,充分反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),收集到6.6g二氧化碳。试计算:
(1)每片补钙剂与盐酸充分反应能得到二氧化碳的质量是________g,含碳酸钙的质量是______g
(2)每片补钙剂含钙元素的质量是____________
(3)通过计算,你判断该标签上钙片的主要成分含量说明___________(正确 / 不正确)0.661.50.6g正确2.(2008·广州中考)煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气。某工厂有含硫0.8%的煤5000t,问答下列问题:( 相对原子质量:H—1 O—16 S—32)
①5000t含硫0.8%的煤中,所含硫的质量是_______ t;硫燃烧的化学方程式___________________。
②二氧化硫的相对分子质量为 ,上述煤如果不经处理直接完全燃烧,产生二氧化硫的质量是 t;
③二氧化硫可用于生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4 。参加反应的SO2与生成的H2SO4的质量比是 ,如果将上述SO2全部转化,可得到H2SO4的质量为________t (精确到0.1)。 40S + O2 === SO2点燃32+16X2=648032:49122.53.煤气中加人有特殊气味的乙硫醇可提示煤气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为:2X+9O2 === 4CO2十2SO2十6H2O,则X是( )
C4H12S2 B. C2H6S
C. C2H6O2 D. C2H6
4.铝在氧气中燃烧生成氧化铝。反应的化学方程式是_____________________________________,
在这个反应中,Al、O2、Al2O3的质量比是
( )化学计量数之比是( )
( 相对原子质量Al-27,O-16 )
27︰32︰102 B. 27︰24︰43
C. 4︰3︰2 D.108︰96︰204点燃B4Al + 3O2 === 2Al2O3点燃DC5.在化学反应A + B=C + D中,8g A和16g B恰好完全反应生成10g C,若12g A参加反应,生成D的质量是( )
A.20 g B.24 g
C.15 g D.21 g
6.在化学反应A+2B=C+2D中,4gA和16gB完全反应,若A的相对分子质量是16,则B的相对分子质量是 ( )
A.64 B.32 C.16 D.8
7.A和B的混合物212g恰好完全反应生成C和D,已知2A + 5B=4C + 2D,测得C和D的质量比为
44︰9,则生成的C的质量为_________________。DB176g【提高题】:8.在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,根据所给数据回答问题:(1)根据质量守恒定律,x =____________;
(2)尝试写出上述反应的符号表达式
__________________________________________
(3)物质W中一定含有__________________元素,
可能含有_____________________元素。OW + O2 === CO2 + H2O一定条件C、HO 9.煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气。某工厂有含硫0.8%的煤5000t,问答下列问题:S:32
①5000t含硫0.8%的煤中,所含硫的质量是 t;硫燃烧的表达式
②二氧化硫的相对分子质量为 ,上述煤如果不经处理直接完全燃烧,产生二氧化硫的质量是 t;
③二氧化硫可用于生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4。参加反应的SO2与生成的H2SO4的质量比是 ,如果将上述SO2全部转化,可得到H2SO4的质量为 t(精确到0.1)。
?40S + O2 === SO2点燃648032:49122.510.如图所示是某反应前后的微观示意图,“ ”和“ ”表示两种不同的原子。则该反应( )
A.是化合反应
B.有单质生成
C.反应前后分子种类不变
D.参加反应的两种分子个数比为4:1
“A
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
