人教版九年级化学课件:3.3元素 第1课时 元素及其元素符号(20张PPT)
文档属性
| 名称 | 人教版九年级化学课件:3.3元素 第1课时 元素及其元素符号(20张PPT) | 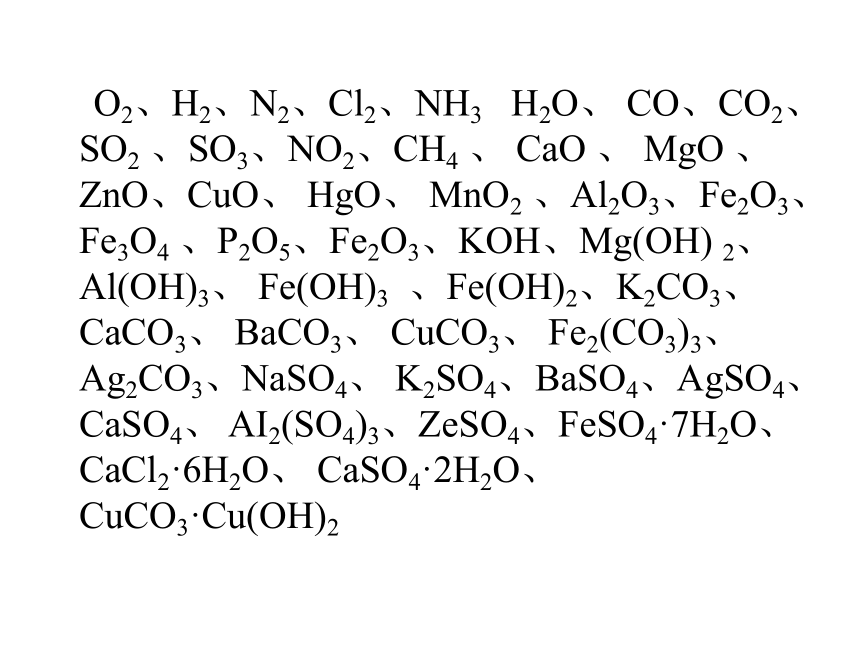 | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-26 16:04:59 | ||
图片预览
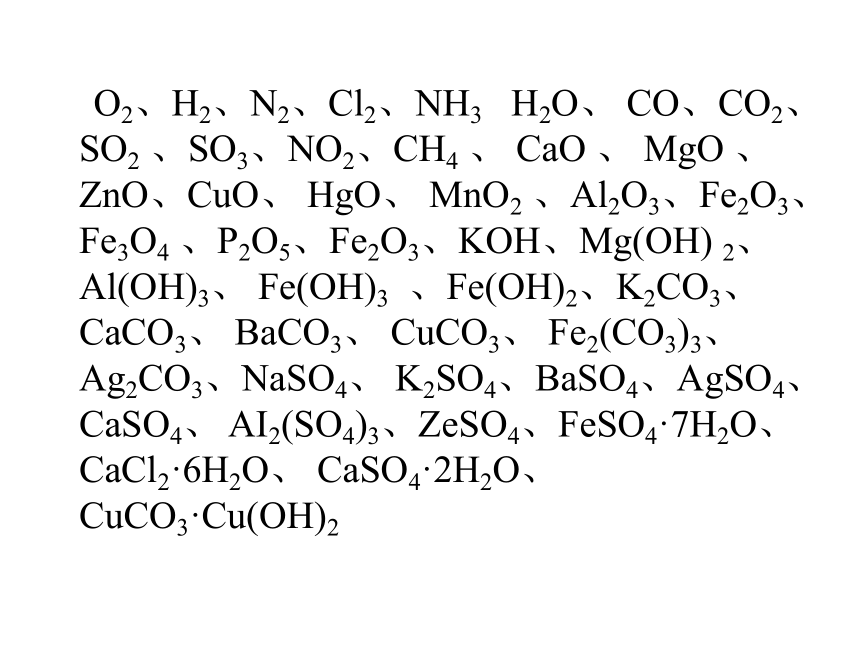





文档简介
(共20张PPT)
O2、H2、N2、Cl2、NH3 H2O、 CO、CO2、SO2 、SO3、NO2、CH4 、 CaO 、 MgO 、ZnO、CuO、 HgO、 MnO2 、Al2O3、Fe2O3、 Fe3O4 、P2O5、Fe2O3、KOH、Mg(OH) 2、 Al(OH)3、 Fe(OH)3 、Fe(OH)2、K2CO3、 CaCO3、 BaCO3、 CuCO3、 Fe2(CO3)3、Ag2CO3、NaSO4、 K2SO4、BaSO4、AgSO4、 CaSO4、 AI2(SO4)3、ZeSO4、FeSO4·7H2O、CaCl2·6H2O、 CaSO4·2H2O、CuCO3·Cu(OH)2
想一想
以上的“钙”“锌” 指的是什么?
缺“钙”吃什么好?
我们每时每刻都在与化学元素打交道。
什么叫元素呢?
第三单元 构成物质的奥秘
课题3 元素
第1课时 元素及元素符号
1.了解元素的概念
2.了解元素符号所表示的意义,学会正确书写元素符号
3.记住一些常见元素的名称和符号
4.初步认识元素周期表;能根据原子序数在元素周期表中找到指定元素的一些信息
学习目标
相对原子质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比。
这种碳原子叫做碳12,是指原子核内含有6个质子和6个中子的碳原子 。
这说明是不是还有其它的碳原子呢?
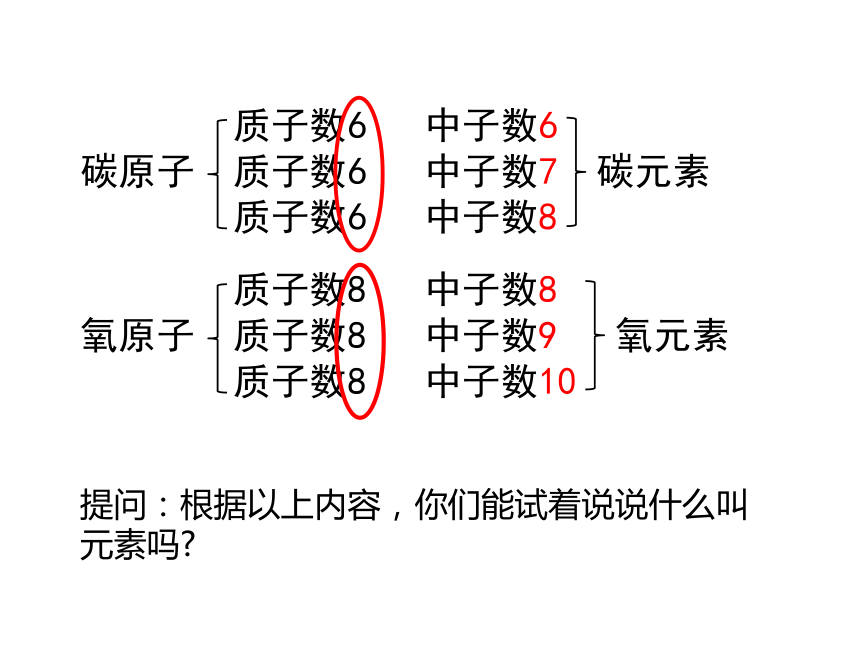
提问:根据以上内容,你们能试着说说什么叫元素吗?
问题:区分钙元素和锌元素关键看什么?
核电荷数或质子数。
一、元素
1、定义:
元素是质子数(即核电荷数)相同的一类原子的总称。
因此,不同种元素的本质区别是:质子数(或核电荷数)不同。即:质子数决定元素种类
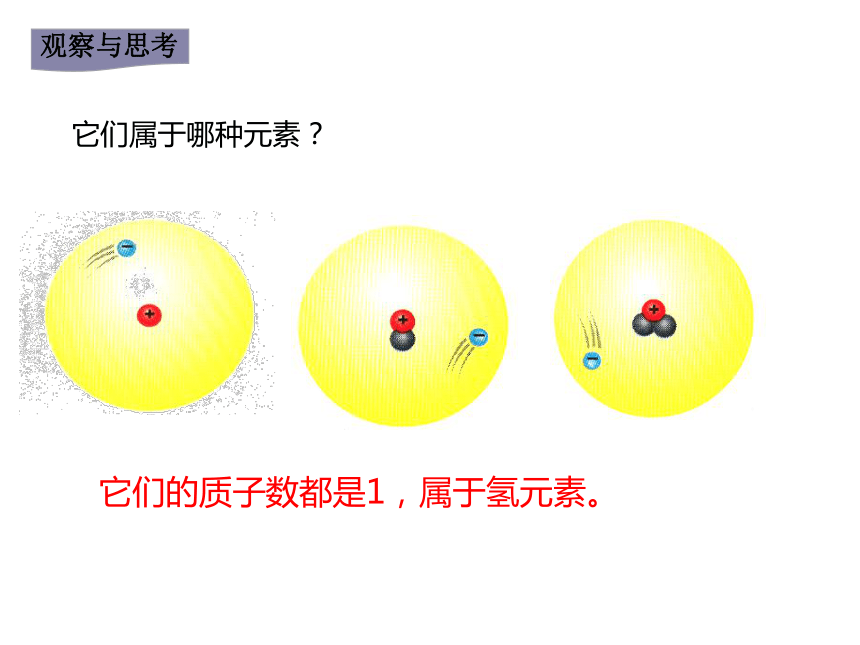
它们的质子数都是1,属于氢元素。
它们属于哪种元素?
判断某几个原子是否为同种元素的依据是什么?
质子数即核电荷数相同,元素相同
质子数即核电荷数不同,元素不同
重新
组合
水分子(H2O)
氧分子
(O2)
氢分子
(H2)
通电
破裂成氢原子和氧原子
电解水的示意图
思考:化学反应前后,分子变化了吗?元素变化了吗?
分子的种类 ,原子的种类 。
元素的种类 ,物质的种类 。
不变
改变
改变
不变
物质发生化学变化时,原子的种类不变,元素种类不变。
元素在地壳中的含量和分布
(2)地壳中含量最多的元素是:
(3)地壳中含量最多的金属元素是:
氧
铝
(1)地壳中含量居于前五位的元素是:
氧、硅、铝、铁、钙
元素
金属元素:
非金属元素:
元素分类
目前已发现一百余种元素
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
带“石”旁 固态非金属
带“气”旁 气态非金属
带“氵”旁 液态非金属
氦、氖、氩、氪、氙
原子和元素的区别和联系
1、是化学变化中的 粒子。是微观概念。
1、是一类原子(核电荷数相同)的总称。是 概念
原子与元素是个体与总体的关系,元素是同一类原子的总称,原子的 (即核内的核电荷数)决定元素的种类
3、从微观角度描述分子的构成或物质的构成
3、从宏观角度描述物质的组成
2、既讲种类,又讲个数
2、 ,
如:氧分子由 构成
金属铁由 构成
如:氧气由 组成
最小
宏观
氧原子
铁原子
氧元素
质子数
只讲种类,不讲个数
原 子 元 素
区
别
联系
答出元素种类
答出粒子种类
答出原子种类
答出原子种类和个数
四种问法 四种答法
1 物质由什么组成
2 物质由什么构成
3 分子由什么构成
4 每个分子由什么构成
1.一种元素跟另一种元素之间的最本质的不同点是( )。
A.质子数 B.中子数 C.电子数 D.相对原子质量
2.地壳中含量最多的四种元素,由多到少的排列顺序正确的是( )。
A.Si、O、Fe、Al B.O、Si、Al、Fe
C.Al、Fe、Si、O D.O、Fe、A1、Si
3.下列符号中,同时表示一种单质、一种原子和一种元素的是( )。
A.2O B.H2 C.N D.Fe
4.下列元素符号中,书写正确的是( )。
A.Mn B.CA C.Al D.hG
5.食用碘盐可预防甲状腺肿等疾病。市售加碘食盐的包装袋上标明每千克含碘20~40mg,这里标明的碘是指( )。
A.碘单质 B.碘分子 C.碘元素 D.碘原子
6.在元素周期表中,非金属元素主要位于( )。
A.左上方区域 B.右上方区域 C.左下方区域 D.右下方区域
B
D
C
A
A
A
O2、H2、N2、Cl2、NH3 H2O、 CO、CO2、SO2 、SO3、NO2、CH4 、 CaO 、 MgO 、ZnO、CuO、 HgO、 MnO2 、Al2O3、Fe2O3、 Fe3O4 、P2O5、Fe2O3、KOH、Mg(OH) 2、 Al(OH)3、 Fe(OH)3 、Fe(OH)2、K2CO3、 CaCO3、 BaCO3、 CuCO3、 Fe2(CO3)3、Ag2CO3、NaSO4、 K2SO4、BaSO4、AgSO4、 CaSO4、 AI2(SO4)3、ZeSO4、FeSO4·7H2O、CaCl2·6H2O、 CaSO4·2H2O、CuCO3·Cu(OH)2
想一想
以上的“钙”“锌” 指的是什么?
缺“钙”吃什么好?
我们每时每刻都在与化学元素打交道。
什么叫元素呢?
第三单元 构成物质的奥秘
课题3 元素
第1课时 元素及元素符号
1.了解元素的概念
2.了解元素符号所表示的意义,学会正确书写元素符号
3.记住一些常见元素的名称和符号
4.初步认识元素周期表;能根据原子序数在元素周期表中找到指定元素的一些信息
学习目标
相对原子质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比。
这种碳原子叫做碳12,是指原子核内含有6个质子和6个中子的碳原子 。
这说明是不是还有其它的碳原子呢?
提问:根据以上内容,你们能试着说说什么叫元素吗?
问题:区分钙元素和锌元素关键看什么?
核电荷数或质子数。
一、元素
1、定义:
元素是质子数(即核电荷数)相同的一类原子的总称。
因此,不同种元素的本质区别是:质子数(或核电荷数)不同。即:质子数决定元素种类
它们的质子数都是1,属于氢元素。
它们属于哪种元素?
判断某几个原子是否为同种元素的依据是什么?
质子数即核电荷数相同,元素相同
质子数即核电荷数不同,元素不同
重新
组合
水分子(H2O)
氧分子
(O2)
氢分子
(H2)
通电
破裂成氢原子和氧原子
电解水的示意图
思考:化学反应前后,分子变化了吗?元素变化了吗?
分子的种类 ,原子的种类 。
元素的种类 ,物质的种类 。
不变
改变
改变
不变
物质发生化学变化时,原子的种类不变,元素种类不变。
元素在地壳中的含量和分布
(2)地壳中含量最多的元素是:
(3)地壳中含量最多的金属元素是:
氧
铝
(1)地壳中含量居于前五位的元素是:
氧、硅、铝、铁、钙
元素
金属元素:
非金属元素:
元素分类
目前已发现一百余种元素
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
带“石”旁 固态非金属
带“气”旁 气态非金属
带“氵”旁 液态非金属
氦、氖、氩、氪、氙
原子和元素的区别和联系
1、是化学变化中的 粒子。是微观概念。
1、是一类原子(核电荷数相同)的总称。是 概念
原子与元素是个体与总体的关系,元素是同一类原子的总称,原子的 (即核内的核电荷数)决定元素的种类
3、从微观角度描述分子的构成或物质的构成
3、从宏观角度描述物质的组成
2、既讲种类,又讲个数
2、 ,
如:氧分子由 构成
金属铁由 构成
如:氧气由 组成
最小
宏观
氧原子
铁原子
氧元素
质子数
只讲种类,不讲个数
原 子 元 素
区
别
联系
答出元素种类
答出粒子种类
答出原子种类
答出原子种类和个数
四种问法 四种答法
1 物质由什么组成
2 物质由什么构成
3 分子由什么构成
4 每个分子由什么构成
1.一种元素跟另一种元素之间的最本质的不同点是( )。
A.质子数 B.中子数 C.电子数 D.相对原子质量
2.地壳中含量最多的四种元素,由多到少的排列顺序正确的是( )。
A.Si、O、Fe、Al B.O、Si、Al、Fe
C.Al、Fe、Si、O D.O、Fe、A1、Si
3.下列符号中,同时表示一种单质、一种原子和一种元素的是( )。
A.2O B.H2 C.N D.Fe
4.下列元素符号中,书写正确的是( )。
A.Mn B.CA C.Al D.hG
5.食用碘盐可预防甲状腺肿等疾病。市售加碘食盐的包装袋上标明每千克含碘20~40mg,这里标明的碘是指( )。
A.碘单质 B.碘分子 C.碘元素 D.碘原子
6.在元素周期表中,非金属元素主要位于( )。
A.左上方区域 B.右上方区域 C.左下方区域 D.右下方区域
B
D
C
A
A
A
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
