人教版九年级上册化学 实验活动2 二氧化碳的实验室制取与性质 课件(16张PPT)
文档属性
| 名称 | 人教版九年级上册化学 实验活动2 二氧化碳的实验室制取与性质 课件(16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 669.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-27 00:00:00 | ||
图片预览



文档简介
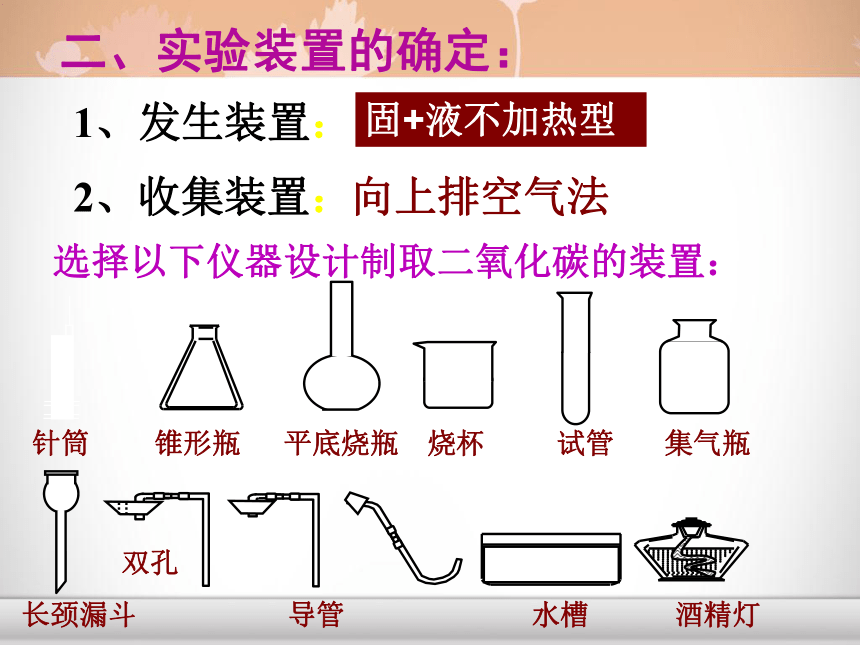
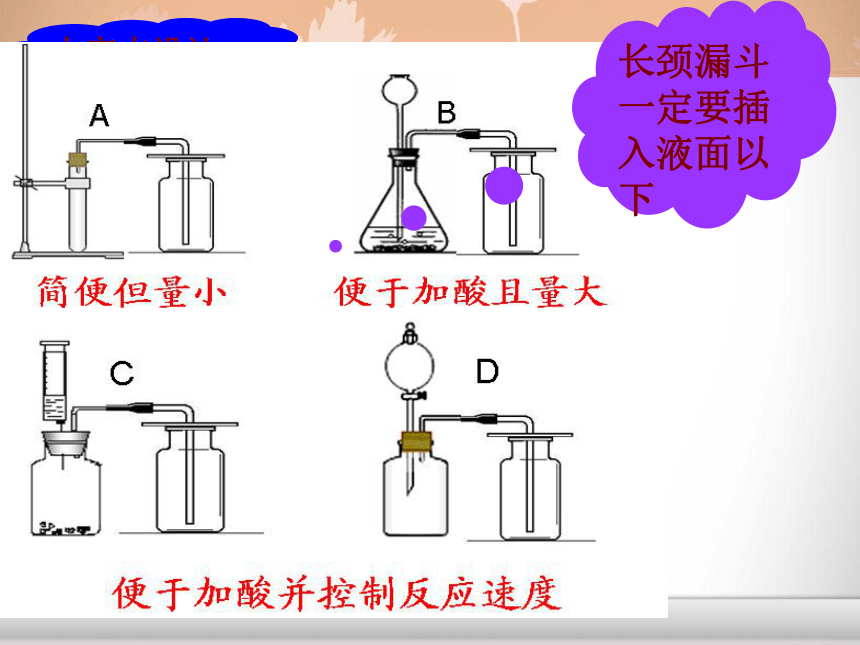
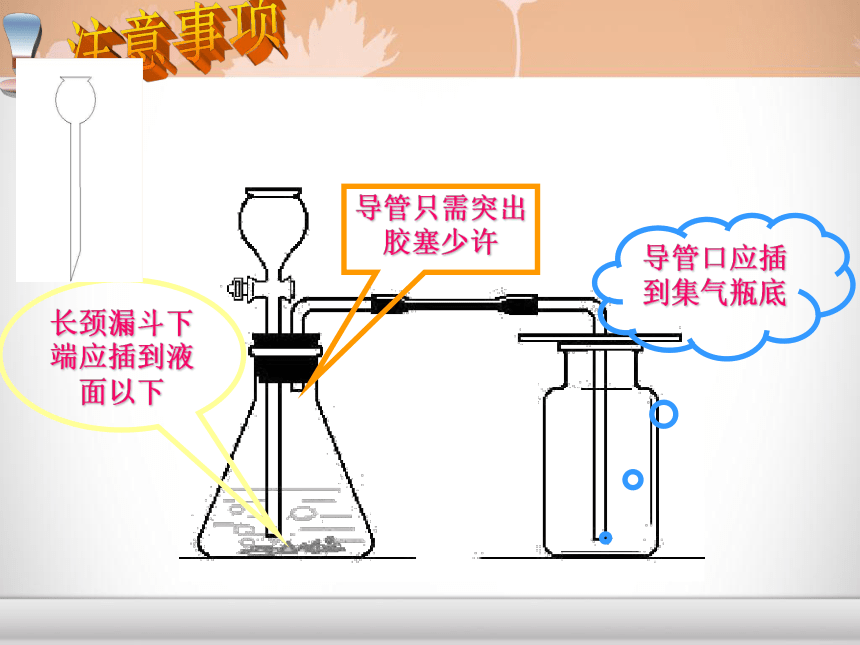
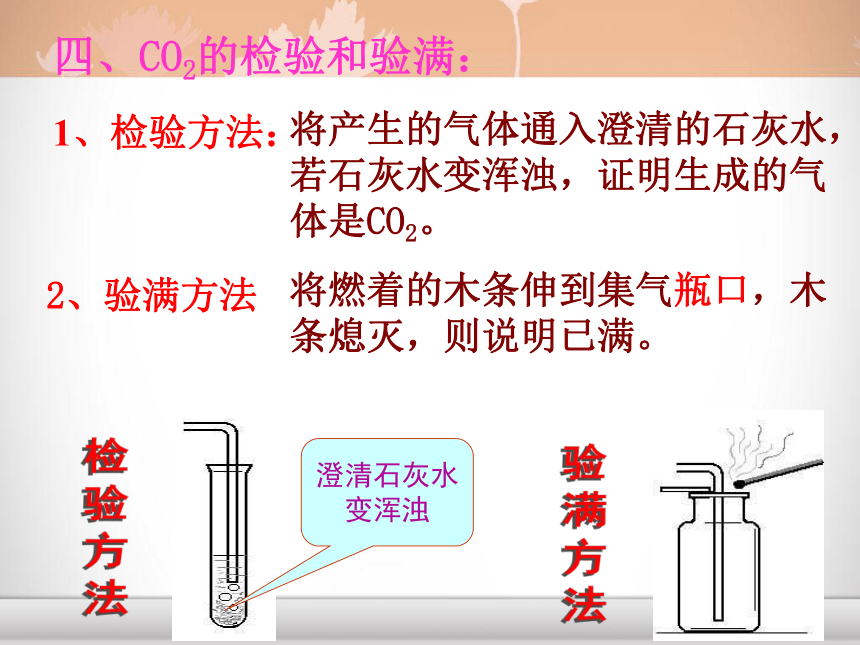
课件16张PPT。CO2给大地带来勃勃生机 二氧化碳的实验室制取和性质CO2一、实验室制取CO2的药品和反应原理:1、药品大理石(或石灰石)和稀盐酸2、反应原理:CaCO3+2HCl=CaCl2+ H2O + CO2↑ (1)、能否用浓盐酸或稀硫酸代替稀盐酸来制取二氧化碳? (2)、能否用碳酸钠代替碳酸钙来制取二氧化碳?思考?二、实验装置的确定:1、发生装置:固+液不加热型2、收集装置:向上排空气法选择以下仪器设计制取二氧化碳的装置:针筒 锥形瓶 平底烧瓶 烧杯 试管 集气瓶 长颈漏斗 导管 水槽 酒精灯 大家来设计长颈漏斗一定要插入液面以下导管只需突出胶塞少许导管口应插到集气瓶底长颈漏斗下端应插到液面以下2、验满方法:验满方法将燃着的木条伸到集气瓶口,木条熄灭,则说明已满。四、CO2的检验和验满:1、检验方法:将产生的气体通入澄清的石灰水,
若石灰水变浑浊,证明生成的气
体是CO2。澄清石灰水
变浑浊检验方法实验室制取二氧化碳的实验步骤结论:二氧化碳的密度为比空气大。
五、二氧化碳:(一)二氧化碳的物理性质:
在通常情况下,二氧化碳是无色无味气体;
在标准状况下,二氧化碳的密度比空气的大;
能溶于水。二氧化碳的固体俗称干冰。结论:(二)二氧化碳的化学性质:1、不能供给呼吸;2、既不能燃烧,也不能支持燃烧;(通常情况下)3、二氧化碳与水反应:二氧化碳与水反应原理:CO2+H2O === H2CO3H2CO3 === CO2↑ +H2O 现象:通入二氧化碳时,紫色石蕊试液变红色。 碳酸不稳定,加热易分解。当加热上述变红色的溶液,
二氧化碳气体逸出,红色又变成紫色。4、与石灰水反应:现象:澄清的石灰水变浑浊。
原理:CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙
此反应原理是用来检验
或鉴定二氧化碳气体。5、二氧化碳与还原性金属或非金属单质反应:(1)二氧化碳与镁带的反应:现象:将燃着的镁带伸进盛有二氧化碳的集气瓶
中,镁带继续燃烧,瓶壁上有黑色物质生
成,瓶底有白色固体物质出现。原理: CO2 + 2Mg == 2MgO + C点燃(2)二氧化碳与碳的反应:原理: CO2 + C == 2CO高温注:(1)燃烧不一定需要氧气参加;(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。(2)二氧化碳在特殊条件下也能支持燃烧。谢 谢 再见
若石灰水变浑浊,证明生成的气
体是CO2。澄清石灰水
变浑浊检验方法实验室制取二氧化碳的实验步骤结论:二氧化碳的密度为比空气大。
五、二氧化碳:(一)二氧化碳的物理性质:
在通常情况下,二氧化碳是无色无味气体;
在标准状况下,二氧化碳的密度比空气的大;
能溶于水。二氧化碳的固体俗称干冰。结论:(二)二氧化碳的化学性质:1、不能供给呼吸;2、既不能燃烧,也不能支持燃烧;(通常情况下)3、二氧化碳与水反应:二氧化碳与水反应原理:CO2+H2O === H2CO3H2CO3 === CO2↑ +H2O 现象:通入二氧化碳时,紫色石蕊试液变红色。 碳酸不稳定,加热易分解。当加热上述变红色的溶液,
二氧化碳气体逸出,红色又变成紫色。4、与石灰水反应:现象:澄清的石灰水变浑浊。
原理:CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙
此反应原理是用来检验
或鉴定二氧化碳气体。5、二氧化碳与还原性金属或非金属单质反应:(1)二氧化碳与镁带的反应:现象:将燃着的镁带伸进盛有二氧化碳的集气瓶
中,镁带继续燃烧,瓶壁上有黑色物质生
成,瓶底有白色固体物质出现。原理: CO2 + 2Mg == 2MgO + C点燃(2)二氧化碳与碳的反应:原理: CO2 + C == 2CO高温注:(1)燃烧不一定需要氧气参加;(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。(2)二氧化碳在特殊条件下也能支持燃烧。谢 谢 再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
