粤教版九上化学 4.3 质量守恒定律 课件(24张PPT)
文档属性
| 名称 | 粤教版九上化学 4.3 质量守恒定律 课件(24张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 709.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-27 15:00:32 | ||
图片预览







文档简介
(共24张PPT)
问:煤燃烧只剩下灰烬;天然气(液化石油气)燃烧连灰烬都没有留下;是不是反应后质量都变小呢?
活动与探究
1.提出问题 化学反应前后各物质的质量总和是否会发生变化呢?
2.猜想与假设
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
[依据:生活经验铁生锈]
[依据:化学反应是原子的重新组合]
[依据:生活经验液化石油气的燃烧]
制定计划 进行实验
实验4-7:
实验4-8:
:【实验装置】
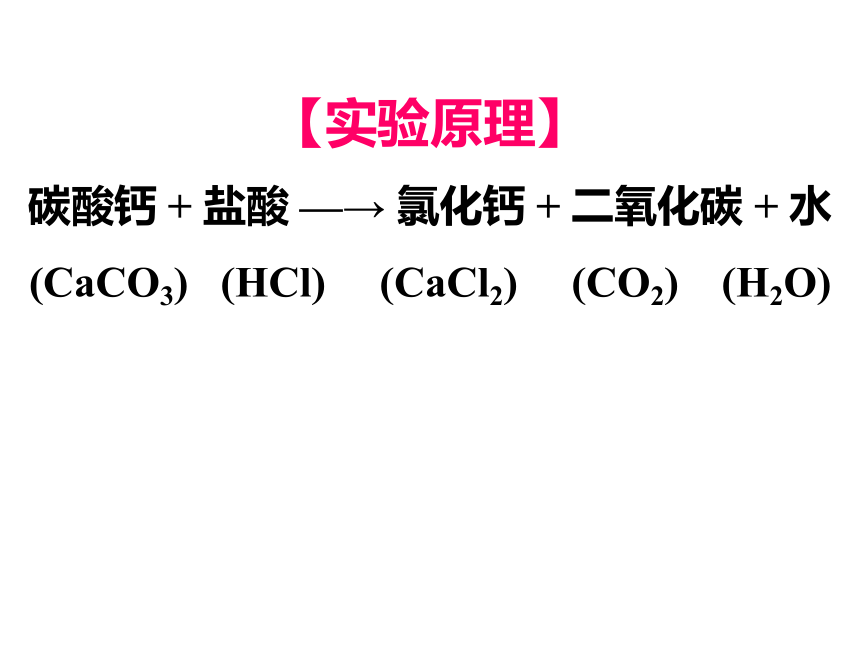
【实验原理】
碳酸钙 + 盐酸 —→ 氯化钙 + 二氧化碳 + 水
(CaCO3) (HCl) (CaCl2) (CO2) (H2O)
【发现问题】
为什么同一个反应,各物质的总质量在反应前后,前面装置中的不相等,而后面装置中的相等
【分析问题】
两个装置的区别是 ;
因此, (填“前”或“后”)面的装置中遗漏了 物质的质量没有称量到,因而天平不能达到平衡。
实验4-9:
【实验原理】
氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜
(NaOH) (CuSO4) (Na2SO4) Cu(OH)2
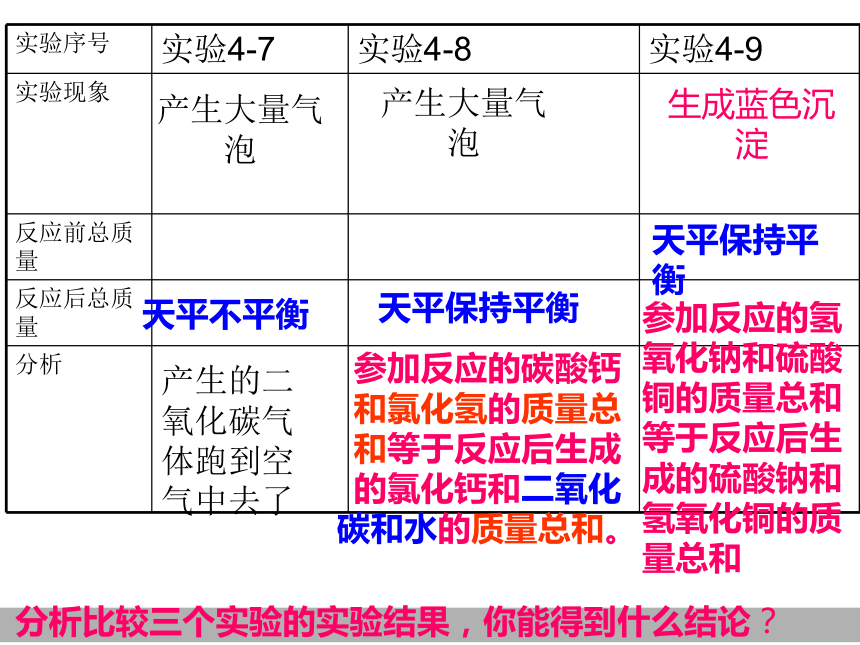
实验序号 实验4-7 实验4-8 实验4-9
实验现象
反应前总质量
反应后总质量
分析
产生大量气泡
天平不平衡
参加反应的碳酸钙和氯化氢的质量总和等于反应后生成的氯化钙和二氧化碳和水的质量总和。
天平保持平衡
分析比较三个实验的实验结果,你能得到什么结论?
产生大量气泡
生成蓝色沉淀
产生的二氧化碳气体跑到空气中去了
天平保持平衡
参加反应的氢氧化钠和硫酸铜的质量总和等于反应后生成的硫酸钠和氢氧化铜的质量总和
结论:
反应前后物质的质量总和没有发生改变
内容:在化学反应里, 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。
质量守恒定律
(1)质量守恒定律仅适用于化学反应。
概念要点:
8克水蒸发变成8克的水蒸气是否遵循质量守恒定律
(2)质量守恒定律的“守恒”,是指质量守恒,而不是体积、反应物的分子个数守恒。
1L的氢气与8L的氧气反应生成了9L的水,对吗
(3)参加化学反应的各物质的质量总和并不是各物质的任意质量之和,不参加反应的物质的质量不能计算在内。
为什么会质量守恒呢
通电
动动脑 ,想一想
4个水分子 在通电条件下,
生成 种原子,分别为: 个氢原子、、
个氧原子 ;这些原子 ,生成
个氢分子 、 个氧分子 。
2
8
4
重新组合
4
2
化学反应的实质
物质发生化学反应时,只是反应物的原子重新组合,生成新物质,反应前后原子的种类和数目都没有改变。因此,化学反应前后各物质的质量总和必定相等。
质量守恒的原因
发生化学反应时,
原子重新排列组合
质量
种类
数目
原子的
在化学反应中有五不变、两改变、两个可能改变
五不变
1、反应物、生成物质量总和不变;
2、元素种类不变
3、原子种类不变
4、原子数目不变
5. 原子质量不变
两改变
1、物质的种类
两个可能
改变
1、化学反应前后分子的数目
2、化学反应前后元素的化合价
2、分子的种类
知识反馈:
有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
1、镁带在氧气中完全燃烧后,生成物的质量比原来镁带的质量大。试用质量守恒定律解释原因。
镁+氧气 氧化镁
点燃
根据质量守恒定律,参加反
应的镁和氧气的质量之和等于生
成氧化镁的质量。所以氧化镁的
质量大于镁带的质量。
2、小明同学用10g高锰酸钾做加
热制取氧气的实验,完全反应后
称量剩余固体,质量为9.2g.符合
质量守恒定律吗?
符合。根据质量守恒定律参加
反应的高锰酸钾的质量等于生成固
体和氧气的质量总和。
质量减轻,
证明生成了0.8g氧气。
(2)铁钉生锈后质量增加了,这一反应不符合质量守恒定律,对吗?
(3)反应A+B=C+D中,已知2克A和5克B参加了反应,完全反应后,生成了4克C,则有____克D生成。
3
A + B = C + D
2 g 5g 4g
(1)试用质量守恒定律解释能否实现“点石成金”
不能。根据质量守恒定律,化学反应前后元素的种类保持不变
不对. 铁钉生锈后,生成的锈(主要成份是氧化铁) 的质量等于
参加反应的铁钉和氧气的质量之和。
(4)加热10克氯酸钾和二氧化锰的混合物,充分反应后称得残留物的质量总和为9.52克,则生成氧气的质量为——克
0.48
KClO3 KCl + O2↑
MnO2
△
KClO3
MnO2
10g
反应前
反应后
KCl
MnO2
9.52g
(5)已知石蜡是蜡烛的主要成分,由蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断
碳、氢
氧
石蜡中一定含有_______元素,可能含有___元素。
石蜡 + O2 CO2 + H2O
点燃
O C、H、O
(6) O2+2SO2=2X,X的化学式为_________
SO3
(7)潜水艇中可用过氧化钠做氧源,其化学方程式为:2Na2O2 + 2CO2 = 2Na2CO3 + X,根据质量守恒定律,您认为X的化学式为________
O2
(8) 若N2 + O2 2A,则A的化学式_____
放电
NO
O
9.6
本节课我们共同学习的内容
质量守恒定律的含义
质量守恒的原因
会用质量守恒定律解释一些问题
问:煤燃烧只剩下灰烬;天然气(液化石油气)燃烧连灰烬都没有留下;是不是反应后质量都变小呢?
活动与探究
1.提出问题 化学反应前后各物质的质量总和是否会发生变化呢?
2.猜想与假设
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
[依据:生活经验铁生锈]
[依据:化学反应是原子的重新组合]
[依据:生活经验液化石油气的燃烧]
制定计划 进行实验
实验4-7:
实验4-8:
:【实验装置】
【实验原理】
碳酸钙 + 盐酸 —→ 氯化钙 + 二氧化碳 + 水
(CaCO3) (HCl) (CaCl2) (CO2) (H2O)
【发现问题】
为什么同一个反应,各物质的总质量在反应前后,前面装置中的不相等,而后面装置中的相等
【分析问题】
两个装置的区别是 ;
因此, (填“前”或“后”)面的装置中遗漏了 物质的质量没有称量到,因而天平不能达到平衡。
实验4-9:
【实验原理】
氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜
(NaOH) (CuSO4) (Na2SO4) Cu(OH)2
实验序号 实验4-7 实验4-8 实验4-9
实验现象
反应前总质量
反应后总质量
分析
产生大量气泡
天平不平衡
参加反应的碳酸钙和氯化氢的质量总和等于反应后生成的氯化钙和二氧化碳和水的质量总和。
天平保持平衡
分析比较三个实验的实验结果,你能得到什么结论?
产生大量气泡
生成蓝色沉淀
产生的二氧化碳气体跑到空气中去了
天平保持平衡
参加反应的氢氧化钠和硫酸铜的质量总和等于反应后生成的硫酸钠和氢氧化铜的质量总和
结论:
反应前后物质的质量总和没有发生改变
内容:在化学反应里, 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。
质量守恒定律
(1)质量守恒定律仅适用于化学反应。
概念要点:
8克水蒸发变成8克的水蒸气是否遵循质量守恒定律
(2)质量守恒定律的“守恒”,是指质量守恒,而不是体积、反应物的分子个数守恒。
1L的氢气与8L的氧气反应生成了9L的水,对吗
(3)参加化学反应的各物质的质量总和并不是各物质的任意质量之和,不参加反应的物质的质量不能计算在内。
为什么会质量守恒呢
通电
动动脑 ,想一想
4个水分子 在通电条件下,
生成 种原子,分别为: 个氢原子、、
个氧原子 ;这些原子 ,生成
个氢分子 、 个氧分子 。
2
8
4
重新组合
4
2
化学反应的实质
物质发生化学反应时,只是反应物的原子重新组合,生成新物质,反应前后原子的种类和数目都没有改变。因此,化学反应前后各物质的质量总和必定相等。
质量守恒的原因
发生化学反应时,
原子重新排列组合
质量
种类
数目
原子的
在化学反应中有五不变、两改变、两个可能改变
五不变
1、反应物、生成物质量总和不变;
2、元素种类不变
3、原子种类不变
4、原子数目不变
5. 原子质量不变
两改变
1、物质的种类
两个可能
改变
1、化学反应前后分子的数目
2、化学反应前后元素的化合价
2、分子的种类
知识反馈:
有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
1、镁带在氧气中完全燃烧后,生成物的质量比原来镁带的质量大。试用质量守恒定律解释原因。
镁+氧气 氧化镁
点燃
根据质量守恒定律,参加反
应的镁和氧气的质量之和等于生
成氧化镁的质量。所以氧化镁的
质量大于镁带的质量。
2、小明同学用10g高锰酸钾做加
热制取氧气的实验,完全反应后
称量剩余固体,质量为9.2g.符合
质量守恒定律吗?
符合。根据质量守恒定律参加
反应的高锰酸钾的质量等于生成固
体和氧气的质量总和。
质量减轻,
证明生成了0.8g氧气。
(2)铁钉生锈后质量增加了,这一反应不符合质量守恒定律,对吗?
(3)反应A+B=C+D中,已知2克A和5克B参加了反应,完全反应后,生成了4克C,则有____克D生成。
3
A + B = C + D
2 g 5g 4g
(1)试用质量守恒定律解释能否实现“点石成金”
不能。根据质量守恒定律,化学反应前后元素的种类保持不变
不对. 铁钉生锈后,生成的锈(主要成份是氧化铁) 的质量等于
参加反应的铁钉和氧气的质量之和。
(4)加热10克氯酸钾和二氧化锰的混合物,充分反应后称得残留物的质量总和为9.52克,则生成氧气的质量为——克
0.48
KClO3 KCl + O2↑
MnO2
△
KClO3
MnO2
10g
反应前
反应后
KCl
MnO2
9.52g
(5)已知石蜡是蜡烛的主要成分,由蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断
碳、氢
氧
石蜡中一定含有_______元素,可能含有___元素。
石蜡 + O2 CO2 + H2O
点燃
O C、H、O
(6) O2+2SO2=2X,X的化学式为_________
SO3
(7)潜水艇中可用过氧化钠做氧源,其化学方程式为:2Na2O2 + 2CO2 = 2Na2CO3 + X,根据质量守恒定律,您认为X的化学式为________
O2
(8) 若N2 + O2 2A,则A的化学式_____
放电
NO
O
9.6
本节课我们共同学习的内容
质量守恒定律的含义
质量守恒的原因
会用质量守恒定律解释一些问题
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
