人教版九年级上册化学 第三单元 物质构成的奥秘复习 课件(29张PPT)
文档属性
| 名称 | 人教版九年级上册化学 第三单元 物质构成的奥秘复习 课件(29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 298.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-28 00:00:00 | ||
图片预览





文档简介
课件29张PPT。第九讲 物质构成的奥秘
复习目标:
1、知道分子、原子、离子等都是构成物质的微粒
2、知道分子、原子、离子(原子团)之间的区别
3、认识分子的主要性质
4、能用微粒的观点解释某些常见的现象
5、知道原子是由原子核和核外电子构成的,原子核是由质子数和中子构成的
6、知道原子可以结合成分子,同一元素的原子和离子可以相互转化
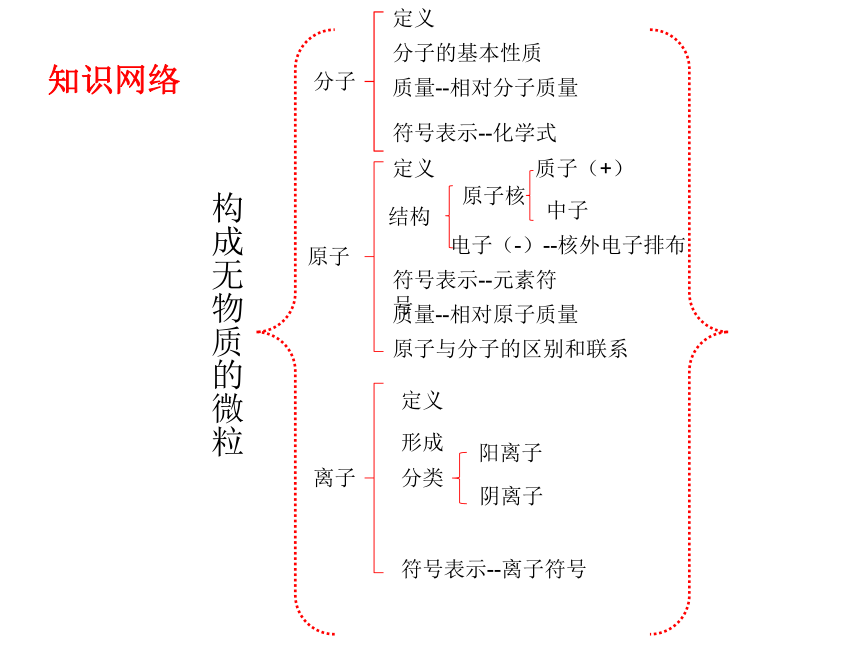
构成无物质的微粒分子定义分子的基本性质质量--相对分子质量符号表示--化学式原子定义结构原子核电子(-)--核外电子排布质子(+)中子符号表示--元素符号质量--相对原子质量原子与分子的区别和联系离子定义形成分类阳离子阴离子符号表示--离子符号知识网络一、分子:
(你还记得下列知识吗?先填填看,忘记了的在课本48-51页查找,用不同颜色的笔填上,再记忆)
(一).分子的概念: 。(并解读其含义)
(二).分子的性质:(举例说明)
。
考点解读、加深理解用分子的观点解释:
(先独立思考解答,然后同桌互查,最后讨论不能解决的问题,准备展示)
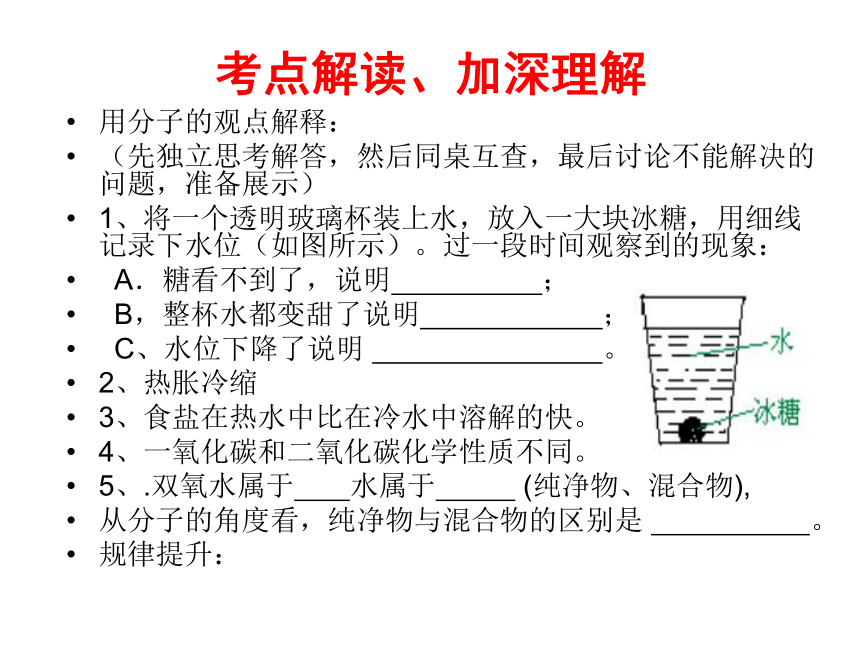
1、将一个透明玻璃杯装上水,放入一大块冰糖,用细线记录下水位(如图所示)。过一段时间观察到的现象:
A.糖看不到了,说明 ;
B,整杯水都变甜了说明 ;
C、水位下降了说明 。
2、热胀冷缩
3、食盐在热水中比在冷水中溶解的快。
4、一氧化碳和二氧化碳化学性质不同。
5、.双氧水属于 水属于 (纯净物、混合物),
从分子的角度看,纯净物与混合物的区别是 。
规律提升:构成物质的微粒——分子2、分子的性质(举例说明) (1)分子体积、质量很小(2)分子在不断运动(3)分子间有间隔温度越高,分子运动速率就越快.通常状况, 气体分子间隙>液体分子间隙>固体分子间隙
温度越高分子间隔越大。(热胀冷缩,三态变化)注意:1、同种分子化学性质相同,反之不同。(O2 O3)
2、纯净物由同种分子构成,混合物由不同种分子构成(冰水混合物、空气)
1、分子的定义: (由分子构成的物质)分子是保持物质的化学性质的最小粒子.二、原子
(一)原子的概念: (并解读其含义)
考点解读:从分子原子的角度分析水的蒸发与水的分解
两种变化的不同之处。水分解时,水分子变成了氢分子和氧分子。水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。物理变化——分子本身不发生改变;
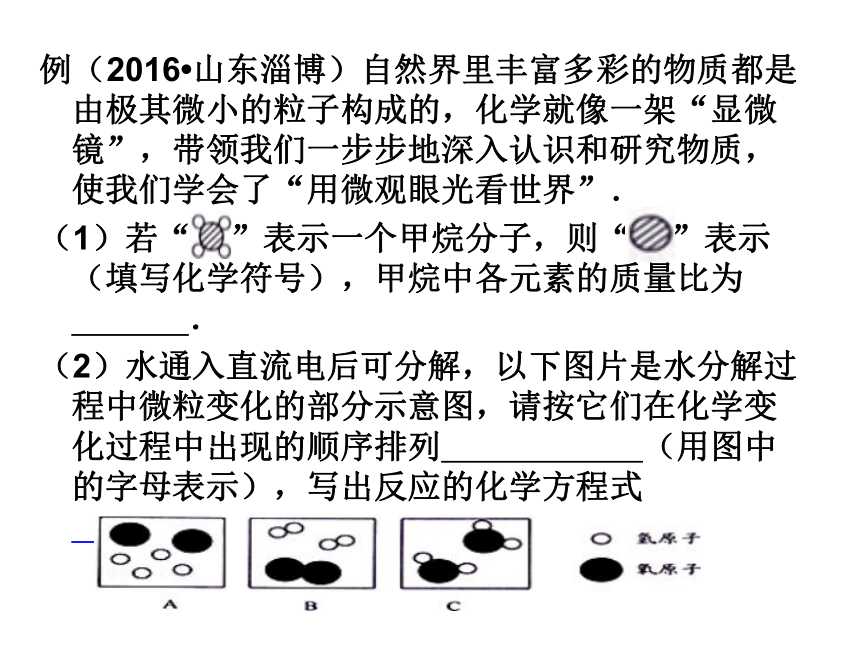
化学变化——分子本身发生改变,生成新的分子(1)分子与物质变化的关系:(2)化学变化的实质:原子的重新组合(3)分子与原子的区别:化学变化中分子可分原子不可分例(2016?山东淄博)自然界里丰富多彩的物质都是由极其微小的粒子构成的,化学就像一架“显微镜”,带领我们一步步地深入认识和研究物质,使我们学会了“用微观眼光看世界”.
(1)若“ ”表示一个甲烷分子,则“ ”表示 (填写化学符号),甲烷中各元素的质量比为 .
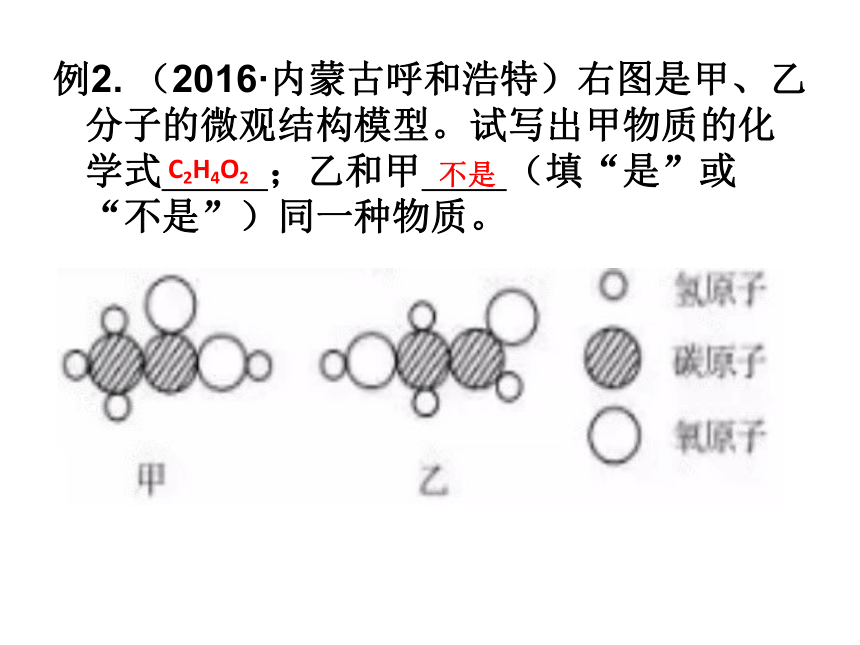
(2)水通入直流电后可分解,以下图片是水分解过程中微粒变化的部分示意图,请按它们在化学变化过程中出现的顺序排列 (用图中的字母表示),写出反应的化学方程式 .例2. (2016·内蒙古呼和浩特)右图是甲、乙分子的微观结构模型。试写出甲物质的化学式 ;乙和甲 (填“是”或“不是”)同一种物质。C2H4O2不是原子核
电子质子
中子决定原子质量(+)(-)(+)(不带电)核电荷数=质子数=原子序数=电子数 中子数 原子原子结构(二)原子的结构不一定等于数据关系:电子层该电子层上的电子数原子核核内质子数(核电荷数)Na原子结构示意图原子结构示意图:相对原子质量1.定义公式:相对原子质量(Ar)= 一个原子的实际质量
一个碳 12 原子的质量× 1
122.近似相对原子质量:相对原子质量=质子数+中子数
原子的质量与相对原子质量的比较[典例]下列有关原子的叙述,正确的是() A.原子是由不带电的粒子构成的
B.原子核都是由质子和中子构成的
C.原子里有相对很大的空间,电子在这个空间里做高速运
动
D.一个质子带一个单位正电荷,原子也带一个单位正电荷
思路点拨:原子核带正电,核外电子带负电,两者所带电
荷数相等,电性相反,对外呈电中性。注意氢原子(1H)无中子。
答案:C例2、 我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为( )
A. 115 B. 49
C. 66 D. 164B元素性质与元素最外层电子数的关系: 读图总结:
1. 决定元素的化学性质; 决定元素的分类。最外层电子数质子数例1.(2016·临沂)与元素的化学性质关系最密切的是( )
A.原子的最外层电子数
B.元素的相对原子质量
C.元素的核电荷数
D.原子的核外电子数A读上图回答下列问题:
1、离子的形成:离子是由原子 形成的,离子也是构成物质一种微粒,如氯化钠是由 构成
的。 元素易失去形成阳离子带 电 , 元素易得到电子形成阴离子带 电。
2、离子的书写:
写出下列离子符号:镁离子 铝离子 碳酸根离子 硫酸根离子 氯离子 。 三、离子3. 离子符号里的数字的意义:表示每个镁离子带2个单位的正电荷 (1)A~E共有 种元素,B所表示的元素位于元素周期表的第 周期,该元素的原子容易 (填“得到”或“失去”)电子。
(2)表示原子的粒子有 (填序号,下同);(3)表示阳离子的有 ;
(4)在化学反应中易得到电子的粒子是 。
(5)将C用符号表示出来 。四BDBNa+A B C D E二得到C考点突破·人教版构成物质的粒子——分子、原子、离子化学性质化学变化原子原子团·人教版·人教版[注意] ①分子、原子、离子都能保持由它们所构成物质的化学性质。如水分子可保持水的化学性质;铁原子可保持铁的化学性质等。
②原子在化学变化中不能再分,但在其他的条件下(如核裂变时)可以再分。
1.下列事实能够说明分子在不断运动的是( )
A.公路上大雾弥漫 B.花棚里香气扑鼻
C.湖面上柳絮飘扬 D.氧气被压缩进钢瓶B当堂检测2.所示实验不能用“分子在不停地运动”解释的是( ) A.闻到气味 B.气体混合
C.刻出划痕 D.品红溶解C3.下列各种粒子,不带电的是( )
A.原子核 B.质子
C.中子 D.电子C4.已知磷原子的核电荷数是15,相对原子质量是31,则磷原子的核内质子数是( )
A.15 B.16
C.31 D.46A5.下列粒子结构示意图中,表示阳离子的是( )D6.下列关于四种微粒结构示意图的说法正确的是( ) A.表示离子的是①
B.化学性质相似的是①③
C.③④表示的元素能形成XY2型化合物
D.④表示的元素在化合物中只能显-1价C7.钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为 ,x= 。
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。金属22350.94
复习目标:
1、知道分子、原子、离子等都是构成物质的微粒
2、知道分子、原子、离子(原子团)之间的区别
3、认识分子的主要性质
4、能用微粒的观点解释某些常见的现象
5、知道原子是由原子核和核外电子构成的,原子核是由质子数和中子构成的
6、知道原子可以结合成分子,同一元素的原子和离子可以相互转化
构成无物质的微粒分子定义分子的基本性质质量--相对分子质量符号表示--化学式原子定义结构原子核电子(-)--核外电子排布质子(+)中子符号表示--元素符号质量--相对原子质量原子与分子的区别和联系离子定义形成分类阳离子阴离子符号表示--离子符号知识网络一、分子:
(你还记得下列知识吗?先填填看,忘记了的在课本48-51页查找,用不同颜色的笔填上,再记忆)
(一).分子的概念: 。(并解读其含义)
(二).分子的性质:(举例说明)
。
考点解读、加深理解用分子的观点解释:
(先独立思考解答,然后同桌互查,最后讨论不能解决的问题,准备展示)
1、将一个透明玻璃杯装上水,放入一大块冰糖,用细线记录下水位(如图所示)。过一段时间观察到的现象:
A.糖看不到了,说明 ;
B,整杯水都变甜了说明 ;
C、水位下降了说明 。
2、热胀冷缩
3、食盐在热水中比在冷水中溶解的快。
4、一氧化碳和二氧化碳化学性质不同。
5、.双氧水属于 水属于 (纯净物、混合物),
从分子的角度看,纯净物与混合物的区别是 。
规律提升:构成物质的微粒——分子2、分子的性质(举例说明) (1)分子体积、质量很小(2)分子在不断运动(3)分子间有间隔温度越高,分子运动速率就越快.通常状况, 气体分子间隙>液体分子间隙>固体分子间隙
温度越高分子间隔越大。(热胀冷缩,三态变化)注意:1、同种分子化学性质相同,反之不同。(O2 O3)
2、纯净物由同种分子构成,混合物由不同种分子构成(冰水混合物、空气)
1、分子的定义: (由分子构成的物质)分子是保持物质的化学性质的最小粒子.二、原子
(一)原子的概念: (并解读其含义)
考点解读:从分子原子的角度分析水的蒸发与水的分解
两种变化的不同之处。水分解时,水分子变成了氢分子和氧分子。水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。物理变化——分子本身不发生改变;
化学变化——分子本身发生改变,生成新的分子(1)分子与物质变化的关系:(2)化学变化的实质:原子的重新组合(3)分子与原子的区别:化学变化中分子可分原子不可分例(2016?山东淄博)自然界里丰富多彩的物质都是由极其微小的粒子构成的,化学就像一架“显微镜”,带领我们一步步地深入认识和研究物质,使我们学会了“用微观眼光看世界”.
(1)若“ ”表示一个甲烷分子,则“ ”表示 (填写化学符号),甲烷中各元素的质量比为 .
(2)水通入直流电后可分解,以下图片是水分解过程中微粒变化的部分示意图,请按它们在化学变化过程中出现的顺序排列 (用图中的字母表示),写出反应的化学方程式 .例2. (2016·内蒙古呼和浩特)右图是甲、乙分子的微观结构模型。试写出甲物质的化学式 ;乙和甲 (填“是”或“不是”)同一种物质。C2H4O2不是原子核
电子质子
中子决定原子质量(+)(-)(+)(不带电)核电荷数=质子数=原子序数=电子数 中子数 原子原子结构(二)原子的结构不一定等于数据关系:电子层该电子层上的电子数原子核核内质子数(核电荷数)Na原子结构示意图原子结构示意图:相对原子质量1.定义公式:相对原子质量(Ar)= 一个原子的实际质量
一个碳 12 原子的质量× 1
122.近似相对原子质量:相对原子质量=质子数+中子数
原子的质量与相对原子质量的比较[典例]下列有关原子的叙述,正确的是() A.原子是由不带电的粒子构成的
B.原子核都是由质子和中子构成的
C.原子里有相对很大的空间,电子在这个空间里做高速运
动
D.一个质子带一个单位正电荷,原子也带一个单位正电荷
思路点拨:原子核带正电,核外电子带负电,两者所带电
荷数相等,电性相反,对外呈电中性。注意氢原子(1H)无中子。
答案:C例2、 我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为( )
A. 115 B. 49
C. 66 D. 164B元素性质与元素最外层电子数的关系: 读图总结:
1. 决定元素的化学性质; 决定元素的分类。最外层电子数质子数例1.(2016·临沂)与元素的化学性质关系最密切的是( )
A.原子的最外层电子数
B.元素的相对原子质量
C.元素的核电荷数
D.原子的核外电子数A读上图回答下列问题:
1、离子的形成:离子是由原子 形成的,离子也是构成物质一种微粒,如氯化钠是由 构成
的。 元素易失去形成阳离子带 电 , 元素易得到电子形成阴离子带 电。
2、离子的书写:
写出下列离子符号:镁离子 铝离子 碳酸根离子 硫酸根离子 氯离子 。 三、离子3. 离子符号里的数字的意义:表示每个镁离子带2个单位的正电荷 (1)A~E共有 种元素,B所表示的元素位于元素周期表的第 周期,该元素的原子容易 (填“得到”或“失去”)电子。
(2)表示原子的粒子有 (填序号,下同);(3)表示阳离子的有 ;
(4)在化学反应中易得到电子的粒子是 。
(5)将C用符号表示出来 。四BDBNa+A B C D E二得到C考点突破·人教版构成物质的粒子——分子、原子、离子化学性质化学变化原子原子团·人教版·人教版[注意] ①分子、原子、离子都能保持由它们所构成物质的化学性质。如水分子可保持水的化学性质;铁原子可保持铁的化学性质等。
②原子在化学变化中不能再分,但在其他的条件下(如核裂变时)可以再分。
1.下列事实能够说明分子在不断运动的是( )
A.公路上大雾弥漫 B.花棚里香气扑鼻
C.湖面上柳絮飘扬 D.氧气被压缩进钢瓶B当堂检测2.所示实验不能用“分子在不停地运动”解释的是( ) A.闻到气味 B.气体混合
C.刻出划痕 D.品红溶解C3.下列各种粒子,不带电的是( )
A.原子核 B.质子
C.中子 D.电子C4.已知磷原子的核电荷数是15,相对原子质量是31,则磷原子的核内质子数是( )
A.15 B.16
C.31 D.46A5.下列粒子结构示意图中,表示阳离子的是( )D6.下列关于四种微粒结构示意图的说法正确的是( ) A.表示离子的是①
B.化学性质相似的是①③
C.③④表示的元素能形成XY2型化合物
D.④表示的元素在化合物中只能显-1价C7.钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为 ,x= 。
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。金属22350.94
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
