人教版九年级上册化学 2.1 空气 课件(16张PPT)
文档属性
| 名称 | 人教版九年级上册化学 2.1 空气 课件(16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-29 10:24:40 | ||
图片预览




文档简介
课件16张PPT。 谜 语
一物到处有,用棒赶不走; 眼睛看不见,手摸也没有; 咀嚼无滋味,没它活不久。 (打一物质) 我们周围的空气课题1 空气 我们周围的空气拉瓦锡研究空气成分所用的装置one、法国化学家拉瓦锡的贡献拉瓦锡通过实验得出空气由氧气和氮气组成知识点一、空气是由什么组成的
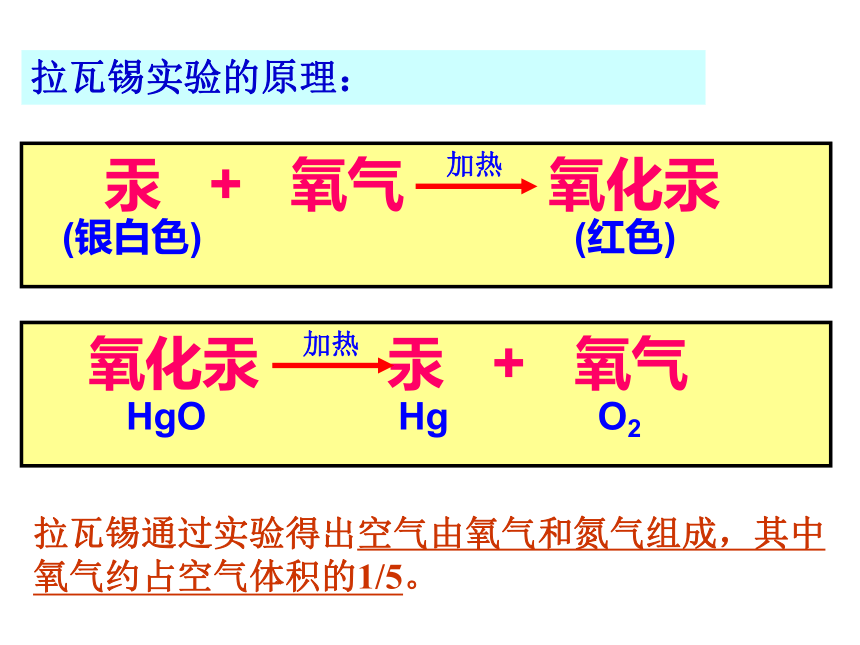
拉瓦锡实验的原理: 汞 + 氧气 氧化汞
(银白色) (红色) 加热 氧化汞 汞 + 氧气
HgO Hg O2加热拉瓦锡通过实验得出空气由氧气和氮气组成,其中氧气约占空气体积的1/5。测定空气中氧气的含量仿照这个历史上著名实验的原理,我们来测定空气里氧气的含量
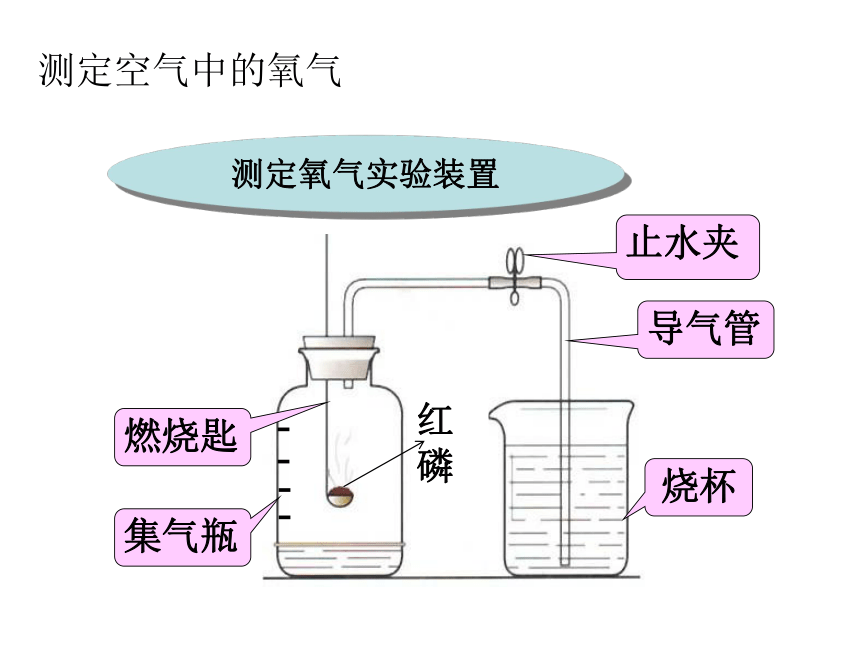
实验用品
仪器:集气瓶 燃烧匙
止水夹
和导气管 烧杯
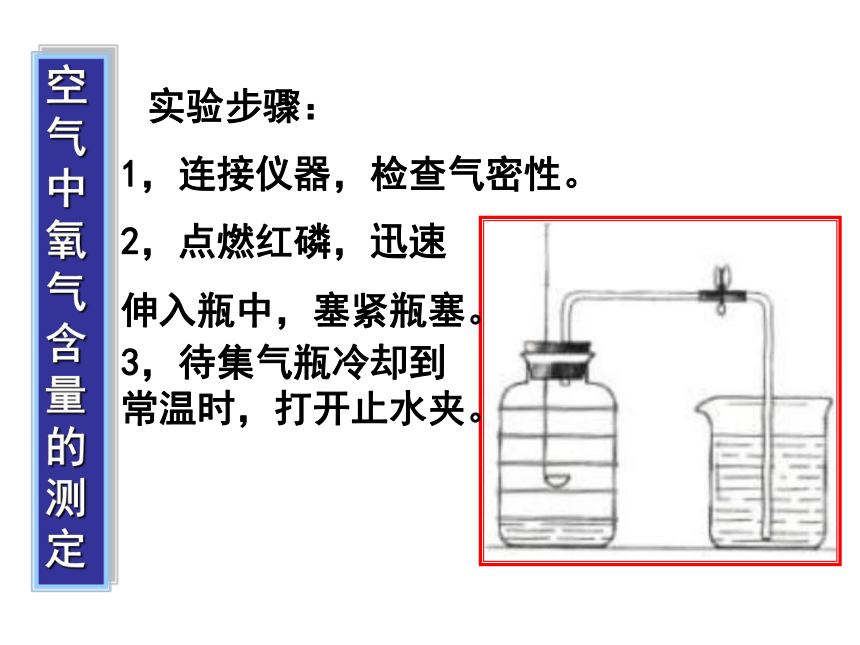
药品:红磷测定氧气实验装置集气瓶燃烧匙止水夹导气管烧杯测定空气中的氧气空气中氧气含量的测定实验步骤:1,连接仪器,检查气密性。2,点燃红磷,迅速
伸入瓶中,塞紧瓶塞。3,待集气瓶冷却到常温时,打开止水夹。two、测定空气里氧气的含量实验现象:1、红磷燃烧,发出黄色火焰,产生大量白烟;2、等到燃烧停止,冷却后,瓶内水面上升了约1/5体积 P O2 P2O5五氧化二磷点燃实验结论:氧气约占空气总体积的1/5。实验原理:红磷 + 氧气问题与思考:1、集气瓶中先加少量水的作用?
A.防止燃着的红磷溅在集气瓶上,使集气瓶炸
B.吸收生成的白烟五氧化二磷同时降温
2、为什么点燃的红磷在伸入集气瓶中要迅速?
红磷燃烧放出热量,部分空气会受热逸出(扩散),(导致进入水的体积大于1/5)。3、为什么要冷却后才打开止水夹?因为温度高时,气体体积膨胀,压强大,而使进入集气瓶内的水的体积减少,从而造成实验结果偏小
4、集气瓶内剩余气体主要成分是什么?它具有什么性质?
N2,不溶于水,不支持燃烧实验成功的关键:
(1)装置不能漏气;(2)集气瓶中加少量水(防止高温熔融物使瓶底炸裂)(3)红磷应过量(4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子(5)待红磷冷却后,打开弹簧夹想一想2.用燃烧法测定空气中氧气的含量实验中,对反应物有什么要求?答:(1)物质在空气中就能燃烧,且不与空气中的其他成分反应;(2)反应后的生成物不能是气体。1.总结实验原理。 答:利用红磷燃烧消耗密闭容器里空气中的氧气,使密闭容器内压强减小,在大气压的作用下,水进入容器。测定进入容器内水的体积,即为空气中氧气的体积。想一想
3.根据实验现象,分析瓶内剩余气体具有怎样的
性质? 答:不能燃烧,也不能支持燃烧;不能溶于水4、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗?答:不能,烟是固体微粒;雾是小液滴。5.在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?(2)装置漏气;(5)燃烧一定程度时,瓶内氧气含量小, 红磷不能继续燃烧。答:(1)红磷熄灭后未冷却到室温;(2)装置漏气;(3)红磷的量不足;(4)有部分水留在导管中未进入集气瓶(5)燃烧一定程度时,瓶内氧气含量小,
红磷不能继续燃烧。(6)点燃红磷后燃烧匙未立即伸入集气瓶中6.除教材中的实验装置外,还有哪些装置可测定空气中氧气的含量?练一练根据要求回答问题:
①在集气瓶中加少量水②检查装置的气密性③在燃烧匙中装足量红磷,夹紧止水夹④点燃红磷,伸入集气瓶中塞紧橡皮塞⑤待集气瓶冷却后打开止水夹(1)步骤④中发生反应的文字表达式为 ;
(2)步骤⑤中打开止水夹后观察到的现象为 ;
(3)该实验得出空气组成的结论是 ;
(4)该实验剩余气体的性质有 ;
(5)实验后集气瓶中水少于1/5,,误差产生的原
因可能是 ;
一物到处有,用棒赶不走; 眼睛看不见,手摸也没有; 咀嚼无滋味,没它活不久。 (打一物质) 我们周围的空气课题1 空气 我们周围的空气拉瓦锡研究空气成分所用的装置one、法国化学家拉瓦锡的贡献拉瓦锡通过实验得出空气由氧气和氮气组成知识点一、空气是由什么组成的
拉瓦锡实验的原理: 汞 + 氧气 氧化汞
(银白色) (红色) 加热 氧化汞 汞 + 氧气
HgO Hg O2加热拉瓦锡通过实验得出空气由氧气和氮气组成,其中氧气约占空气体积的1/5。测定空气中氧气的含量仿照这个历史上著名实验的原理,我们来测定空气里氧气的含量
实验用品
仪器:集气瓶 燃烧匙
止水夹
和导气管 烧杯
药品:红磷测定氧气实验装置集气瓶燃烧匙止水夹导气管烧杯测定空气中的氧气空气中氧气含量的测定实验步骤:1,连接仪器,检查气密性。2,点燃红磷,迅速
伸入瓶中,塞紧瓶塞。3,待集气瓶冷却到常温时,打开止水夹。two、测定空气里氧气的含量实验现象:1、红磷燃烧,发出黄色火焰,产生大量白烟;2、等到燃烧停止,冷却后,瓶内水面上升了约1/5体积 P O2 P2O5五氧化二磷点燃实验结论:氧气约占空气总体积的1/5。实验原理:红磷 + 氧气问题与思考:1、集气瓶中先加少量水的作用?
A.防止燃着的红磷溅在集气瓶上,使集气瓶炸
B.吸收生成的白烟五氧化二磷同时降温
2、为什么点燃的红磷在伸入集气瓶中要迅速?
红磷燃烧放出热量,部分空气会受热逸出(扩散),(导致进入水的体积大于1/5)。3、为什么要冷却后才打开止水夹?因为温度高时,气体体积膨胀,压强大,而使进入集气瓶内的水的体积减少,从而造成实验结果偏小
4、集气瓶内剩余气体主要成分是什么?它具有什么性质?
N2,不溶于水,不支持燃烧实验成功的关键:
(1)装置不能漏气;(2)集气瓶中加少量水(防止高温熔融物使瓶底炸裂)(3)红磷应过量(4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子(5)待红磷冷却后,打开弹簧夹想一想2.用燃烧法测定空气中氧气的含量实验中,对反应物有什么要求?答:(1)物质在空气中就能燃烧,且不与空气中的其他成分反应;(2)反应后的生成物不能是气体。1.总结实验原理。 答:利用红磷燃烧消耗密闭容器里空气中的氧气,使密闭容器内压强减小,在大气压的作用下,水进入容器。测定进入容器内水的体积,即为空气中氧气的体积。想一想
3.根据实验现象,分析瓶内剩余气体具有怎样的
性质? 答:不能燃烧,也不能支持燃烧;不能溶于水4、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗?答:不能,烟是固体微粒;雾是小液滴。5.在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?(2)装置漏气;(5)燃烧一定程度时,瓶内氧气含量小, 红磷不能继续燃烧。答:(1)红磷熄灭后未冷却到室温;(2)装置漏气;(3)红磷的量不足;(4)有部分水留在导管中未进入集气瓶(5)燃烧一定程度时,瓶内氧气含量小,
红磷不能继续燃烧。(6)点燃红磷后燃烧匙未立即伸入集气瓶中6.除教材中的实验装置外,还有哪些装置可测定空气中氧气的含量?练一练根据要求回答问题:
①在集气瓶中加少量水②检查装置的气密性③在燃烧匙中装足量红磷,夹紧止水夹④点燃红磷,伸入集气瓶中塞紧橡皮塞⑤待集气瓶冷却后打开止水夹(1)步骤④中发生反应的文字表达式为 ;
(2)步骤⑤中打开止水夹后观察到的现象为 ;
(3)该实验得出空气组成的结论是 ;
(4)该实验剩余气体的性质有 ;
(5)实验后集气瓶中水少于1/5,,误差产生的原
因可能是 ;
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
