人教版九年级上册化学 6.2 二氧化碳制取的研究 课件(40张PPT)
文档属性
| 名称 | 人教版九年级上册化学 6.2 二氧化碳制取的研究 课件(40张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-08-31 08:59:10 | ||
图片预览









文档简介
课件40张PPT。课题2
二氧化碳制取的研究
(共2课时)碳单质的化学性质:1、可燃性:(用作燃料)2、还原性:(用作冶炼金属)实验室制取氧气(O2):1、加热氯酸钾与二氧化锰混合物:2、加热紫高锰酸钾粉末:3、用过氧化氢溶液与二氧化锰混合制取氧气: 1、了解实验室制取二氧化碳的反应原理,探究实验室中制取二氧化碳的装置。
2、了解实验室中制取气体的思路和方法。学习目标1、二氧化碳的性质信息:(从生活经验和已有事实推测)
(1)把燃烧的木条放入二氧化碳中,木条熄灭,说明 。
(2)打开汽水瓶盖可观察到 ,
这个事实说明二氧化碳在水里的溶解性为:
,且二氧化碳能与水反应。自主学习CO2不燃烧,也不支持燃烧瓶口冒出大量气泡CO2能溶于水(3)向石灰水中吹气,现象是 ,
利用这一性质可以检验CO2。
(4)在标准状况下,二氧化碳的密度为1.977 g / L
空气密度为1.293 g / L。说明二氧化碳的密度比
空气的密度 。
(5)由(2)和(4)可知,用 法收集
二氧化碳气体;由(1)可知验满方法为:
。澄清石灰水变浑浊大向上排空气用燃着木条放于瓶口,木条熄灭氧气和二氧化碳的实验室制取比较:液 + 固催化剂、常温固加热固 + 固催化剂、加热氧气和二氧化碳的相关性质比较:密度比空气略大 不易溶于水,
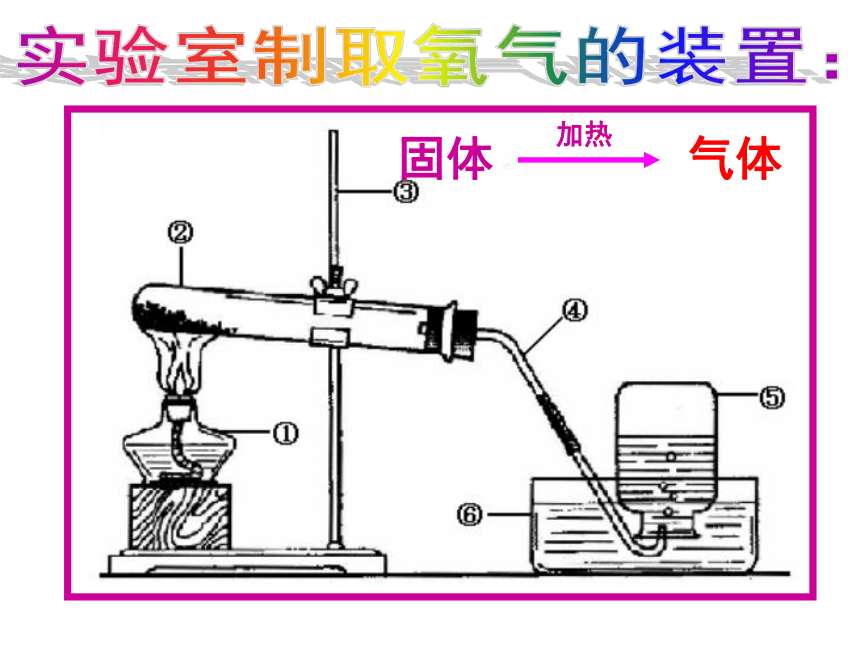
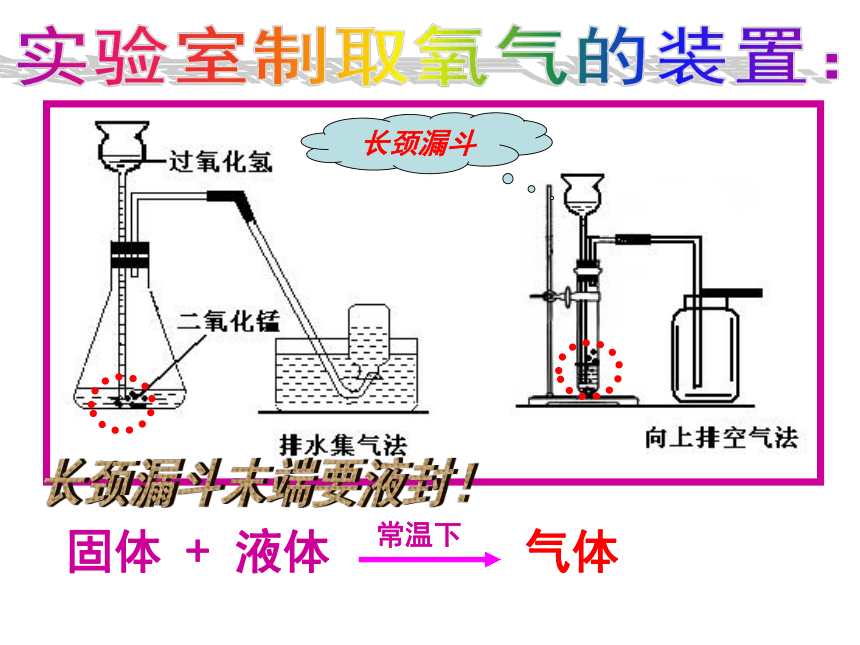
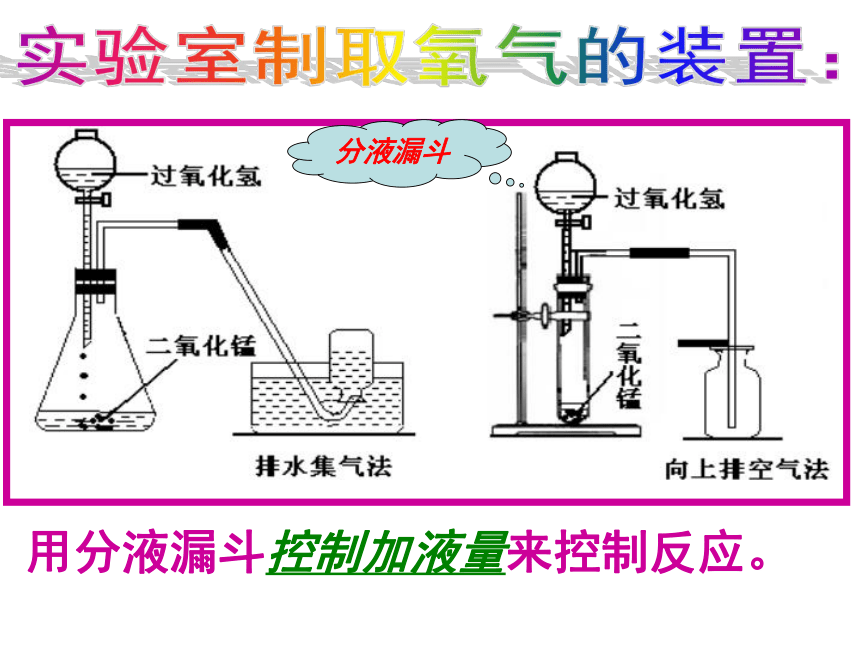
不与水反应实验室制取氧气的装置:实验室制取氧气的装置:长颈漏斗长颈漏斗末端要液封!实验室制取氧气的装置:用分液漏斗控制加液量来控制反应。分液漏斗 实验室里制取气体装置的确定依据: ①实验室制取二氧化碳的理想原料(原理)②实验室制取二氧化碳的装置(发生+收集)合作探究:探究:实验室制取二氧化碳的反应原理 大理石(或石灰石) + 稀盐酸大理石石灰石稀
盐
酸主要成分HCl主要成分CaCO3HCl气体溶于水——盐酸(混合物)实验室制取二氧化碳总的化学方程式:
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
(固体) + (液体) (氯化钙)H2CO3 === H2O + CO2↑(碳酸)注意——“三不”:
1、不能用浓盐酸;
2、不能用稀硫酸;
3、不能用Na2CO3或粉末状CaCO3。你知道吗? 因为浓盐酸易挥发出HCl气体,使制得的二氧化碳不纯.你知道吗?不能用稀硫酸代替盐酸。
(原因:因为稀硫酸与碳酸钙反应,生成微溶于水的硫酸钙,覆盖在石灰石的表面上,阻碍了反应的进一步发生。)CaCO3 + H2SO4 == CaSO4 + H2O + CO2↑
(微溶)你知道吗?不能.因为反应太快难于控制.写出下列反应的化学方程式1、实验室制取氧气的三种方法:2、实验室制取二氧化碳:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑氧气和二氧化碳的实验室制取比较:液 + 固催化剂、常温固加热固 + 固催化剂、加热液 + 固常温氧气和二氧化碳的相关性质比较:密度比空气略大密度比空气大 不易溶于水,
不与水反应能溶于水,
能与水反应二氧化碳气体收集:
【CO2能溶于水,且密度比空气大】
——向上排空气法。
【注意:相对分子质量>29,比空气重。】 收集时导气管应伸入到集气瓶底部,便于排净空气,
收集较纯净的气体。答:不能。
因为CO2气体能溶于水,且密度比空气大.CO2 + H2O == H2CO3(碳酸)
H2CO3 == H2O + CO2↑(碳酸不稳定)实验室制取二氧化碳:注意——“三不”:
1、不能用浓盐酸;(收集气体不纯)
2、不能用稀硫酸;(反应会中断)
3、不能用Na2CO3或粉末状CaCO3。(反应过快)药品:大理石(石灰石)、稀盐酸原理(反应方程式):
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
(固体) + (液体) 探究:利用下列仪器设计制取CO2的装置缺点: 不便于控制加酸量,不能控制反应的发生和停止.单孔橡皮塞优点: 便于控制加酸量,可用于大量、多次制取气体.双孔橡皮塞 制取二氧化碳气体发生装置的选择:固体 + 液体 → 气体,不需加热。最佳装置所需仪器(5种):
锥形瓶(广口瓶)、长颈漏斗、
双孔橡皮塞、导气管、集气瓶。 因所需反应物的量较大,故应选用容量大的反应容器(锥形瓶或广口瓶)。实验室制取二氧化碳常用装置温馨提醒:
①长颈漏斗末端管口应浸没在液面以下.——防止气体从长颈漏斗中逸出;
②收集气体的玻璃导管应伸到集气瓶底部.——便于把集气瓶中空气排出.实验室制取二氧化碳操作步骤:
① 按实验要求装配好仪器;
② 检查装置的气密性;
③ 向锥形瓶中放入大理石;
④ 向长颈漏斗中注入稀盐酸;
⑤ 用向上排空气法收集气体。实验室制取二氧化碳装置P115讨论 二氧化碳的检验方法
1. 检验(验是)方法:
把气体通入澄清的石灰水里,石灰水变浑浊,证明生成的气体是二氧化碳。(利用了CO2与石灰水反应生成白色不溶物CaCO3的性质)
Ca(OH)2 + CO2 === CaCO3↓+ H2O
(白色)
2. 验满方法:
用燃着的木条放在集气瓶瓶口,火焰熄灭,
证明瓶里已充满了二氧化碳。(利用CO2不能燃烧也不支持燃烧且密度比空气大的性质)指出下列实验室制取二氧化碳装置的错误并改正:①长颈漏斗末端管口未伸入液面以下;
改为:伸入到液面以下。
②导气管伸入锥形瓶内太长;
改为:缩短至刚露出胶塞少许。③收集气体方法错误;改为:向上排空气法收集。★ 总结 ★
实验室里制取气体的设计思路与方法:
① 反应原理(即:反应方程式);
② 设计实验装置(发生装置 + 收集装置);
③ 验证(检验、验满). 二氧化碳(CO2)的工业制法——
高温煅烧石灰石(生石灰)CaO + H2O ==== Ca(OH)2(生石灰) (熟石灰)Ca(OH)2溶液——石灰水写出下列反应的化学方程式:1、实验室用大理石与稀盐酸反应制取CO2:2、高温煅烧石灰石:3、CO2气体通入澄清石灰水中:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑CO2 + Ca(OH)2 === CaCO3↓ + H2O 《石灰吟》
【宋】于谦这首诗是于谦十七岁时所写。通过对石灰制作过程的拟人化描绘,表达了他不怕艰险、勇于牺牲的大无畏精神和为人清白正直的崇高志向。① 千锤万击出深山,
② 烈火焚烧若等闲;
③ 碎骨粉身全不怕,
④ 要留清白在人间。 石灰吟
【宋】于谦(化学版)① 石灰石出自深山——(物理变化)③ CaO + H2O == Ca(OH)2 ④ CO2 + Ca(OH)2 == CaCO3↓+ H2O本课题小结1、实验室里可用大理石(或石灰石)与稀盐酸反应来制取二氧化碳;
2、实验室里制取二氧化碳的装置和检验二氧化碳的方法;
3、实验室里制取气体的一般思路和方法:
(1)选择适当的反应,包括反应物和反应条件;
(2)选择合适的实验装置;
(3)验证所制得的气体。
二氧化碳制取的研究
(共2课时)碳单质的化学性质:1、可燃性:(用作燃料)2、还原性:(用作冶炼金属)实验室制取氧气(O2):1、加热氯酸钾与二氧化锰混合物:2、加热紫高锰酸钾粉末:3、用过氧化氢溶液与二氧化锰混合制取氧气: 1、了解实验室制取二氧化碳的反应原理,探究实验室中制取二氧化碳的装置。
2、了解实验室中制取气体的思路和方法。学习目标1、二氧化碳的性质信息:(从生活经验和已有事实推测)
(1)把燃烧的木条放入二氧化碳中,木条熄灭,说明 。
(2)打开汽水瓶盖可观察到 ,
这个事实说明二氧化碳在水里的溶解性为:
,且二氧化碳能与水反应。自主学习CO2不燃烧,也不支持燃烧瓶口冒出大量气泡CO2能溶于水(3)向石灰水中吹气,现象是 ,
利用这一性质可以检验CO2。
(4)在标准状况下,二氧化碳的密度为1.977 g / L
空气密度为1.293 g / L。说明二氧化碳的密度比
空气的密度 。
(5)由(2)和(4)可知,用 法收集
二氧化碳气体;由(1)可知验满方法为:
。澄清石灰水变浑浊大向上排空气用燃着木条放于瓶口,木条熄灭氧气和二氧化碳的实验室制取比较:液 + 固催化剂、常温固加热固 + 固催化剂、加热氧气和二氧化碳的相关性质比较:密度比空气略大 不易溶于水,
不与水反应实验室制取氧气的装置:实验室制取氧气的装置:长颈漏斗长颈漏斗末端要液封!实验室制取氧气的装置:用分液漏斗控制加液量来控制反应。分液漏斗 实验室里制取气体装置的确定依据: ①实验室制取二氧化碳的理想原料(原理)②实验室制取二氧化碳的装置(发生+收集)合作探究:探究:实验室制取二氧化碳的反应原理 大理石(或石灰石) + 稀盐酸大理石石灰石稀
盐
酸主要成分HCl主要成分CaCO3HCl气体溶于水——盐酸(混合物)实验室制取二氧化碳总的化学方程式:
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
(固体) + (液体) (氯化钙)H2CO3 === H2O + CO2↑(碳酸)注意——“三不”:
1、不能用浓盐酸;
2、不能用稀硫酸;
3、不能用Na2CO3或粉末状CaCO3。你知道吗? 因为浓盐酸易挥发出HCl气体,使制得的二氧化碳不纯.你知道吗?不能用稀硫酸代替盐酸。
(原因:因为稀硫酸与碳酸钙反应,生成微溶于水的硫酸钙,覆盖在石灰石的表面上,阻碍了反应的进一步发生。)CaCO3 + H2SO4 == CaSO4 + H2O + CO2↑
(微溶)你知道吗?不能.因为反应太快难于控制.写出下列反应的化学方程式1、实验室制取氧气的三种方法:2、实验室制取二氧化碳:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑氧气和二氧化碳的实验室制取比较:液 + 固催化剂、常温固加热固 + 固催化剂、加热液 + 固常温氧气和二氧化碳的相关性质比较:密度比空气略大密度比空气大 不易溶于水,
不与水反应能溶于水,
能与水反应二氧化碳气体收集:
【CO2能溶于水,且密度比空气大】
——向上排空气法。
【注意:相对分子质量>29,比空气重。】 收集时导气管应伸入到集气瓶底部,便于排净空气,
收集较纯净的气体。答:不能。
因为CO2气体能溶于水,且密度比空气大.CO2 + H2O == H2CO3(碳酸)
H2CO3 == H2O + CO2↑(碳酸不稳定)实验室制取二氧化碳:注意——“三不”:
1、不能用浓盐酸;(收集气体不纯)
2、不能用稀硫酸;(反应会中断)
3、不能用Na2CO3或粉末状CaCO3。(反应过快)药品:大理石(石灰石)、稀盐酸原理(反应方程式):
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
(固体) + (液体) 探究:利用下列仪器设计制取CO2的装置缺点: 不便于控制加酸量,不能控制反应的发生和停止.单孔橡皮塞优点: 便于控制加酸量,可用于大量、多次制取气体.双孔橡皮塞 制取二氧化碳气体发生装置的选择:固体 + 液体 → 气体,不需加热。最佳装置所需仪器(5种):
锥形瓶(广口瓶)、长颈漏斗、
双孔橡皮塞、导气管、集气瓶。 因所需反应物的量较大,故应选用容量大的反应容器(锥形瓶或广口瓶)。实验室制取二氧化碳常用装置温馨提醒:
①长颈漏斗末端管口应浸没在液面以下.——防止气体从长颈漏斗中逸出;
②收集气体的玻璃导管应伸到集气瓶底部.——便于把集气瓶中空气排出.实验室制取二氧化碳操作步骤:
① 按实验要求装配好仪器;
② 检查装置的气密性;
③ 向锥形瓶中放入大理石;
④ 向长颈漏斗中注入稀盐酸;
⑤ 用向上排空气法收集气体。实验室制取二氧化碳装置P115讨论 二氧化碳的检验方法
1. 检验(验是)方法:
把气体通入澄清的石灰水里,石灰水变浑浊,证明生成的气体是二氧化碳。(利用了CO2与石灰水反应生成白色不溶物CaCO3的性质)
Ca(OH)2 + CO2 === CaCO3↓+ H2O
(白色)
2. 验满方法:
用燃着的木条放在集气瓶瓶口,火焰熄灭,
证明瓶里已充满了二氧化碳。(利用CO2不能燃烧也不支持燃烧且密度比空气大的性质)指出下列实验室制取二氧化碳装置的错误并改正:①长颈漏斗末端管口未伸入液面以下;
改为:伸入到液面以下。
②导气管伸入锥形瓶内太长;
改为:缩短至刚露出胶塞少许。③收集气体方法错误;改为:向上排空气法收集。★ 总结 ★
实验室里制取气体的设计思路与方法:
① 反应原理(即:反应方程式);
② 设计实验装置(发生装置 + 收集装置);
③ 验证(检验、验满). 二氧化碳(CO2)的工业制法——
高温煅烧石灰石(生石灰)CaO + H2O ==== Ca(OH)2(生石灰) (熟石灰)Ca(OH)2溶液——石灰水写出下列反应的化学方程式:1、实验室用大理石与稀盐酸反应制取CO2:2、高温煅烧石灰石:3、CO2气体通入澄清石灰水中:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑CO2 + Ca(OH)2 === CaCO3↓ + H2O 《石灰吟》
【宋】于谦这首诗是于谦十七岁时所写。通过对石灰制作过程的拟人化描绘,表达了他不怕艰险、勇于牺牲的大无畏精神和为人清白正直的崇高志向。① 千锤万击出深山,
② 烈火焚烧若等闲;
③ 碎骨粉身全不怕,
④ 要留清白在人间。 石灰吟
【宋】于谦(化学版)① 石灰石出自深山——(物理变化)③ CaO + H2O == Ca(OH)2 ④ CO2 + Ca(OH)2 == CaCO3↓+ H2O本课题小结1、实验室里可用大理石(或石灰石)与稀盐酸反应来制取二氧化碳;
2、实验室里制取二氧化碳的装置和检验二氧化碳的方法;
3、实验室里制取气体的一般思路和方法:
(1)选择适当的反应,包括反应物和反应条件;
(2)选择合适的实验装置;
(3)验证所制得的气体。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
