第五单元 化学方程式:有关化学计算专题复习(16张PPT)
文档属性
| 名称 | 第五单元 化学方程式:有关化学计算专题复习(16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-02 10:02:26 | ||
图片预览






文档简介
(共16张PPT)
有关化学计算专题复习
吴铺中学 程君
自主探学、尝试解决
尝试计算:Ca-40 C-12 O-16
(1)碳酸钙有几种元素组成( )
(2)一个碳酸钙分子中有( )钙原子( )碳原子( )氧原子
(3)碳酸钙的相对分子质量是———
(4)碳酸钙中钙元素、碳元素、氧元素的质量比为———
(5)碳酸钙中钙元素的质量分数为———
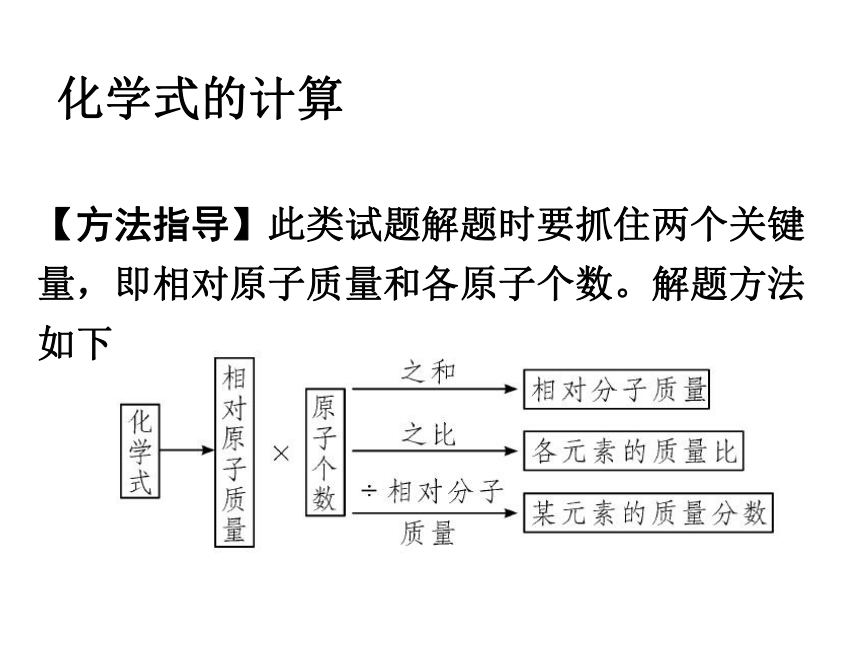
化学式的计算
【方法指导】此类试题解题时要抓住两个关键量,即相对原子质量和各原子个数。解题方法如下:
化学兴趣小组的同学们计划在实验室制取CO2,若要制取4.4克CO2,则需计算出CaCO3的需要量。研究小组成员小佳的计算如下:
解:设需CaCO3 x g ,
CaCO3 + HCl CaCl2 + H2O + CO2
100 44
xg 4.4g
x=10 (g)
活动现场一
解:设需要CaCO3 的质量为x
CaCO3 + 2HCl CaCl2 + H2O + CO2 ↑
44
X 4.4g
100 X
44 4.4g
X=10g
答:需要碳酸钙的质量为10g。
回顾与交流
根据化学方程式计算应该注意的问题
(1)正确书写化学方程式。
(2)解题的过程要完整规范。
(3)找到的已知量必须是纯净物的质量。
注:常用换算公式
纯净物质量=不纯物质量×物质的质量分数
纯净物质量=纯净物的体积×密度
取石灰石10g
却只产生3.3g CO2
这是为什么呢?
加入足量
稀盐酸
(充分反应且气体全部逸出)
从刚才的计算得知,要得到4.4gCO2,必须有10gCaCO3参加反应
活动现场二
请通过计算说明原因
那么,你知道研究小组的同学们是怎么测出产生CO2的质量的吗?
你会设计实验方案吗?
活动现场三
阿基米德将国王的皇冠轻轻地放入盛满水的容器里,仔细测量出溢出水的体积,也就是皇冠的体积 ……
若用石灰石与稀盐酸反应得到3.3L二氧化碳,求:参加反应的石灰石质量是多少(前已算出石灰石的纯度是75%)?
CO2密度以2.0g/L计
3.3L
10g水垢
过量的稀盐酸200 g 烧杯:50g
时间/min 0 1 2 3 4 5
天平示数/g 260 258.5 257 256.7 x 256.7
(1)3分钟后,水垢中的CaCO3是否反应完全?
(2)帮助研究小组成员完成水垢中CaCO3质量分数的计算。
解题过程中你感觉最关键的,会成为难点的步骤是哪一步?
教师寄语:
计算解题 做到四要
㈠、看题要耐心;
㈡、做题要细心;
㈢、解题要思路;
㈣、答题要规范。
你清楚了吗?
10克75%的石灰石
高温煅烧
m(CO2)=?
m(CO2)=3.3g
+足量
已知:
CaCO3 高温CaO + CO2↑
高温煅烧
m(CO2)=?
m(CO2)=?
+足量
10克75%的石灰石
3.3g
3.3g
why?
有关化学计算专题复习
吴铺中学 程君
自主探学、尝试解决
尝试计算:Ca-40 C-12 O-16
(1)碳酸钙有几种元素组成( )
(2)一个碳酸钙分子中有( )钙原子( )碳原子( )氧原子
(3)碳酸钙的相对分子质量是———
(4)碳酸钙中钙元素、碳元素、氧元素的质量比为———
(5)碳酸钙中钙元素的质量分数为———
化学式的计算
【方法指导】此类试题解题时要抓住两个关键量,即相对原子质量和各原子个数。解题方法如下:
化学兴趣小组的同学们计划在实验室制取CO2,若要制取4.4克CO2,则需计算出CaCO3的需要量。研究小组成员小佳的计算如下:
解:设需CaCO3 x g ,
CaCO3 + HCl CaCl2 + H2O + CO2
100 44
xg 4.4g
x=10 (g)
活动现场一
解:设需要CaCO3 的质量为x
CaCO3 + 2HCl CaCl2 + H2O + CO2 ↑
44
X 4.4g
100 X
44 4.4g
X=10g
答:需要碳酸钙的质量为10g。
回顾与交流
根据化学方程式计算应该注意的问题
(1)正确书写化学方程式。
(2)解题的过程要完整规范。
(3)找到的已知量必须是纯净物的质量。
注:常用换算公式
纯净物质量=不纯物质量×物质的质量分数
纯净物质量=纯净物的体积×密度
取石灰石10g
却只产生3.3g CO2
这是为什么呢?
加入足量
稀盐酸
(充分反应且气体全部逸出)
从刚才的计算得知,要得到4.4gCO2,必须有10gCaCO3参加反应
活动现场二
请通过计算说明原因
那么,你知道研究小组的同学们是怎么测出产生CO2的质量的吗?
你会设计实验方案吗?
活动现场三
阿基米德将国王的皇冠轻轻地放入盛满水的容器里,仔细测量出溢出水的体积,也就是皇冠的体积 ……
若用石灰石与稀盐酸反应得到3.3L二氧化碳,求:参加反应的石灰石质量是多少(前已算出石灰石的纯度是75%)?
CO2密度以2.0g/L计
3.3L
10g水垢
过量的稀盐酸200 g 烧杯:50g
时间/min 0 1 2 3 4 5
天平示数/g 260 258.5 257 256.7 x 256.7
(1)3分钟后,水垢中的CaCO3是否反应完全?
(2)帮助研究小组成员完成水垢中CaCO3质量分数的计算。
解题过程中你感觉最关键的,会成为难点的步骤是哪一步?
教师寄语:
计算解题 做到四要
㈠、看题要耐心;
㈡、做题要细心;
㈢、解题要思路;
㈣、答题要规范。
你清楚了吗?
10克75%的石灰石
高温煅烧
m(CO2)=?
m(CO2)=3.3g
+足量
已知:
CaCO3 高温CaO + CO2↑
高温煅烧
m(CO2)=?
m(CO2)=?
+足量
10克75%的石灰石
3.3g
3.3g
why?
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
