第1章 微项目 探秘膨松剂 课件(共29张PPT)
文档属性
| 名称 | 第1章 微项目 探秘膨松剂 课件(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-04 00:00:00 | ||
图片预览








文档简介
课件29张PPT。※微项目※
探秘膨松剂
——体会研究物质性质的方法和程序的实用价值知识铺垫新知预习1.联想回忆钠的化合物的知识,写出有关NaHCO3用途的下列化学方程式。
2.例举生活中使用过的食品添加剂
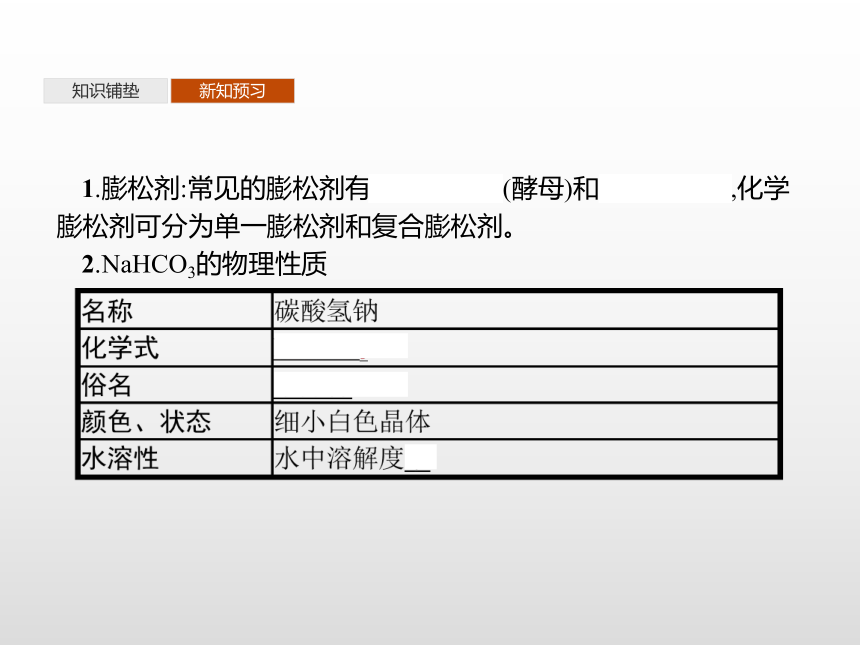
碳酸氢钠、苯甲酸钠、谷氨酸钠(味精)、酱油等知识铺垫新知预习1.膨松剂:常见的膨松剂有生物膨松剂(酵母)和化学膨松剂,化学膨松剂可分为单一膨松剂和复合膨松剂。
2.NaHCO3的物理性质知识铺垫新知预习3.NaHCO3的化学性质
写出上述序号①②③④所表示反应的化学方程式:【微思考】化学膨松剂为什么可以使食品变得松软或酥脆?
提示:化学膨松剂中通常含有碳酸氢钠,碳酸氢钠在受热条件下分解产生二氧化碳气体,从而可使食品变膨松。探究随堂检测NaHCO3作为膨松剂的作用原理
问题探究
1.碳酸氢钠可能具有什么性质?
提示:碳酸氢钠属于盐,加热会分解,能与酸反应。
2.如果面团没有发酵,能否利用加入碳酸钠的方法使其膨松?
提示:碳酸钠受热一般不分解,与酸反应比较缓慢。所以不能加入碳酸钠使面团发酵。探究随堂检测知识归纳
1.碳酸氢钠的重要性质和应用探究随堂检测2.探究碳酸氢钠的性质:实验方案设计及实施 碳酸氢钠作膨松剂的原理是受热分解产生二氧化碳,使食物膨松。探究随堂检测3.设计并使用复合膨松剂 探究随堂检测方法提炼物质性质实验的一般思路 探究随堂检测典例剖析
例题某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。探究随堂检测(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是 。?
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为? 。?
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 (填化学式)。?
答案:(1)Na2CO3和NaHCO3均可以与盐酸反应产生CO2,CO2使澄清石灰水变浑浊,故达不到实验目的探究随堂检测解析:(1)NaHCO3、Na2CO3都可以与盐酸反应放出CO2,故不能达到目的。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠不稳定。探究随堂检测对点训练1Na2CO3和NaHCO3是常见的两种钠盐,它们广泛应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是( )
A.小苏打能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人
B.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头
C.可以用加热法来鉴别Na2CO3溶液和NaHCO3溶液
D.Na2CO3和NaHCO3都与盐酸反应产生二氧化碳
答案:C探究随堂检测解析:小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为NaHCO3+HCl === NaCl+H2O+CO2↑,胃溃疡病人不能服用小苏打类药物来治疗,因为反应产生的二氧化碳气体会造成胃部胀气,易造成胃穿孔,A项正确;NaHCO3与酸反应生成二氧化碳气体,使得馒头或面包松软多孔,B项正确;Na2CO3和NaHCO3固体可用加热法鉴别,但加热溶液不能鉴别,C项错误;Na2CO3和NaHCO3都是碳酸盐,都能与盐酸反应产生二氧化碳,D项正确。探究随堂检测对点训练2我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
Ⅰ.原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 。?
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出探究随堂检测Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。探究随堂检测回答下列有关问题:
①乙装置中的试剂是 ;?
②丁装置中稀硫酸的作用是 ;?
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。?
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从 管通入 气体,再从 管通入 气体。?
②有同学建议在戊装置的b导管下端连接己装置,理由是 。?
(3)请再写出一种实验室制取少量碳酸氢钠的方法: 。?探究随堂检测答案:Ⅰ.c Ⅱ.(1)①饱和碳酸氢钠溶液 ②吸收未反应的NH3 ③过滤
(2)①a NH3 b CO2 ②增大CO2气体与溶液接触的面积,提高CO2在溶液中的吸收率 (3)往烧碱溶液中通入过量CO2(或往饱和Na2CO3溶液中通入过量CO2等)探究随堂检测解析:Ⅱ.(1)甲装置是CO2的发生装置,由于盐酸易挥发,故生成的CO2气体中会含有HCl气体,乙装置的作用是除去CO2中的HCl气体,所以乙装置中的试剂是饱和碳酸氢钠溶液,丙是制备碳酸氢钠的装置,丁的作用是吸收多余的NH3,防止其污染环境。从溶液中分离出NaHCO3晶体的方法是过滤。(2)实验时必须制取含氨的饱和NaCl溶液,然后通入CO2进行反应。因为NH3极易溶于水,CO2在水中的溶解度不大,故应先从a导管通入NH3,后从b导管通入CO2。己装置中有多孔球泡,能增大CO2气体与溶液的接触面积,从而提高CO2在溶液中的吸收率。
(3)此题是开放性试题,制备少量碳酸氢钠的方法:①用碳酸氢铵与适量的饱和食盐水反应;②往烧碱溶液中通入过量CO2;③往饱和Na2CO3溶液中通入过量CO2等。探究随堂检测1.下图是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察下图所示实验装置,分析实验原理,并判断下列说法和做法中不科学的是( )
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊探究随堂检测答案:C
解析:Na2CO3很稳定,用酒精灯加热情况下不会分解,故A烧杯中不会产生白色沉淀。探究随堂检测2.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸钠俗称 。?
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者。?
(3)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的化学方程式为 。
(4)除去碳酸钠固体中碳酸氢钠时反应的化学方程式为 。?解析:(1)碳酸钠俗称苏打或纯碱。(2)根据碳原子守恒,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应产生的二氧化碳一样多。(4)碳酸钠固体中混有碳酸氢钠时,可用加热的方法来除去碳酸氢钠。探究随堂检测3.工业制纯碱(Na2CO3)的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。 NH3+CO2+H2O+NaCl(饱和) === NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置制取碳酸氢钠晶体。B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。制取碳酸氢钠晶体可供选用的药品有:
A.石灰石 B.生石灰 C.6 mol·L-1盐酸 D.稀硫酸 E.浓氨水 F.饱和氯化钠溶液探究随堂检测①A中制备气体时,所需药品是(选填字母代号) 。?
②B中盛有饱和碳酸氢钠溶液,其作用是 。?
③在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体的化学式为 。?探究随堂检测(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下列实验操作:
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的操作是(选填字母序号) 。?
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液探究随堂检测②操作Ⅲ的方法为 、 、 。?
③所得晶体中碳酸氢钠的纯度为 。?答案:(1)①AC ②除去CO2中的HCl ③NH3
(2)①A ②过滤 洗涤 干燥 探究随堂检测解析:(1)①用石灰石和盐酸在烧瓶中发生反应制取CO2,由于CO2在水中溶解度不大,所以导气管要伸入到液面以下,而制取氨气是将E(浓氨水)滴入到盛有生石灰的烧瓶E中,氨气在水中非常容易溶解,所以导气管要在液面以上,根据C中导气管的长短可知:在A中制备CO2气体,所需药品是A、C;②用盐酸制取CO2气体时,由于盐酸有挥发性,所以CO2中含有杂质HCl,在B中盛有饱和碳酸氢钠溶液,其作用就是除去CO2中的杂质HCl;③CO2在水中的溶解度小,产生的
的浓度也就小,不容易形成NaHCO3的饱和溶液,所以难形成沉淀,因此在实验过程中,应先向C中通入NH3使溶液呈碱性。(2)①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液,若不出现白色沉淀,就证明氯化钙溶液过量,若产生白色沉淀,就证明氯化钙溶液不足量。由于实验目的是确定晶体加热后得到的Na2CO3质量,故不能在实验过程中人为加入Na2CO3,故B、C错误,A正确。探究随堂检测
2.例举生活中使用过的食品添加剂
碳酸氢钠、苯甲酸钠、谷氨酸钠(味精)、酱油等知识铺垫新知预习1.膨松剂:常见的膨松剂有生物膨松剂(酵母)和化学膨松剂,化学膨松剂可分为单一膨松剂和复合膨松剂。
2.NaHCO3的物理性质知识铺垫新知预习3.NaHCO3的化学性质
写出上述序号①②③④所表示反应的化学方程式:【微思考】化学膨松剂为什么可以使食品变得松软或酥脆?
提示:化学膨松剂中通常含有碳酸氢钠,碳酸氢钠在受热条件下分解产生二氧化碳气体,从而可使食品变膨松。探究随堂检测NaHCO3作为膨松剂的作用原理
问题探究
1.碳酸氢钠可能具有什么性质?
提示:碳酸氢钠属于盐,加热会分解,能与酸反应。
2.如果面团没有发酵,能否利用加入碳酸钠的方法使其膨松?
提示:碳酸钠受热一般不分解,与酸反应比较缓慢。所以不能加入碳酸钠使面团发酵。探究随堂检测知识归纳
1.碳酸氢钠的重要性质和应用探究随堂检测2.探究碳酸氢钠的性质:实验方案设计及实施 碳酸氢钠作膨松剂的原理是受热分解产生二氧化碳,使食物膨松。探究随堂检测3.设计并使用复合膨松剂 探究随堂检测方法提炼物质性质实验的一般思路 探究随堂检测典例剖析
例题某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。探究随堂检测(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是 。?
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为? 。?
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 (填化学式)。?
答案:(1)Na2CO3和NaHCO3均可以与盐酸反应产生CO2,CO2使澄清石灰水变浑浊,故达不到实验目的探究随堂检测解析:(1)NaHCO3、Na2CO3都可以与盐酸反应放出CO2,故不能达到目的。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠不稳定。探究随堂检测对点训练1Na2CO3和NaHCO3是常见的两种钠盐,它们广泛应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是( )
A.小苏打能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人
B.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头
C.可以用加热法来鉴别Na2CO3溶液和NaHCO3溶液
D.Na2CO3和NaHCO3都与盐酸反应产生二氧化碳
答案:C探究随堂检测解析:小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为NaHCO3+HCl === NaCl+H2O+CO2↑,胃溃疡病人不能服用小苏打类药物来治疗,因为反应产生的二氧化碳气体会造成胃部胀气,易造成胃穿孔,A项正确;NaHCO3与酸反应生成二氧化碳气体,使得馒头或面包松软多孔,B项正确;Na2CO3和NaHCO3固体可用加热法鉴别,但加热溶液不能鉴别,C项错误;Na2CO3和NaHCO3都是碳酸盐,都能与盐酸反应产生二氧化碳,D项正确。探究随堂检测对点训练2我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
Ⅰ.原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 。?
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出探究随堂检测Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。探究随堂检测回答下列有关问题:
①乙装置中的试剂是 ;?
②丁装置中稀硫酸的作用是 ;?
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。?
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从 管通入 气体,再从 管通入 气体。?
②有同学建议在戊装置的b导管下端连接己装置,理由是 。?
(3)请再写出一种实验室制取少量碳酸氢钠的方法: 。?探究随堂检测答案:Ⅰ.c Ⅱ.(1)①饱和碳酸氢钠溶液 ②吸收未反应的NH3 ③过滤
(2)①a NH3 b CO2 ②增大CO2气体与溶液接触的面积,提高CO2在溶液中的吸收率 (3)往烧碱溶液中通入过量CO2(或往饱和Na2CO3溶液中通入过量CO2等)探究随堂检测解析:Ⅱ.(1)甲装置是CO2的发生装置,由于盐酸易挥发,故生成的CO2气体中会含有HCl气体,乙装置的作用是除去CO2中的HCl气体,所以乙装置中的试剂是饱和碳酸氢钠溶液,丙是制备碳酸氢钠的装置,丁的作用是吸收多余的NH3,防止其污染环境。从溶液中分离出NaHCO3晶体的方法是过滤。(2)实验时必须制取含氨的饱和NaCl溶液,然后通入CO2进行反应。因为NH3极易溶于水,CO2在水中的溶解度不大,故应先从a导管通入NH3,后从b导管通入CO2。己装置中有多孔球泡,能增大CO2气体与溶液的接触面积,从而提高CO2在溶液中的吸收率。
(3)此题是开放性试题,制备少量碳酸氢钠的方法:①用碳酸氢铵与适量的饱和食盐水反应;②往烧碱溶液中通入过量CO2;③往饱和Na2CO3溶液中通入过量CO2等。探究随堂检测1.下图是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察下图所示实验装置,分析实验原理,并判断下列说法和做法中不科学的是( )
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊探究随堂检测答案:C
解析:Na2CO3很稳定,用酒精灯加热情况下不会分解,故A烧杯中不会产生白色沉淀。探究随堂检测2.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸钠俗称 。?
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者。?
(3)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的化学方程式为 。
(4)除去碳酸钠固体中碳酸氢钠时反应的化学方程式为 。?解析:(1)碳酸钠俗称苏打或纯碱。(2)根据碳原子守恒,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应产生的二氧化碳一样多。(4)碳酸钠固体中混有碳酸氢钠时,可用加热的方法来除去碳酸氢钠。探究随堂检测3.工业制纯碱(Na2CO3)的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。 NH3+CO2+H2O+NaCl(饱和) === NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置制取碳酸氢钠晶体。B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。制取碳酸氢钠晶体可供选用的药品有:
A.石灰石 B.生石灰 C.6 mol·L-1盐酸 D.稀硫酸 E.浓氨水 F.饱和氯化钠溶液探究随堂检测①A中制备气体时,所需药品是(选填字母代号) 。?
②B中盛有饱和碳酸氢钠溶液,其作用是 。?
③在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体的化学式为 。?探究随堂检测(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下列实验操作:
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的操作是(选填字母序号) 。?
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液探究随堂检测②操作Ⅲ的方法为 、 、 。?
③所得晶体中碳酸氢钠的纯度为 。?答案:(1)①AC ②除去CO2中的HCl ③NH3
(2)①A ②过滤 洗涤 干燥 探究随堂检测解析:(1)①用石灰石和盐酸在烧瓶中发生反应制取CO2,由于CO2在水中溶解度不大,所以导气管要伸入到液面以下,而制取氨气是将E(浓氨水)滴入到盛有生石灰的烧瓶E中,氨气在水中非常容易溶解,所以导气管要在液面以上,根据C中导气管的长短可知:在A中制备CO2气体,所需药品是A、C;②用盐酸制取CO2气体时,由于盐酸有挥发性,所以CO2中含有杂质HCl,在B中盛有饱和碳酸氢钠溶液,其作用就是除去CO2中的杂质HCl;③CO2在水中的溶解度小,产生的
的浓度也就小,不容易形成NaHCO3的饱和溶液,所以难形成沉淀,因此在实验过程中,应先向C中通入NH3使溶液呈碱性。(2)①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液,若不出现白色沉淀,就证明氯化钙溶液过量,若产生白色沉淀,就证明氯化钙溶液不足量。由于实验目的是确定晶体加热后得到的Na2CO3质量,故不能在实验过程中人为加入Na2CO3,故B、C错误,A正确。探究随堂检测
