2019年秋鲁科版高中化学必修一 第2章 元素与物质世界 本章整合 课件(共25张PPT)
文档属性
| 名称 | 2019年秋鲁科版高中化学必修一 第2章 元素与物质世界 本章整合 课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-04 15:48:47 | ||
图片预览






文档简介
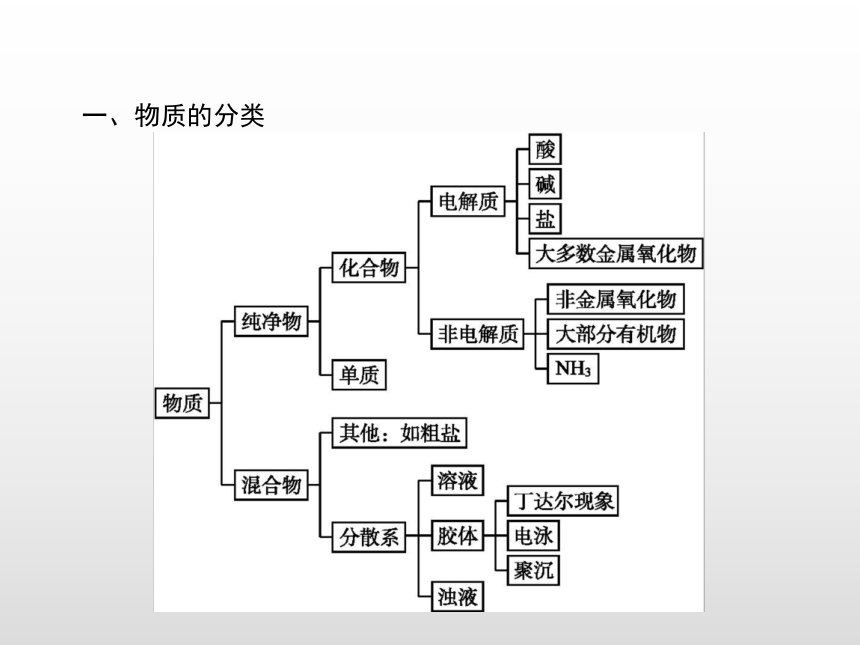
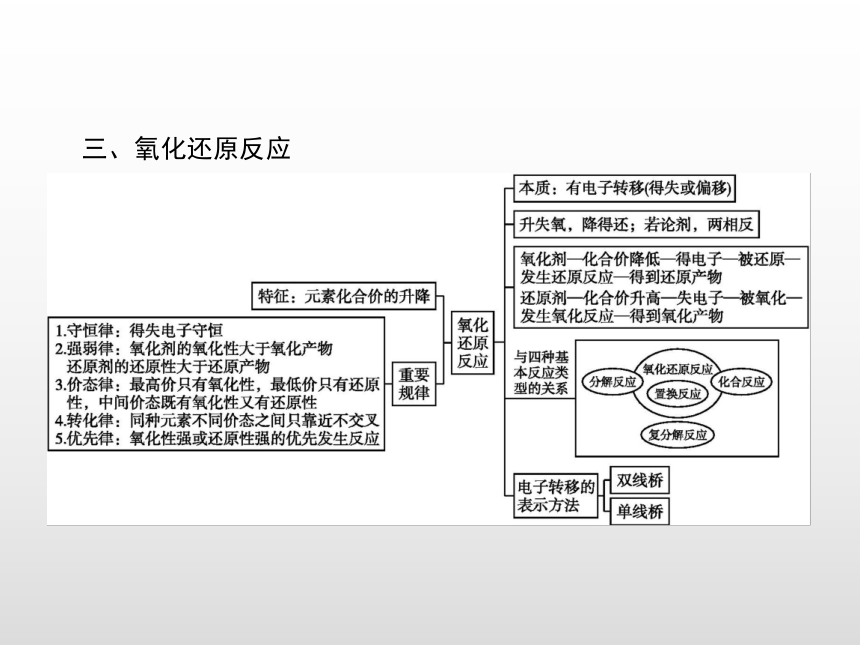
课件25张PPT。本章整合一、物质的分类 二、离子反应 三、氧化还原反应 突破一突破二突破三突破四离子大量共存的判断
典例1在强酸性和强碱性溶液中都能大量共存的一组离子是( )
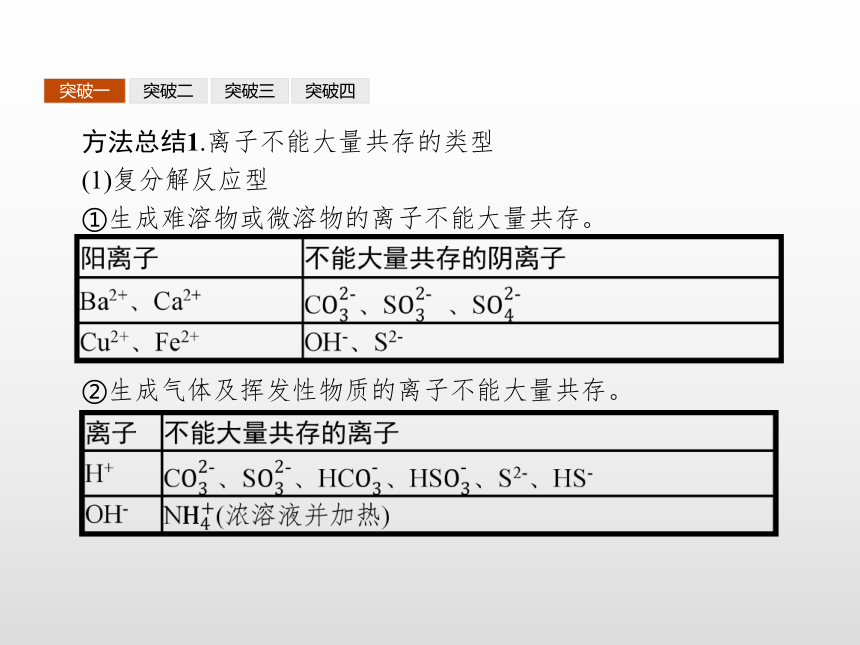
答案:D突破一突破二突破三突破四方法总结1.离子不能大量共存的类型
(1)复分解反应型
①生成难溶物或微溶物的离子不能大量共存。②生成气体及挥发性物质的离子不能大量共存。 突破一突破二突破三突破四③生成难电离物质(水、弱酸、一水合氨等)。
(2)氧化还原型
具有较强氧化性的离子与具有较强还原性的离子,会发生氧化还原反应而不能大量共存。突破一突破二突破三突破四2.判断离子共存的“六大注意”
(1)注意判断离子共存的情况,“能”“不能”“一定”“可能”“一定不能”。
(2)注意题干中提示的溶液酸碱性,酸性溶液应考虑H+的存在,碱性溶液应考虑OH-的存在。
(3)注意题干中提示的溶液颜色,溶液无色时,有色离子不能大量存在。
(4)注意正确理解“透明溶液”,不能认为“有色”就不透明。CuSO4溶液是蓝色透明的溶液。突破一突破二突破三突破四对点训练1-1在无色透明的酸性溶液中,能大量共存的离子组是( )
答案:C
解析:选项A中的Ag+与Cl-不能大量共存,生成的AgCl不溶;选项B中Cu2+在水溶液中显蓝色;选项D中OH-不能大量存在于酸性溶液中;选项C中各离子能够大量共存,且为无色。突破一突破二突破三突破四对点训练1-2下列离子在指定溶液中一定能大量共存的是( )
答案:A突破一突破二突破三突破四离子方程式的判断与书写
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸反应
A.①② B.①②④
C.②③ D.①③
答案:D
解析:②中,若Ba(OH)2溶液与CuSO4或MgSO4溶液反应,除生成BaSO4沉淀外,还有Cu(OH)2或Mg(OH)2沉淀。④中,除生成BaSO4沉淀外,还生成水,因此离子方程式中还应该有水。突破一突破二突破三突破四方法规律1.离子方程式书写步骤(以CaCO3与盐酸的反应为例)突破一突破二突破三突破四2.离子方程式正误判断的总体思路 【微点拨】(1)浓盐酸、浓硝酸在离子方程式中写离子符号,而浓硫酸写化学式。
(3)四种常见的微溶物是Ag2SO4、CaSO4、MgCO3、Ca(OH)2。突破一突破二突破三突破四3.“定1法”书写酸式盐与碱反应的离子方程式
(1)将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
(3)依据“先中和后沉淀”的思路书写。
如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为:突破一突破二突破三突破四对点训练2向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。?
(2)下列三种情况下,离子方程式与(1)相同的是 (填字母)。?
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至 恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量突破一突破二突破三突破四突破一突破二突破三突破四快速准确地熟记氧化还原反应有关概念的方法
典例3工业上可由下列方法制得高效饮用水处理剂高铁酸钠
下列说法正确的是( )
A.反应中Fe2O3是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.3 mol Na2O2反应,有3 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
答案:A
解析:Fe元素的化合价由+3价升高到+6价,反应中Fe2O3做还原剂,A项正确;铁丝在氧气中燃烧生成Fe3O4,B项错误;3 mol Na2O2反应,有6 mol电子转移,C项错误;在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,D项错误。突破一突破二突破三突破四知识归纳
理清氧化还原反应有关概念间的关系突破一突破二突破三突破四方法规律1.联想记忆关键词
(1)记忆口诀:“升失氧还、降得还氧”。其含义即:化合价升高→失去电子(电子对偏离)→被氧化→还原剂→具有还原性(失电子能力)。化合价降低→得到电子 (电子对偏向)→被还原→氧化剂→具有氧化性(得电子能力)。
(2)记忆口诀:“剂性一致,其他相反”。其含义是氧化剂具有氧化性,还原剂具有还原性。“其他相反”即氧化剂被还原,发生还原反应,得还原产物;还原剂被氧化,发生氧化反应,得氧化产物。
2.学会正确的分析方法
化合价变化是分析一切氧化还原反应问题的前提和基础,正确标出各元素的化合价是分析氧化还原反应的关键和突破口。具体方法是找变价,判类型(是否为氧化还原反应)。分升降,定其他(化合价升高,失去电子,发生氧化反应,化合价降低,得到电子,发生还原反应)。突破一突破二突破三突破四对点训练3-1下列对反应3NO2+H2O === 2HNO3+NO的说法中正确的是( )
A.氧化剂与还原剂的质量比为1∶2
B.氧化产物与还原产物的物质的量之比为1∶2
C.NO2是氧化剂,H2O是还原剂
D.若有6 mol NO2参与反应时,有3 mol电子发生转移
答案:A
解析:根据方程式及反应前后氮元素的化合价升降可知,氧化剂与还原剂的质量比为1∶2,A正确;氧化产物与还原产物的物质的量之比为2∶1,B错误;NO2既是氧化剂又是还原剂,C错误;若有6 mol NO2参与反应,则转移4 mol电子,D错误。突破一突破二突破三突破四对点训练3-2N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如:
下列说法正确的是( )
A.反应①中NH4NO3既是氧化剂又是还原剂,H2O是氧化产物
B.反应②中K2SO3是还原剂,N2O是氧化产物
C.反应③中每生成1 mol N2O,转移8 mol电子
D.反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物
答案:C突破一突破二突破三突破四解析:反应①中N元素的化合价既有升高又有降低,故NH4NO3既是氧化剂又是还原剂,生成物N2O既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物,A项错误;反应②中,N元素的化合价降低,S元素的化合价升高,所以K2SO3是还原剂,K2SO4是氧化产物,B项错误;反应③中,N元素的化合价由-3价升高到+1价,则每生成1 mol N2O转移8 mol电子,C项正确;反应④中,NaNO3中N元素的化合价降低,则NaNO3是氧化剂,(NH4)2SO4中N元素的化合价升高,生成物N2O既是氧化产物又是还原产物,D项错误。突破一突破二突破三突破四电子守恒规律及应用
典例41.52 g某铁的氧化物(FexO)溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将铁元素完全氧化成Fe3+。x值为( )
A.0.80 B.0.85 C.0.90 D.0.93
答案:A
解析:根据得失电子守恒可知,FexO被氧化为Fe3+失去的电子数和Cl2得到的电子数相等。标准状况下112 mL Cl2得到电子为0.01 mol,则有:突破一突破二突破三突破四方法规律守恒规律——得失电子相等
即在氧化还原反应中元素化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。
应用:氧化还原反应方程式的配平及相关计算。
利用守恒规律,可以抛开烦琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态, 从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。突破一突破二突破三突破四对点训练4在一定条件下, 和氟气可发生反应
A.+4 B.+5
C.+6 D.+7
答案:B
解析:设 中R的化合价为+x价,则反应前后R的化合价变化为+x价→+6价,F的化合价变化为0价→-1价,由电子守恒可知2×(+6-x)=2×[0-(-1)],即x=5。
典例1在强酸性和强碱性溶液中都能大量共存的一组离子是( )
答案:D突破一突破二突破三突破四方法总结1.离子不能大量共存的类型
(1)复分解反应型
①生成难溶物或微溶物的离子不能大量共存。②生成气体及挥发性物质的离子不能大量共存。 突破一突破二突破三突破四③生成难电离物质(水、弱酸、一水合氨等)。
(2)氧化还原型
具有较强氧化性的离子与具有较强还原性的离子,会发生氧化还原反应而不能大量共存。突破一突破二突破三突破四2.判断离子共存的“六大注意”
(1)注意判断离子共存的情况,“能”“不能”“一定”“可能”“一定不能”。
(2)注意题干中提示的溶液酸碱性,酸性溶液应考虑H+的存在,碱性溶液应考虑OH-的存在。
(3)注意题干中提示的溶液颜色,溶液无色时,有色离子不能大量存在。
(4)注意正确理解“透明溶液”,不能认为“有色”就不透明。CuSO4溶液是蓝色透明的溶液。突破一突破二突破三突破四对点训练1-1在无色透明的酸性溶液中,能大量共存的离子组是( )
答案:C
解析:选项A中的Ag+与Cl-不能大量共存,生成的AgCl不溶;选项B中Cu2+在水溶液中显蓝色;选项D中OH-不能大量存在于酸性溶液中;选项C中各离子能够大量共存,且为无色。突破一突破二突破三突破四对点训练1-2下列离子在指定溶液中一定能大量共存的是( )
答案:A突破一突破二突破三突破四离子方程式的判断与书写
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸反应
A.①② B.①②④
C.②③ D.①③
答案:D
解析:②中,若Ba(OH)2溶液与CuSO4或MgSO4溶液反应,除生成BaSO4沉淀外,还有Cu(OH)2或Mg(OH)2沉淀。④中,除生成BaSO4沉淀外,还生成水,因此离子方程式中还应该有水。突破一突破二突破三突破四方法规律1.离子方程式书写步骤(以CaCO3与盐酸的反应为例)突破一突破二突破三突破四2.离子方程式正误判断的总体思路 【微点拨】(1)浓盐酸、浓硝酸在离子方程式中写离子符号,而浓硫酸写化学式。
(3)四种常见的微溶物是Ag2SO4、CaSO4、MgCO3、Ca(OH)2。突破一突破二突破三突破四3.“定1法”书写酸式盐与碱反应的离子方程式
(1)将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
(3)依据“先中和后沉淀”的思路书写。
如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为:突破一突破二突破三突破四对点训练2向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。?
(2)下列三种情况下,离子方程式与(1)相同的是 (填字母)。?
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至 恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量突破一突破二突破三突破四突破一突破二突破三突破四快速准确地熟记氧化还原反应有关概念的方法
典例3工业上可由下列方法制得高效饮用水处理剂高铁酸钠
下列说法正确的是( )
A.反应中Fe2O3是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.3 mol Na2O2反应,有3 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
答案:A
解析:Fe元素的化合价由+3价升高到+6价,反应中Fe2O3做还原剂,A项正确;铁丝在氧气中燃烧生成Fe3O4,B项错误;3 mol Na2O2反应,有6 mol电子转移,C项错误;在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,D项错误。突破一突破二突破三突破四知识归纳
理清氧化还原反应有关概念间的关系突破一突破二突破三突破四方法规律1.联想记忆关键词
(1)记忆口诀:“升失氧还、降得还氧”。其含义即:化合价升高→失去电子(电子对偏离)→被氧化→还原剂→具有还原性(失电子能力)。化合价降低→得到电子 (电子对偏向)→被还原→氧化剂→具有氧化性(得电子能力)。
(2)记忆口诀:“剂性一致,其他相反”。其含义是氧化剂具有氧化性,还原剂具有还原性。“其他相反”即氧化剂被还原,发生还原反应,得还原产物;还原剂被氧化,发生氧化反应,得氧化产物。
2.学会正确的分析方法
化合价变化是分析一切氧化还原反应问题的前提和基础,正确标出各元素的化合价是分析氧化还原反应的关键和突破口。具体方法是找变价,判类型(是否为氧化还原反应)。分升降,定其他(化合价升高,失去电子,发生氧化反应,化合价降低,得到电子,发生还原反应)。突破一突破二突破三突破四对点训练3-1下列对反应3NO2+H2O === 2HNO3+NO的说法中正确的是( )
A.氧化剂与还原剂的质量比为1∶2
B.氧化产物与还原产物的物质的量之比为1∶2
C.NO2是氧化剂,H2O是还原剂
D.若有6 mol NO2参与反应时,有3 mol电子发生转移
答案:A
解析:根据方程式及反应前后氮元素的化合价升降可知,氧化剂与还原剂的质量比为1∶2,A正确;氧化产物与还原产物的物质的量之比为2∶1,B错误;NO2既是氧化剂又是还原剂,C错误;若有6 mol NO2参与反应,则转移4 mol电子,D错误。突破一突破二突破三突破四对点训练3-2N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如:
下列说法正确的是( )
A.反应①中NH4NO3既是氧化剂又是还原剂,H2O是氧化产物
B.反应②中K2SO3是还原剂,N2O是氧化产物
C.反应③中每生成1 mol N2O,转移8 mol电子
D.反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物
答案:C突破一突破二突破三突破四解析:反应①中N元素的化合价既有升高又有降低,故NH4NO3既是氧化剂又是还原剂,生成物N2O既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物,A项错误;反应②中,N元素的化合价降低,S元素的化合价升高,所以K2SO3是还原剂,K2SO4是氧化产物,B项错误;反应③中,N元素的化合价由-3价升高到+1价,则每生成1 mol N2O转移8 mol电子,C项正确;反应④中,NaNO3中N元素的化合价降低,则NaNO3是氧化剂,(NH4)2SO4中N元素的化合价升高,生成物N2O既是氧化产物又是还原产物,D项错误。突破一突破二突破三突破四电子守恒规律及应用
典例41.52 g某铁的氧化物(FexO)溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将铁元素完全氧化成Fe3+。x值为( )
A.0.80 B.0.85 C.0.90 D.0.93
答案:A
解析:根据得失电子守恒可知,FexO被氧化为Fe3+失去的电子数和Cl2得到的电子数相等。标准状况下112 mL Cl2得到电子为0.01 mol,则有:突破一突破二突破三突破四方法规律守恒规律——得失电子相等
即在氧化还原反应中元素化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。
应用:氧化还原反应方程式的配平及相关计算。
利用守恒规律,可以抛开烦琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态, 从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。突破一突破二突破三突破四对点训练4在一定条件下, 和氟气可发生反应
A.+4 B.+5
C.+6 D.+7
答案:B
解析:设 中R的化合价为+x价,则反应前后R的化合价变化为+x价→+6价,F的化合价变化为0价→-1价,由电子守恒可知2×(+6-x)=2×[0-(-1)],即x=5。
