河北省雄安新区博奥高中2019-2020学年高二上学期开学考试化学试题 Word版含答案
文档属性
| 名称 | 河北省雄安新区博奥高中2019-2020学年高二上学期开学考试化学试题 Word版含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 130.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-05 00:00:00 | ||
图片预览


文档简介
2019-2020学年度博奥高中第一学期开学考试
化学试卷
一、单选题(本部分为选择题,每题3分)
1.下列化合物依次属于氧化物、碱、盐的一组是 ( )
A.Na2CO3、KOH、CaO
B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl
D.CuO、Cu2(OH)2CO3、CaCO3
2.下列关于摩尔质量的描述或应用正确的是()
A.1mol OH-的质量是17
B.二氧化碳的摩尔质量是44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量约等于g
3.现有三组溶液:①含有水分的植物油中除去水分;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
4.某无色透明溶液,在酸性环境下能大量共存的离子组是
A.Na+、SO42-、HCO3-、C1-
B.Mg2+、Cl-、Na+、NO3-
C.K+、MnO4-、NO3-、Fe2+
D.Cu2+、Cl-、NH4+、SO42-
5.已知Na2S2O3(S的价态为+2价)可与氯气发生如下反应:4C12 +Na2S2O3 +5H2O= 2NaCl + 2H2SO4 + 6HCl,有关该反应的叙述正确的是
A.Cl2在该反应中被还原
B.H2SO4是还原产物
C.反应中硫元素的化合价降低
D.反应中H2O被氧化
6.常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,
②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。
由此判断下列说法正确的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序:Cl2>Br2>I2> Fe3+
D.还原性强弱顺序:I-> Br->Fe2+>Cl-
7.24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知亚硫酸钠被氧化为硫酸钠,则铬元素在还原产物中的化合价为( )
A.+3价 B.+4价 C.+5价 D.+6价
8.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的
A.加热,观察是否有气体放出
B.溶于水后加BaCl2,看有无沉淀
C.溶于水后加石灰水,看有无沉淀
D.取固体试样加盐酸,看是否有气泡产生
9.对于反应:2Na2O2 + 2H2O === 4NaOH + O2,下列说法中正确的是 ( )
A.Na2O2是氧化剂,H2O是还原剂
B.Na2O2既是氧化剂,又是还原剂
C.该反应中电子转移的数目为4e-
D.O2既是氧化产物,又是还原产物
10.检验 SO2 气体中是否混有 CO2 气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过足量酸性 KMnO4 溶液,再通过澄清石灰水
D.先通过 NaOH 溶液,再通过澄清石灰水
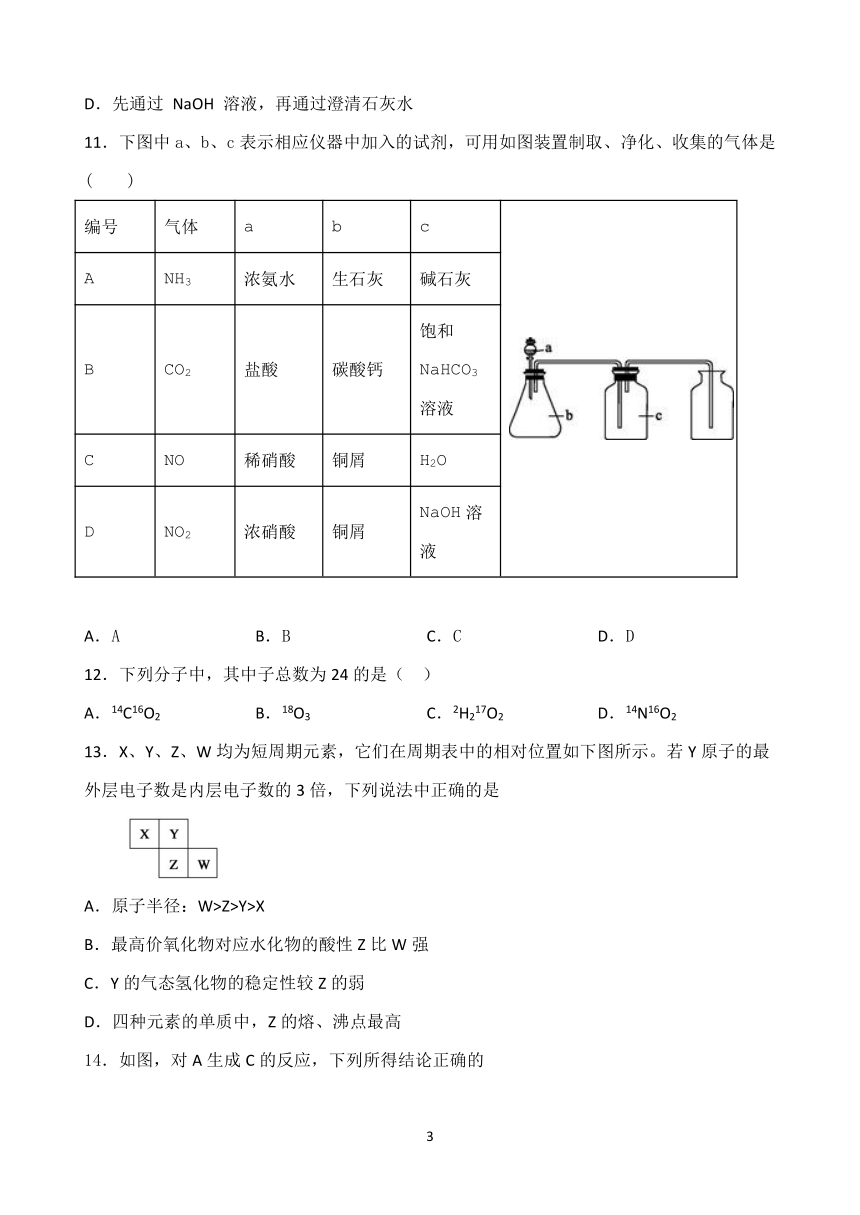
11.下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号
气体
a
b
c
A
NH3
浓氨水
生石灰
碱石灰
B
CO2
盐酸
碳酸钙
饱和NaHCO3溶液
C
NO
稀硝酸
铜屑
H2O
D
NO2
浓硝酸
铜屑
NaOH溶液
A.A B.B C.C D.D
12.下列分子中,其中子总数为24的是( )
A.14C16O2 B.18O3 C.2H217O2 D.14N16O2
13.X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性Z比W强
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
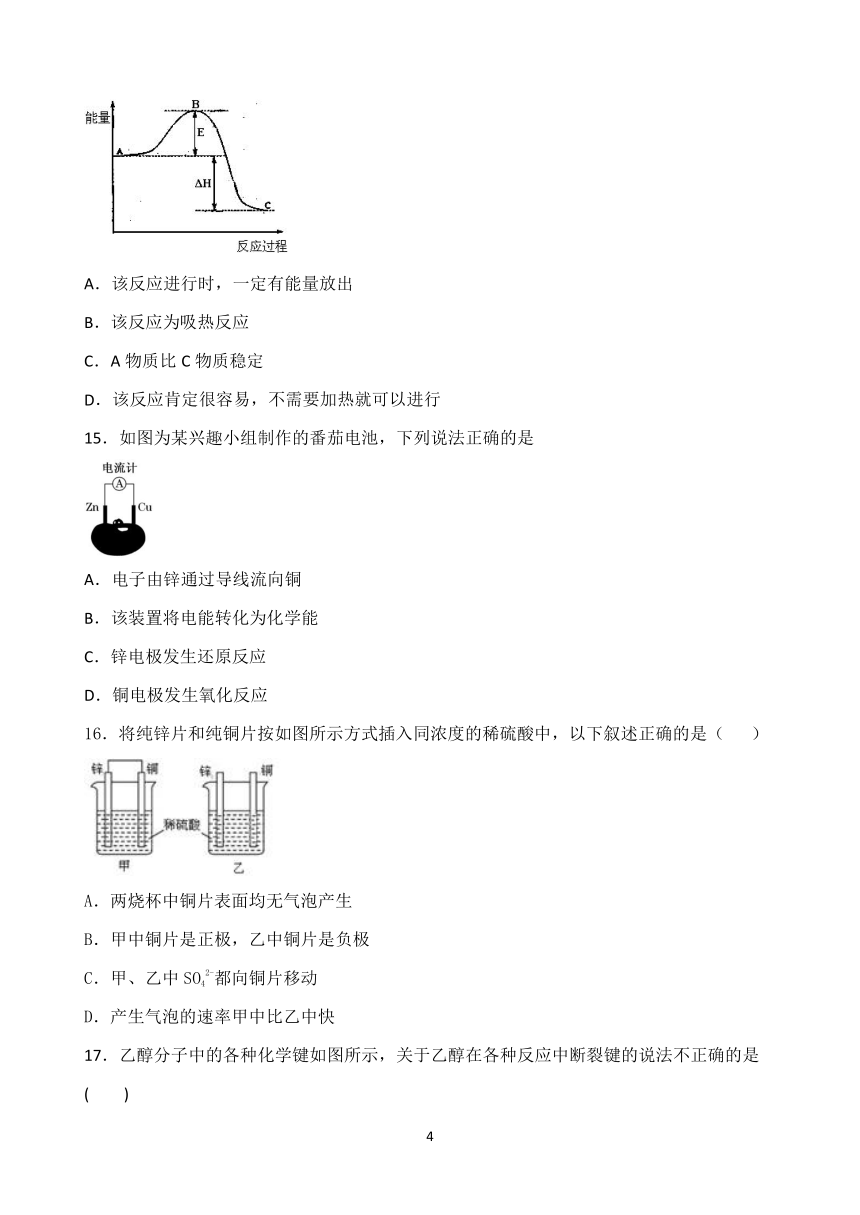
14.如图,对A生成C的反应,下列所得结论正确的
A.该反应进行时,一定有能量放出
B.该反应为吸热反应
C.A物质比C物质稳定
D.该反应肯定很容易,不需要加热就可以进行
15.如图为某兴趣小组制作的番茄电池,下列说法正确的是
A.电子由锌通过导线流向铜
B.该装置将电能转化为化学能
C.锌电极发生还原反应
D.铜电极发生氧化反应
16.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲、乙中SO42-都向铜片移动
D.产生气泡的速率甲中比乙中快
17.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在铜催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
18.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羟基和羧基均能电离出氢离子
19.下列关于苯的叙述正确的是( )
A.反应①常温下不能进行
B.反应②不发生,但是仍有分层现象,紫色层在上层
C.反应③为取代反应,加热方式为酒精灯直接加热
D.反应④能发生,生成的产物其二氯代物有4种
二、非选择题
20(14分)在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl22HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl22HCl反应________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
三、综合题
21(16分)I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>” “<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →?2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
四、实验题
22(13)实验室配制欲配置480mL4.0 mol·L-1的NaOH溶液。根据配置溶液的具体过程回答下列问题:
(1)配制该溶液应选用______________mL容量瓶。
(2)用托盘天平称取_____________g固体NaOH。
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入____________, 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用________?滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液_____________(填“能”或“不能”)长期存放在容量瓶中。
(7)以下因素会造成实验结果偏低的是____________
A.定容时观察液面仰视????????????
B.定容时观察液面俯视
C.有少量NaOH溶液残留在烧杯中?
D.容量瓶中原来有少量蒸馏水
化学参考答案
1.B 2.D 3.C 4.B 5.A 6.B 7.A 8.B 9.B 10.C
11.B 12.A 13.D 14.A 15.A 16.D 17.C 18.C 19.D
20.(1)679 kJ (2)862 kJ (3)放出 (4)>
21.2A?B 0.05mol·(L·min)-1 否 = 是 b bc
22.500 80 容量瓶 胶头滴管 不能 AC
化学试卷
一、单选题(本部分为选择题,每题3分)
1.下列化合物依次属于氧化物、碱、盐的一组是 ( )
A.Na2CO3、KOH、CaO
B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl
D.CuO、Cu2(OH)2CO3、CaCO3
2.下列关于摩尔质量的描述或应用正确的是()
A.1mol OH-的质量是17
B.二氧化碳的摩尔质量是44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量约等于g
3.现有三组溶液:①含有水分的植物油中除去水分;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
4.某无色透明溶液,在酸性环境下能大量共存的离子组是
A.Na+、SO42-、HCO3-、C1-
B.Mg2+、Cl-、Na+、NO3-
C.K+、MnO4-、NO3-、Fe2+
D.Cu2+、Cl-、NH4+、SO42-
5.已知Na2S2O3(S的价态为+2价)可与氯气发生如下反应:4C12 +Na2S2O3 +5H2O= 2NaCl + 2H2SO4 + 6HCl,有关该反应的叙述正确的是
A.Cl2在该反应中被还原
B.H2SO4是还原产物
C.反应中硫元素的化合价降低
D.反应中H2O被氧化
6.常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,
②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。
由此判断下列说法正确的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序:Cl2>Br2>I2> Fe3+
D.还原性强弱顺序:I-> Br->Fe2+>Cl-
7.24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知亚硫酸钠被氧化为硫酸钠,则铬元素在还原产物中的化合价为( )
A.+3价 B.+4价 C.+5价 D.+6价
8.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的
A.加热,观察是否有气体放出
B.溶于水后加BaCl2,看有无沉淀
C.溶于水后加石灰水,看有无沉淀
D.取固体试样加盐酸,看是否有气泡产生
9.对于反应:2Na2O2 + 2H2O === 4NaOH + O2,下列说法中正确的是 ( )
A.Na2O2是氧化剂,H2O是还原剂
B.Na2O2既是氧化剂,又是还原剂
C.该反应中电子转移的数目为4e-
D.O2既是氧化产物,又是还原产物
10.检验 SO2 气体中是否混有 CO2 气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过足量酸性 KMnO4 溶液,再通过澄清石灰水
D.先通过 NaOH 溶液,再通过澄清石灰水
11.下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号
气体
a
b
c
A
NH3
浓氨水
生石灰
碱石灰
B
CO2
盐酸
碳酸钙
饱和NaHCO3溶液
C
NO
稀硝酸
铜屑
H2O
D
NO2
浓硝酸
铜屑
NaOH溶液
A.A B.B C.C D.D
12.下列分子中,其中子总数为24的是( )
A.14C16O2 B.18O3 C.2H217O2 D.14N16O2
13.X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性Z比W强
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
14.如图,对A生成C的反应,下列所得结论正确的
A.该反应进行时,一定有能量放出
B.该反应为吸热反应
C.A物质比C物质稳定
D.该反应肯定很容易,不需要加热就可以进行
15.如图为某兴趣小组制作的番茄电池,下列说法正确的是
A.电子由锌通过导线流向铜
B.该装置将电能转化为化学能
C.锌电极发生还原反应
D.铜电极发生氧化反应
16.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲、乙中SO42-都向铜片移动
D.产生气泡的速率甲中比乙中快
17.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在铜催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
18.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羟基和羧基均能电离出氢离子
19.下列关于苯的叙述正确的是( )
A.反应①常温下不能进行
B.反应②不发生,但是仍有分层现象,紫色层在上层
C.反应③为取代反应,加热方式为酒精灯直接加热
D.反应④能发生,生成的产物其二氯代物有4种
二、非选择题
20(14分)在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl22HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl22HCl反应________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
三、综合题
21(16分)I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>” “<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →?2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
四、实验题
22(13)实验室配制欲配置480mL4.0 mol·L-1的NaOH溶液。根据配置溶液的具体过程回答下列问题:
(1)配制该溶液应选用______________mL容量瓶。
(2)用托盘天平称取_____________g固体NaOH。
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入____________, 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用________?滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液_____________(填“能”或“不能”)长期存放在容量瓶中。
(7)以下因素会造成实验结果偏低的是____________
A.定容时观察液面仰视????????????
B.定容时观察液面俯视
C.有少量NaOH溶液残留在烧杯中?
D.容量瓶中原来有少量蒸馏水
化学参考答案
1.B 2.D 3.C 4.B 5.A 6.B 7.A 8.B 9.B 10.C
11.B 12.A 13.D 14.A 15.A 16.D 17.C 18.C 19.D
20.(1)679 kJ (2)862 kJ (3)放出 (4)>
21.2A?B 0.05mol·(L·min)-1 否 = 是 b bc
22.500 80 容量瓶 胶头滴管 不能 AC
同课章节目录
