高中化学人教版必修一2.1《物质的分类》ppt课件
文档属性
| 名称 | 高中化学人教版必修一2.1《物质的分类》ppt课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-09 21:05:30 | ||
图片预览








文档简介
(共43张PPT)
图书馆里有许许多多的书籍,为什么你很快就找到你需要的书?
请从下列各组物质中找出一种与其它物质不同的物质
Cu(OH)2 、 NaOH 、Mg(OH)2、H2SO4
(H2SO4)
空气 、 N2 、 HCl气体、CuSO4·5H2O
(空气)
Na2CO3 、 ZnSO4、 CaCO3 、MgCO3
(ZnSO4)
NaHCO3、HCl、H2SO4、HNO3
(NaHCO3)
分类方法的应用在日常生活中是非常普遍的,我们应该善于发现和学会使用,以提高我们工作和学习的效率。
在化学方面,为了更好地获得和利用物质,科学家同样也会将众多的化学物质进行分类研究。
分类:即根据事物的特点分别归类。
【交流与讨论】
请将下列物质进行分类,并说明分类的依据。
空气、乙醇(C2H5OH)、硫酸铵、铜、碘酒、碘、 氢气、石墨 、食盐水
空气、碘酒、食盐水
乙醇、硫酸铵、铜、
碘、氢气、石墨
硫酸铵、铜、碘、石墨
乙醇、碘酒、食盐水
空气、氢气
混合物:
纯净物:
例如:
或者:
固体:
液体:
气体:
一、物质的简单分类方法
1.单一分类法:被分对象只用一种标准进行归类的方法
化学物质
纯净物
混合物
单质
金属单质
非金属单质
(据所含物质的种数)
(据所含元素的性质)
单一分类法有很明显的局限性
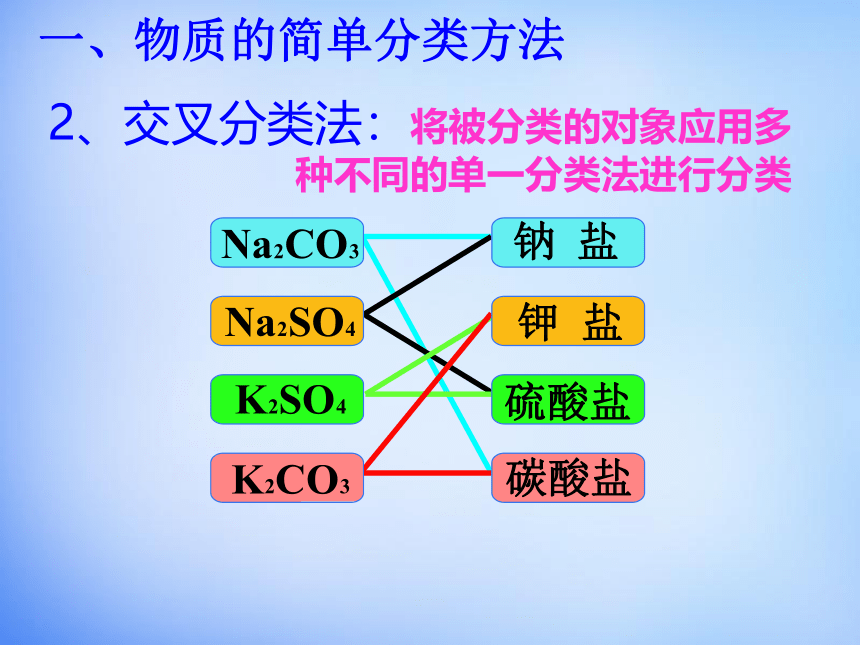
2、交叉分类法:将被分类的对象应用多种不同的单一分类法进行分类
一、物质的简单分类方法
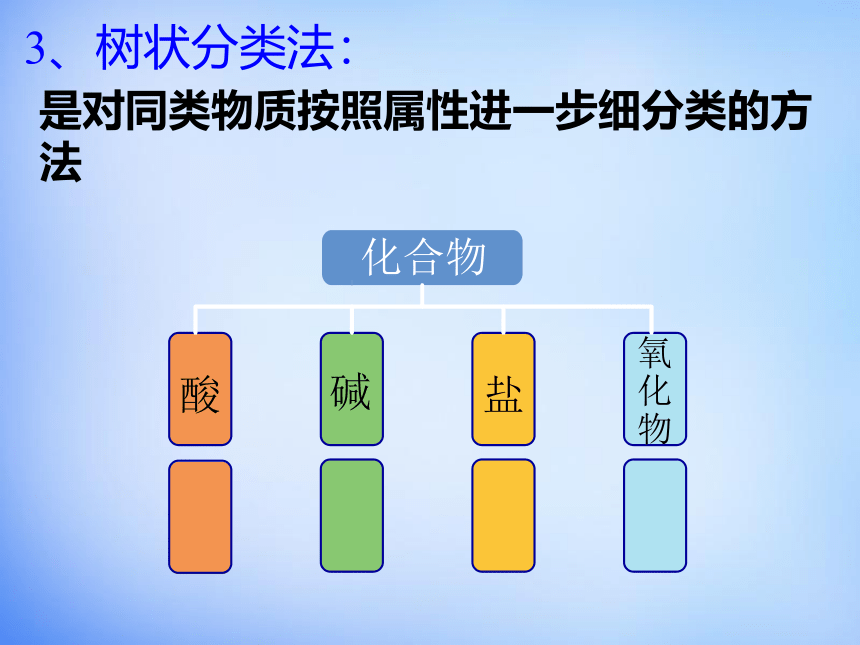
3、树状分类法:
是对同类物质按照属性进一步细分类的方法
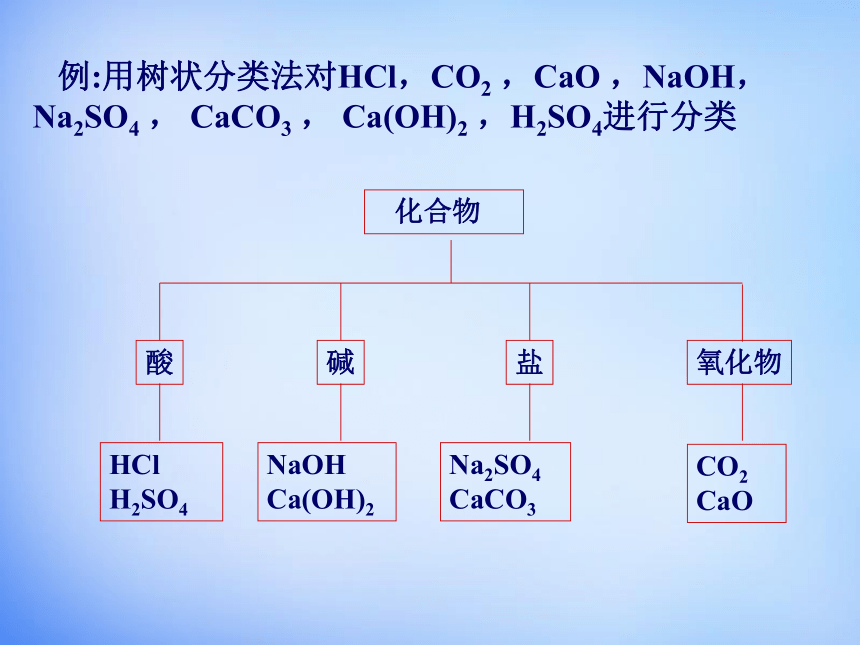
例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
CO2 CaO
化学物质
混合物
纯净物
非均匀
混合物
均匀
混合物
(按物质的组成分类)
单质
化合物
非金属
单质
金属单质
无机化合物
有机化合物
酸 碱 盐 氧化物…
学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时地归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。
1.对若干物质分类,下列说法错误的是
A.可能有多种标准
B.一定只有一种标准
C.可能用交叉分类法进行分类
D.可能用树状分类法进行分类
2.下列物质属于纯净物的是
A.稀硫酸 B.NaOH
C.NaOH溶液 D.天然气
练习:
√
√
名 称 生石灰 硫 酸 硫酸铜 氖 气 氯化铁 碳酸氢铵 氢氧化钠
化学式
类 别
(组成)
3.填表
CaO
H2SO4
CuSO4
Ne
FeCl3
NH4HCO3
NaOH
氧化物
酸
盐
单质
盐
盐
碱
初中时所学“溶液”的概念:
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液.
溶剂:能溶解其他物质的物质.
溶质:被溶解的物质
二、分散系及其分类
分散系:
分散质:
分散剂:
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系。
被分散的物质
起容纳分散质作用的物质
气
固
液
固
液
气
分散质
分散剂
按照分散质或分散剂的聚集状态(气、液、固)
来分,有9种类型。
分散系的分类
【思考与交流】
阅读课本,然后画出分散系的树状分类图?
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系
依据分散质微粒直径大小
分散系可分为溶液、浊液、胶体三类
分散系 溶液 胶体 浊液
分散质微粒直径
< 1nm
1 ~100 nm
>100 nm
【实验1-1】:
1、取两个100mL烧杯,分别加入40mL蒸馏水、40mLCuSO4溶液。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得Fe(OH)3胶体。
2、把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用手电筒照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
光束照射时的现象 原因分析
Fe(OH)3胶体
CuSO4溶液
形成一条光亮的通路
胶体的直径在1-100nm之间,能使光波发生散射
无光路现象产生
溶液中粒子的直径小于1nm,散射极其微弱
它们的分散质粒子大小﹑性质有何区别?
三、胶体
分散质微粒的直径大小在1nm-100nm(10-9-10-7m )之间的分散系叫做胶体
1. 定义:
2、溶液与胶体的鉴别
常见胶体有:Fe(OH)3、AgI、淀粉、H2SiO3
在光的传播过程中,光线照射到微粒时,如果微粒大于入射光波长很多倍,则发生光的反射;如果微粒小于入射光波长,则发生光的散射,此时的光向四周放射,称为散射光或乳光现象。
溶胶粒子大小一般不超过100nm(1nm~100nm),小于可见光的波长(400nm~700nm),因此可见光透过溶胶会产生明显的散射作用。这种现象也被称为丁达尔现象。而对于溶液,虽然分子或离子更小,但散射光的强度随散射粒子体积的减小而明显减小。
淀粉胶体和 NaCl溶液于半透膜内
蒸镏水
利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
溶液、胶体的粒子大小比较
应用:
胶体净化、提纯使胶体和溶液分离
3、胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。是胶体稳定性的主要原因
胶粒带电情况:
金属氢氧化物 —— 带(+)电荷
土壤胶粒—— 带(-)电荷
淀粉胶粒——不带电。
4、胶体的聚沉
原因:当破坏胶体微粒原来带有相同电荷的特点时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:
⑴加热
⑵加电解质溶液
⑶加带相反电荷的胶体
溶液 胶体 浊液
微粒直径
微粒组成
特点
能否通过滤纸
光照
能否通过半透膜
实例
<1n m
1~100n m
>100n m
分子或离子
分子的集合体或高分子
小液滴或固体小颗粒
均一、稳定、透明
不均一、不稳定、不透明
均一、稳定、透明
能 能 不能
可通过无光路
可通过形成光路
透光性差
能 不能 不能
蔗糖水、食盐水
蛋白溶液、淀粉溶液
石灰乳、油水混合物
1、用特殊方法把固体物质加 工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液
C、胶体 D、乳浊液
c
目标测试
2、下列各组物质中,常用渗析法分离
的是 ( )
A、CaCO3和Na2CO3固体
B、I2和K2CO3固体
C、CCl4和水
D、Fe(OH)3胶体和FeCl3溶液
D
目标测试
酸
1,按是否含有氧元素:
含氧酸:
H2SO4 HNO3 H2CO3 H3PO4
无氧酸:
HCl H2S HBr HF
2,按电离时生成氢离子的个数
一元酸:
HNO3 HCl HF
二元酸:
H2SO4 H2CO3 H2S
三元酸:
H3PO4
3,按性质分:
易挥发酸:
难挥发性酸:
易分解酸:
强氧化性酸:
HNO3 HCl
H2SO4 H3PO4
H2CO3 H2SO3
(浓)H2SO4 HNO3
碱
按其在水溶液中是否溶解:
1,可溶性碱:
2,难溶性碱:
KOH NaOH Ba(OH)2 Ca(OH)2
Cu(OH)2 Fe(OH)3 Mg(OH)2 Zn(OH)2
可溶性碱的氧化物 + 水===碱
如: Na2O +H2O==2NaOH
如: Cu(OH)2===CuO +H2O
难溶性碱 加热易分解
盐
1,按组成分为:
正 盐
酸式盐
碱式盐
NaCl FeS MgCl2
某化某
NaNO3 CuSO4 CaCO3
某酸某
NaHCO3 Ca(HCO3)2
某酸氢某
NaH2PO4
某酸几氢某
Cu2(OH)2CO3 MgOHCl
碱式某酸某
2,按是否可溶于水:
可溶性盐:
难溶性盐:
NaCl MgCl2 CuSO4
CaCO3 AgCl BaSO4
3,按阴、阳离子来分:
阳离子:
阴离子:
K+ Na+ NH4+ Cu2+ Ca2+
NO3-- SO42-- Cl— CO32-- PO43--
化学反应
按反应物和生成物的类别以及反应前后物质的多少
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加
离子反应
非离子反应
按反应中是否有电子转移
氧化还原反应
非氧化还原反应
思考与讨论
酸与活泼金属的反应:
2Al +6HCl ====2AlCl + 3H ↑
酸与碱性氧化物反应:
CaO+2HCl=CaCl2+H2O
酸与碱反应:
HCl+NaOH=NaCl+H2O
酸与某些盐反应:
H2SO4+BaCl2=BaSO4↓+2HCl
为什么不同的酸(或碱)具有相似的化学性质?是因为他们在组成上具有相似性。
从微观角度来看,不同的酸溶液中都含有H+
,不同的碱溶液中都含有OH-。不同的碳酸盐溶液都含有碳酸根离子,所以不同的碳酸盐也具有相似的化学性质。
从反映类型来看,初中我们学过的酸与金属、盐与金属的反应属于置换反应,酸与碱、盐与酸、盐与碱、盐与盐之间的反应都属于复分解反应。
思考与讨论
写出下列物质之间的转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
Ca→CaO→Ca(OH)2→CaSO4
2Ca + O2 == 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+2H2O
C→CO2→H2CO3→CaCO3
C+O2= 点燃 =CO2
CO + H O === H CO
H2CO3+Ca(OH)2=CaCO3↓+2H2O
图书馆里有许许多多的书籍,为什么你很快就找到你需要的书?
请从下列各组物质中找出一种与其它物质不同的物质
Cu(OH)2 、 NaOH 、Mg(OH)2、H2SO4
(H2SO4)
空气 、 N2 、 HCl气体、CuSO4·5H2O
(空气)
Na2CO3 、 ZnSO4、 CaCO3 、MgCO3
(ZnSO4)
NaHCO3、HCl、H2SO4、HNO3
(NaHCO3)
分类方法的应用在日常生活中是非常普遍的,我们应该善于发现和学会使用,以提高我们工作和学习的效率。
在化学方面,为了更好地获得和利用物质,科学家同样也会将众多的化学物质进行分类研究。
分类:即根据事物的特点分别归类。
【交流与讨论】
请将下列物质进行分类,并说明分类的依据。
空气、乙醇(C2H5OH)、硫酸铵、铜、碘酒、碘、 氢气、石墨 、食盐水
空气、碘酒、食盐水
乙醇、硫酸铵、铜、
碘、氢气、石墨
硫酸铵、铜、碘、石墨
乙醇、碘酒、食盐水
空气、氢气
混合物:
纯净物:
例如:
或者:
固体:
液体:
气体:
一、物质的简单分类方法
1.单一分类法:被分对象只用一种标准进行归类的方法
化学物质
纯净物
混合物
单质
金属单质
非金属单质
(据所含物质的种数)
(据所含元素的性质)
单一分类法有很明显的局限性
2、交叉分类法:将被分类的对象应用多种不同的单一分类法进行分类
一、物质的简单分类方法
3、树状分类法:
是对同类物质按照属性进一步细分类的方法
例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
CO2 CaO
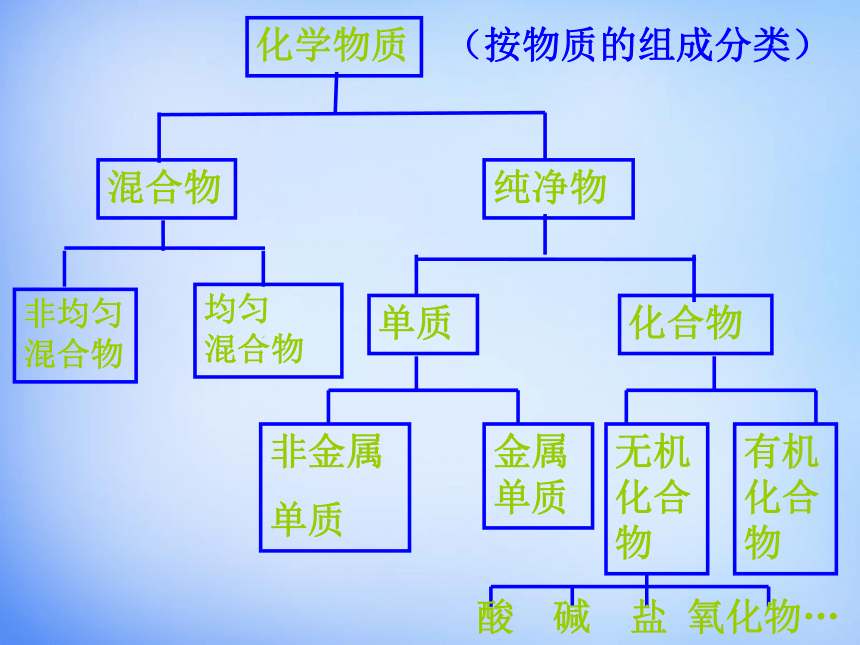
化学物质
混合物
纯净物
非均匀
混合物
均匀
混合物
(按物质的组成分类)
单质
化合物
非金属
单质
金属单质
无机化合物
有机化合物
酸 碱 盐 氧化物…
学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时地归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。
1.对若干物质分类,下列说法错误的是
A.可能有多种标准
B.一定只有一种标准
C.可能用交叉分类法进行分类
D.可能用树状分类法进行分类
2.下列物质属于纯净物的是
A.稀硫酸 B.NaOH
C.NaOH溶液 D.天然气
练习:
√
√
名 称 生石灰 硫 酸 硫酸铜 氖 气 氯化铁 碳酸氢铵 氢氧化钠
化学式
类 别
(组成)
3.填表
CaO
H2SO4
CuSO4
Ne
FeCl3
NH4HCO3
NaOH
氧化物
酸
盐
单质
盐
盐
碱
初中时所学“溶液”的概念:
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液.
溶剂:能溶解其他物质的物质.
溶质:被溶解的物质
二、分散系及其分类
分散系:
分散质:
分散剂:
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系。
被分散的物质
起容纳分散质作用的物质
气
固
液
固
液
气
分散质
分散剂
按照分散质或分散剂的聚集状态(气、液、固)
来分,有9种类型。
分散系的分类
【思考与交流】
阅读课本,然后画出分散系的树状分类图?
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系
依据分散质微粒直径大小
分散系可分为溶液、浊液、胶体三类
分散系 溶液 胶体 浊液
分散质微粒直径
< 1nm
1 ~100 nm
>100 nm
【实验1-1】:
1、取两个100mL烧杯,分别加入40mL蒸馏水、40mLCuSO4溶液。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得Fe(OH)3胶体。
2、把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用手电筒照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
光束照射时的现象 原因分析
Fe(OH)3胶体
CuSO4溶液
形成一条光亮的通路
胶体的直径在1-100nm之间,能使光波发生散射
无光路现象产生
溶液中粒子的直径小于1nm,散射极其微弱
它们的分散质粒子大小﹑性质有何区别?
三、胶体
分散质微粒的直径大小在1nm-100nm(10-9-10-7m )之间的分散系叫做胶体
1. 定义:
2、溶液与胶体的鉴别
常见胶体有:Fe(OH)3、AgI、淀粉、H2SiO3
在光的传播过程中,光线照射到微粒时,如果微粒大于入射光波长很多倍,则发生光的反射;如果微粒小于入射光波长,则发生光的散射,此时的光向四周放射,称为散射光或乳光现象。
溶胶粒子大小一般不超过100nm(1nm~100nm),小于可见光的波长(400nm~700nm),因此可见光透过溶胶会产生明显的散射作用。这种现象也被称为丁达尔现象。而对于溶液,虽然分子或离子更小,但散射光的强度随散射粒子体积的减小而明显减小。
淀粉胶体和 NaCl溶液于半透膜内
蒸镏水
利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。
溶液、胶体的粒子大小比较
应用:
胶体净化、提纯使胶体和溶液分离
3、胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。是胶体稳定性的主要原因
胶粒带电情况:
金属氢氧化物 —— 带(+)电荷
土壤胶粒—— 带(-)电荷
淀粉胶粒——不带电。
4、胶体的聚沉
原因:当破坏胶体微粒原来带有相同电荷的特点时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:
⑴加热
⑵加电解质溶液
⑶加带相反电荷的胶体
溶液 胶体 浊液
微粒直径
微粒组成
特点
能否通过滤纸
光照
能否通过半透膜
实例
<1n m
1~100n m
>100n m
分子或离子
分子的集合体或高分子
小液滴或固体小颗粒
均一、稳定、透明
不均一、不稳定、不透明
均一、稳定、透明
能 能 不能
可通过无光路
可通过形成光路
透光性差
能 不能 不能
蔗糖水、食盐水
蛋白溶液、淀粉溶液
石灰乳、油水混合物
1、用特殊方法把固体物质加 工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液
C、胶体 D、乳浊液
c
目标测试
2、下列各组物质中,常用渗析法分离
的是 ( )
A、CaCO3和Na2CO3固体
B、I2和K2CO3固体
C、CCl4和水
D、Fe(OH)3胶体和FeCl3溶液
D
目标测试
酸
1,按是否含有氧元素:
含氧酸:
H2SO4 HNO3 H2CO3 H3PO4
无氧酸:
HCl H2S HBr HF
2,按电离时生成氢离子的个数
一元酸:
HNO3 HCl HF
二元酸:
H2SO4 H2CO3 H2S
三元酸:
H3PO4
3,按性质分:
易挥发酸:
难挥发性酸:
易分解酸:
强氧化性酸:
HNO3 HCl
H2SO4 H3PO4
H2CO3 H2SO3
(浓)H2SO4 HNO3
碱
按其在水溶液中是否溶解:
1,可溶性碱:
2,难溶性碱:
KOH NaOH Ba(OH)2 Ca(OH)2
Cu(OH)2 Fe(OH)3 Mg(OH)2 Zn(OH)2
可溶性碱的氧化物 + 水===碱
如: Na2O +H2O==2NaOH
如: Cu(OH)2===CuO +H2O
难溶性碱 加热易分解
盐
1,按组成分为:
正 盐
酸式盐
碱式盐
NaCl FeS MgCl2
某化某
NaNO3 CuSO4 CaCO3
某酸某
NaHCO3 Ca(HCO3)2
某酸氢某
NaH2PO4
某酸几氢某
Cu2(OH)2CO3 MgOHCl
碱式某酸某
2,按是否可溶于水:
可溶性盐:
难溶性盐:
NaCl MgCl2 CuSO4
CaCO3 AgCl BaSO4
3,按阴、阳离子来分:
阳离子:
阴离子:
K+ Na+ NH4+ Cu2+ Ca2+
NO3-- SO42-- Cl— CO32-- PO43--
化学反应
按反应物和生成物的类别以及反应前后物质的多少
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加
离子反应
非离子反应
按反应中是否有电子转移
氧化还原反应
非氧化还原反应
思考与讨论
酸与活泼金属的反应:
2Al +6HCl ====2AlCl + 3H ↑
酸与碱性氧化物反应:
CaO+2HCl=CaCl2+H2O
酸与碱反应:
HCl+NaOH=NaCl+H2O
酸与某些盐反应:
H2SO4+BaCl2=BaSO4↓+2HCl
为什么不同的酸(或碱)具有相似的化学性质?是因为他们在组成上具有相似性。
从微观角度来看,不同的酸溶液中都含有H+
,不同的碱溶液中都含有OH-。不同的碳酸盐溶液都含有碳酸根离子,所以不同的碳酸盐也具有相似的化学性质。
从反映类型来看,初中我们学过的酸与金属、盐与金属的反应属于置换反应,酸与碱、盐与酸、盐与碱、盐与盐之间的反应都属于复分解反应。
思考与讨论
写出下列物质之间的转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
Ca→CaO→Ca(OH)2→CaSO4
2Ca + O2 == 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+2H2O
C→CO2→H2CO3→CaCO3
C+O2= 点燃 =CO2
CO + H O === H CO
H2CO3+Ca(OH)2=CaCO3↓+2H2O
