苏教版高中化学选修四 2019-2020 专题三 第四 单元 难溶电解质的沉淀溶解平衡30张PPT
文档属性
| 名称 | 苏教版高中化学选修四 2019-2020 专题三 第四 单元 难溶电解质的沉淀溶解平衡30张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-14 08:40:16 | ||
图片预览







文档简介
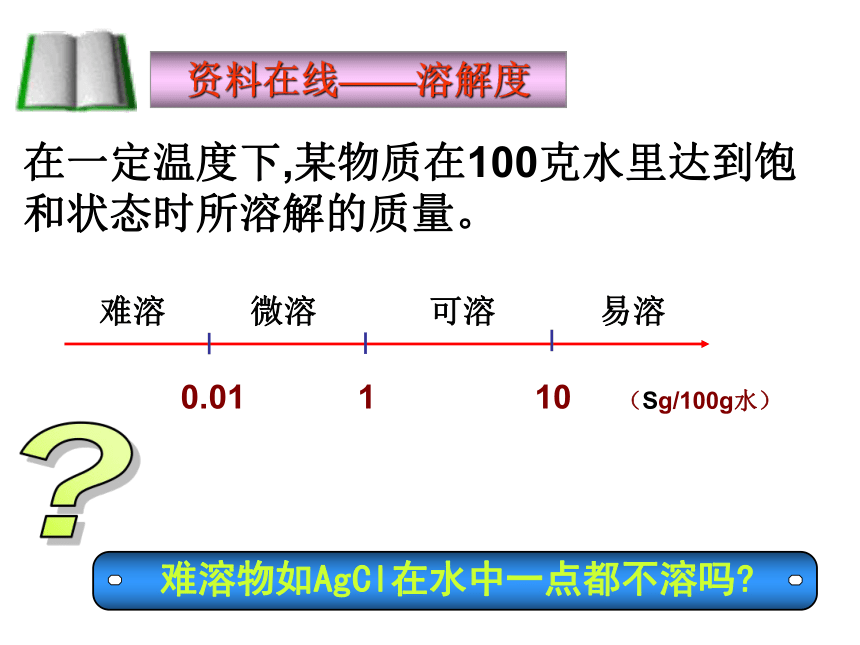
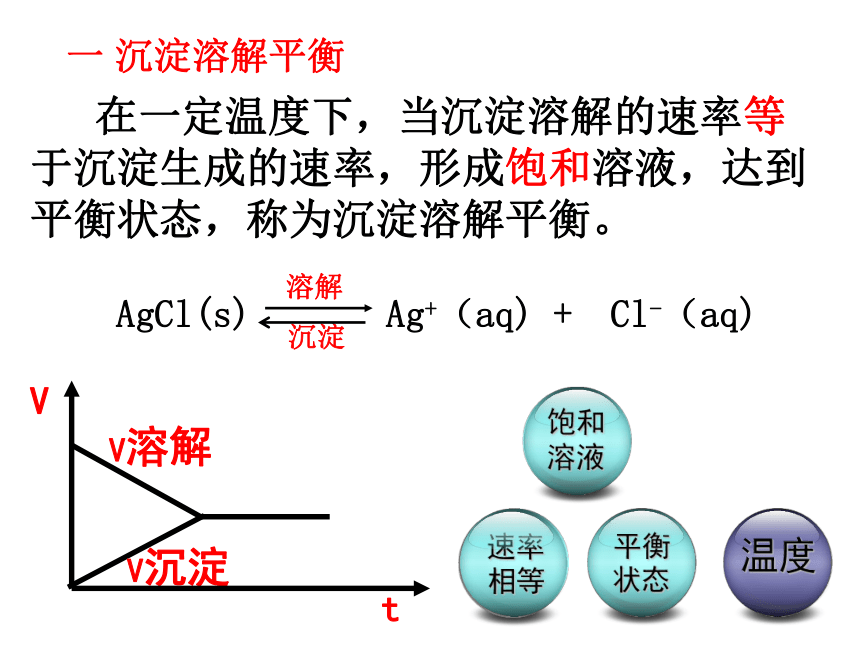
课件30张PPT。沉淀溶解平衡? 难溶物如AgCl在水中一点都不溶吗?资料在线——溶解度在一定温度下,某物质在100克水里达到饱和状态时所溶解的质量。一 沉淀溶解平衡 在一定温度下,当沉淀溶解的速率等于沉淀生成的速率,形成饱和溶液,达到平衡状态,称为沉淀溶解平衡。AgCl(s) Ag+(aq) + Cl-(aq) 溶解沉淀沉淀溶解平衡1书写如下难溶电解质的沉淀溶解平衡方程式:
PbI2 BaSO4 Fe(OH)3 2 判断正误:
(1)饱和溶液中,沉淀溶解为离子和离子结合成沉淀的过程都停止了.
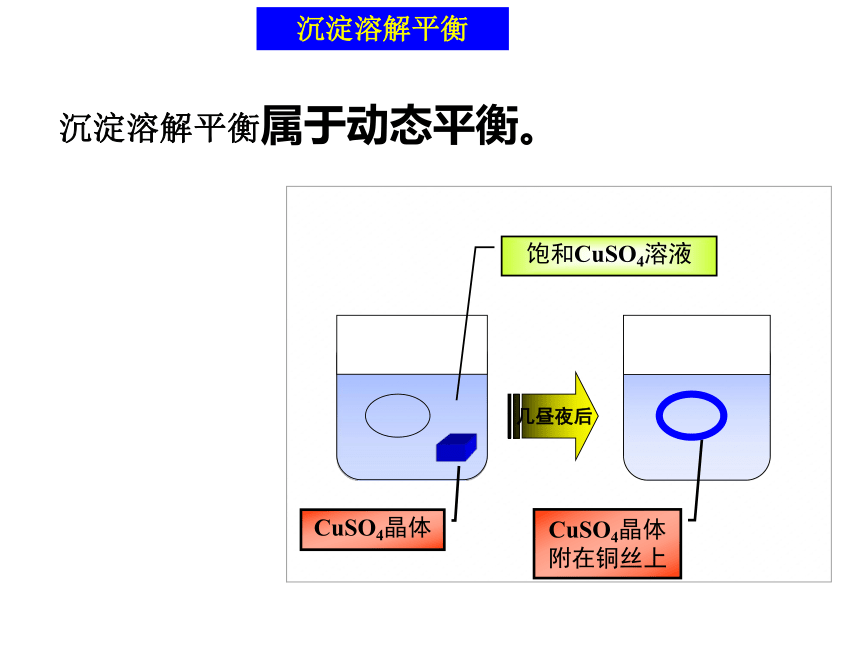
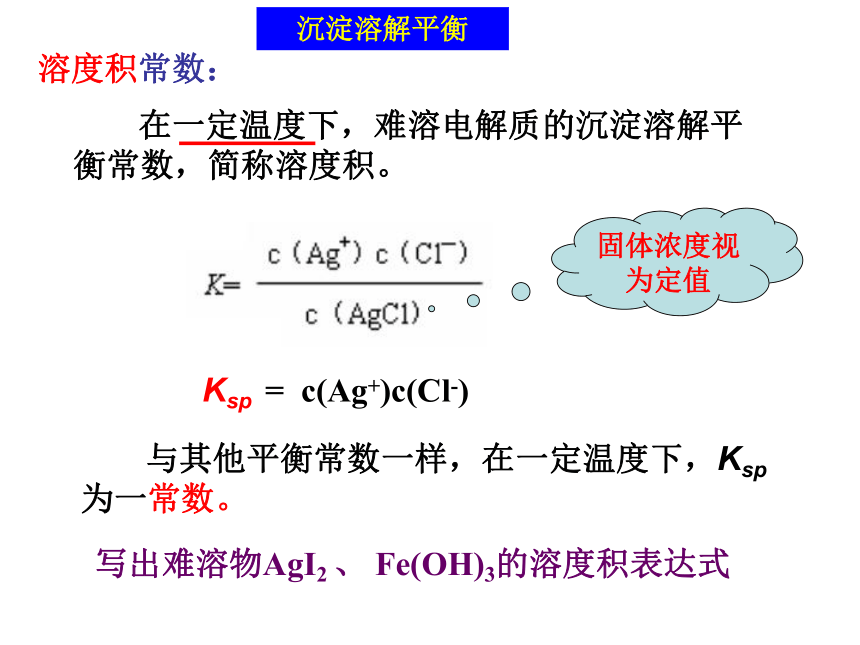
(2)一定条件下,当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化.沉淀溶解平衡属于动态平衡。几昼夜后饱和CuSO4溶液沉淀溶解平衡沉淀溶解平衡属于动态平衡。固体浓度视为定值 = c(Ag+)c(Cl-) Ksp 溶度积常数: 在一定温度下,难溶电解质的沉淀溶解平衡常数,简称溶度积。
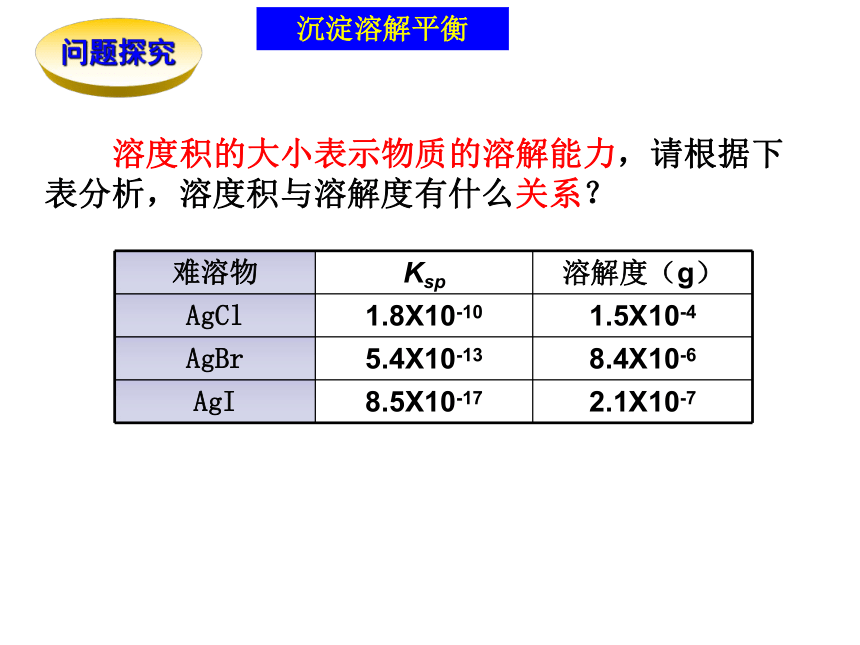
与其他平衡常数一样,在一定温度下,Ksp为一常数。写出难溶物AgI2 、 Fe(OH)3的溶度积表达式 沉淀溶解平衡问题探究 溶度积的大小表示物质的溶解能力,请根据下表分析,溶度积与溶解度有什么关系?
沉淀溶解平衡溶度积规则: 一定温度下,AgCl的溶度积为Ksp,
①当Qc = Ksp时,
②当Qc < Ksp时,
③当Qc > Ksp时,
已达沉淀溶解平衡,此时饱和溶液。右移,表现为沉淀正在不断溶解;此时溶液为不饱和;左移,表现为溶液中的离子不断沉淀出来;此时溶液为过饱和;沉淀溶解平衡课堂练习一沉淀溶解平衡请用溶度积规则解释沉淀溶解平衡的移动:
1 向PbI2(难溶于水)上层清液中滴加KI溶液会产生黄色沉淀,为什么?
2 将相同质量的AgCl(过量)分别溶于少量水和盐酸中,则水中C(Ag+)大于盐酸中C(Ag+),为什么? 课堂练习二1某温度下AgCl的KSP=1.8×10—10,将0.001mol/LNaCl溶液和0.001mol/LAgNO3溶液等体积混合,是否有AgCl沉淀生成? 沉淀溶解平衡解:等体积混合后, c(Ag+) 和c(Cl—)均减半,即
c(Ag+) = 0.001mol/L× 1/2
c(Cl—) = 0.001mol/L× 1/2
Qc = c (Ag+)× c(Cl—) = 2.5×10-7
Qc > Ksp ∴有沉淀析出。
答:能析出AgCl沉淀。课堂练习二沉淀溶解平衡练习:教材88页——问题解决2已知AgI的KSP=8.5×10—17, AgCl的KSP=1.8×10—10,在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? (假设加入的AgNO3浓度较大,引起的体积变化不计)课堂练习:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度
移动 溶解度 [Ag+] [Cl-]HCl(0.1 mol·L-1)→ 不变 不变 不变不移动 不变 不变 不变→ ↑ ↑ ↑ Ksp增大 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) 升温AgClH2O← ↓ ↓ ↑ 同离子效应沉淀溶解平衡的移动沉淀溶解平衡原理的应用教材P89——交流与讨论沉淀溶解平衡原理的应用一用沉淀溶解平衡的原理解释沉淀的生成沉淀溶解平衡原理的应用二用沉淀溶解平衡的原理解释沉淀的溶解1 CaCO3难溶于水,但可溶于盐酸,为什么?
2 阅读教材P89——问题解决;解释为什么糖吃多了易患龋齿?
3 石灰石岩的主要成分是CaCO3 ;石灰石岩层在经历了数万年的岁月侵蚀后,会形成美丽的溶洞,其原理是什么?沉淀溶解平衡原理的应用溶洞的形成:水滴石穿教材P90——活动与探究沉淀溶解平衡原理的应用三用沉淀溶解平衡的原理解释沉淀的转化教材P91——交流与讨论沉淀转化的实质是沉淀溶解平衡的移动;一般来说,溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。 沉淀溶解平衡原理的应用三用沉淀溶解平衡的原理解释沉淀的转化1 阅读教材P89——问题解决;解释为什么使用含氟牙膏能防止龋齿?
2 重晶石BaSO4用饱和Na2CO3溶液处理转化为BaCO3 ?
3 分析BaSO4到BaCO3的反应,认识工业上“多次重复”的重要性?沉淀溶解平衡原理的应用四用分步沉淀的方法分离或除去某些离子例题:在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? 两种沉淀能否有效分离?(Ksp(AgI)=8.5×10—17; Ksp(AgCl)=1.8×10—10 )两种沉淀的溶度积相差越大,分离越完全。 注:通常当溶液中被沉淀离子浓度小于10—5mol/L时即可认为沉淀完全了 例 计算298K时使0.010mol·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。已知Fe(OH)3的Ksp=2.64×10-39。解: Fe(OH)3 (s) Fe3+ + 3OH-⑴开始沉淀∵ [Fe3+][OH-]3 =Ksp∴ pH = 1.81研究:金属氢氧化物沉淀的生成⑵ 沉淀完全[Fe3+] ≤ 10-5 mol·L-1∴ pH =2.81注:由此可见:①氢氧化物沉淀不一定在碱性环境;②不同氢氧化物的Ksp值不同,沉淀的pH值也不同,因此可通过控制pH值分离金属离子。研究:金属氢氧化物沉淀的生成 某溶液中Fe3+和Mg2+的浓度均为0.10mol/L,求算使Fe3+沉淀完全而Mg2+不沉淀的pH?
(Ksp(Fe(OH)3)=4.0×10-39; Ksp(Mg(OH)2)=1.8×10-11 )pH = 2.9解: Fe(OH)3 Fe3+ + 3OH-
Ksp = [Fe3+][OH-]3 = 4.0 ×10-39
Fe3+ 沉淀完全时的[OH-]为:四用分步沉淀的方法分离或除去某些离子Mg2+开始沉淀的pH值为: pH =9.1
因此, 只要控制pH值在2.9 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。沉淀溶解平衡原理的应用四用分步沉淀的方法分离或除去某些离子溶洞 石笋 风景欣赏实验探究 如何设计实验验证难溶电解质PbI2
在水中仍能极少量的溶解? PbI2实验探究 取上层清液1~2ml,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。 [方案一] 另取上层清液于试管中,逐滴加入KI溶液,有何现象?[方案二]AgI、 PbI2的生成又说明了什么呢?溶液还是澄清的吗?根据颜色推测沉淀是什么?难溶物也可以有少量的溶解实验结论石笋的形成:滴水成石溶度积常数(见p419附表6)
PbI2 BaSO4 Fe(OH)3 2 判断正误:
(1)饱和溶液中,沉淀溶解为离子和离子结合成沉淀的过程都停止了.
(2)一定条件下,当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化.沉淀溶解平衡属于动态平衡。几昼夜后饱和CuSO4溶液沉淀溶解平衡沉淀溶解平衡属于动态平衡。固体浓度视为定值 = c(Ag+)c(Cl-) Ksp 溶度积常数: 在一定温度下,难溶电解质的沉淀溶解平衡常数,简称溶度积。
与其他平衡常数一样,在一定温度下,Ksp为一常数。写出难溶物AgI2 、 Fe(OH)3的溶度积表达式 沉淀溶解平衡问题探究 溶度积的大小表示物质的溶解能力,请根据下表分析,溶度积与溶解度有什么关系?
沉淀溶解平衡溶度积规则: 一定温度下,AgCl的溶度积为Ksp,
①当Qc = Ksp时,
②当Qc < Ksp时,
③当Qc > Ksp时,
已达沉淀溶解平衡,此时饱和溶液。右移,表现为沉淀正在不断溶解;此时溶液为不饱和;左移,表现为溶液中的离子不断沉淀出来;此时溶液为过饱和;沉淀溶解平衡课堂练习一沉淀溶解平衡请用溶度积规则解释沉淀溶解平衡的移动:
1 向PbI2(难溶于水)上层清液中滴加KI溶液会产生黄色沉淀,为什么?
2 将相同质量的AgCl(过量)分别溶于少量水和盐酸中,则水中C(Ag+)大于盐酸中C(Ag+),为什么? 课堂练习二1某温度下AgCl的KSP=1.8×10—10,将0.001mol/LNaCl溶液和0.001mol/LAgNO3溶液等体积混合,是否有AgCl沉淀生成? 沉淀溶解平衡解:等体积混合后, c(Ag+) 和c(Cl—)均减半,即
c(Ag+) = 0.001mol/L× 1/2
c(Cl—) = 0.001mol/L× 1/2
Qc = c (Ag+)× c(Cl—) = 2.5×10-7
Qc > Ksp ∴有沉淀析出。
答:能析出AgCl沉淀。课堂练习二沉淀溶解平衡练习:教材88页——问题解决2已知AgI的KSP=8.5×10—17, AgCl的KSP=1.8×10—10,在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? (假设加入的AgNO3浓度较大,引起的体积变化不计)课堂练习:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度
移动 溶解度 [Ag+] [Cl-]HCl(0.1 mol·L-1)→ 不变 不变 不变不移动 不变 不变 不变→ ↑ ↑ ↑ Ksp增大 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) 升温AgClH2O← ↓ ↓ ↑ 同离子效应沉淀溶解平衡的移动沉淀溶解平衡原理的应用教材P89——交流与讨论沉淀溶解平衡原理的应用一用沉淀溶解平衡的原理解释沉淀的生成沉淀溶解平衡原理的应用二用沉淀溶解平衡的原理解释沉淀的溶解1 CaCO3难溶于水,但可溶于盐酸,为什么?
2 阅读教材P89——问题解决;解释为什么糖吃多了易患龋齿?
3 石灰石岩的主要成分是CaCO3 ;石灰石岩层在经历了数万年的岁月侵蚀后,会形成美丽的溶洞,其原理是什么?沉淀溶解平衡原理的应用溶洞的形成:水滴石穿教材P90——活动与探究沉淀溶解平衡原理的应用三用沉淀溶解平衡的原理解释沉淀的转化教材P91——交流与讨论沉淀转化的实质是沉淀溶解平衡的移动;一般来说,溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。 沉淀溶解平衡原理的应用三用沉淀溶解平衡的原理解释沉淀的转化1 阅读教材P89——问题解决;解释为什么使用含氟牙膏能防止龋齿?
2 重晶石BaSO4用饱和Na2CO3溶液处理转化为BaCO3 ?
3 分析BaSO4到BaCO3的反应,认识工业上“多次重复”的重要性?沉淀溶解平衡原理的应用四用分步沉淀的方法分离或除去某些离子例题:在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? 两种沉淀能否有效分离?(Ksp(AgI)=8.5×10—17; Ksp(AgCl)=1.8×10—10 )两种沉淀的溶度积相差越大,分离越完全。 注:通常当溶液中被沉淀离子浓度小于10—5mol/L时即可认为沉淀完全了 例 计算298K时使0.010mol·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。已知Fe(OH)3的Ksp=2.64×10-39。解: Fe(OH)3 (s) Fe3+ + 3OH-⑴开始沉淀∵ [Fe3+][OH-]3 =Ksp∴ pH = 1.81研究:金属氢氧化物沉淀的生成⑵ 沉淀完全[Fe3+] ≤ 10-5 mol·L-1∴ pH =2.81注:由此可见:①氢氧化物沉淀不一定在碱性环境;②不同氢氧化物的Ksp值不同,沉淀的pH值也不同,因此可通过控制pH值分离金属离子。研究:金属氢氧化物沉淀的生成 某溶液中Fe3+和Mg2+的浓度均为0.10mol/L,求算使Fe3+沉淀完全而Mg2+不沉淀的pH?
(Ksp(Fe(OH)3)=4.0×10-39; Ksp(Mg(OH)2)=1.8×10-11 )pH = 2.9解: Fe(OH)3 Fe3+ + 3OH-
Ksp = [Fe3+][OH-]3 = 4.0 ×10-39
Fe3+ 沉淀完全时的[OH-]为:四用分步沉淀的方法分离或除去某些离子Mg2+开始沉淀的pH值为: pH =9.1
因此, 只要控制pH值在2.9 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。沉淀溶解平衡原理的应用四用分步沉淀的方法分离或除去某些离子溶洞 石笋 风景欣赏实验探究 如何设计实验验证难溶电解质PbI2
在水中仍能极少量的溶解? PbI2实验探究 取上层清液1~2ml,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。 [方案一] 另取上层清液于试管中,逐滴加入KI溶液,有何现象?[方案二]AgI、 PbI2的生成又说明了什么呢?溶液还是澄清的吗?根据颜色推测沉淀是什么?难溶物也可以有少量的溶解实验结论石笋的形成:滴水成石溶度积常数(见p419附表6)
