《氧化剂和还原剂》(鲁科版必修1)32ppt
文档属性
| 名称 | 《氧化剂和还原剂》(鲁科版必修1)32ppt |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-12 20:01:14 | ||
图片预览






文档简介
课件32张PPT。普通高中课程标准实验教科书 化学1(必修)第二章第三节 氧化剂与还原剂0:29:001【第一课时】氧化还原反应1、什么是氧化还原反应?
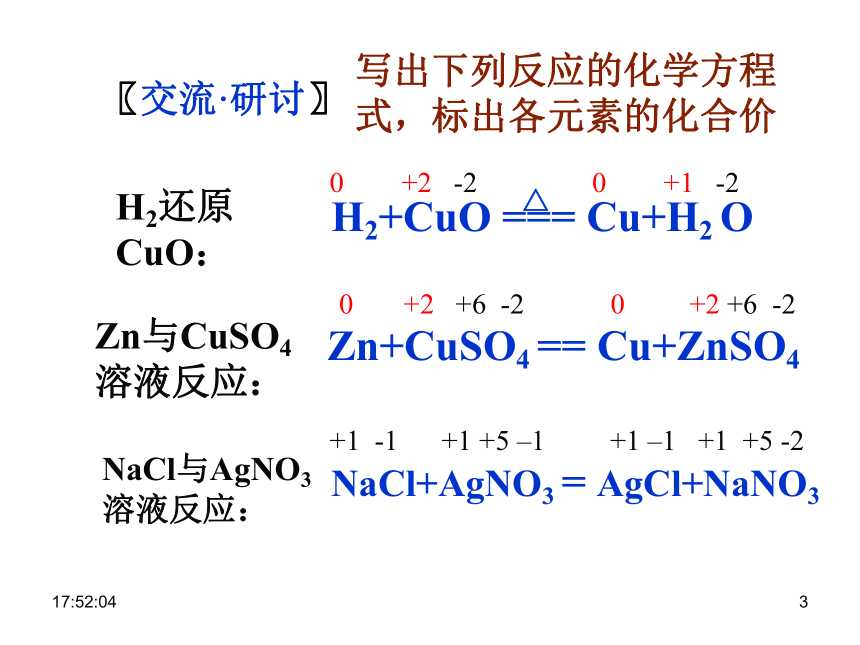
2、氧化还原反应的本质是什么?0:29:001〖交流·研讨〗写出下列反应的化学方程
式,标出各元素的化合价NaCl与AgNO3
溶液反应:H2还原
CuO:Zn与CuSO4
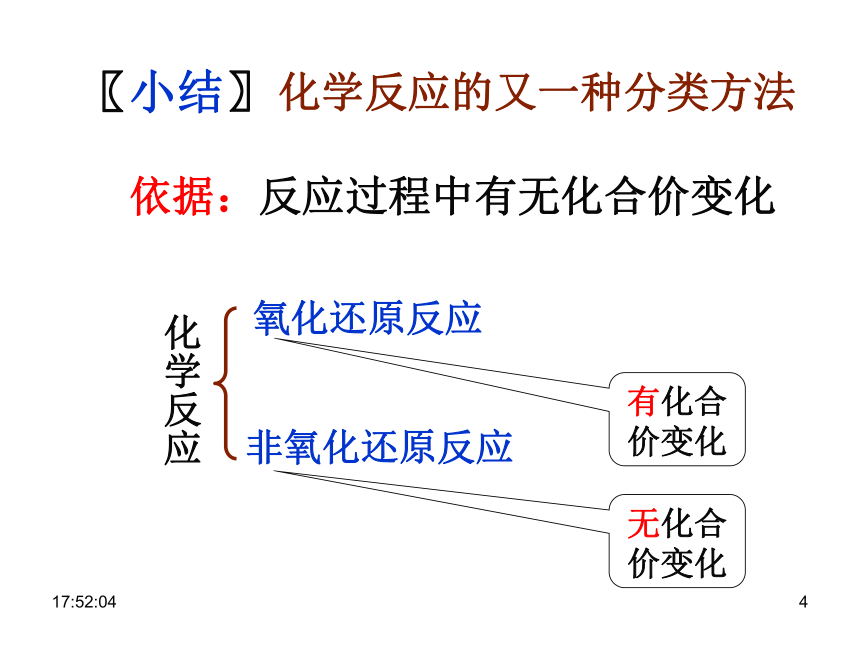
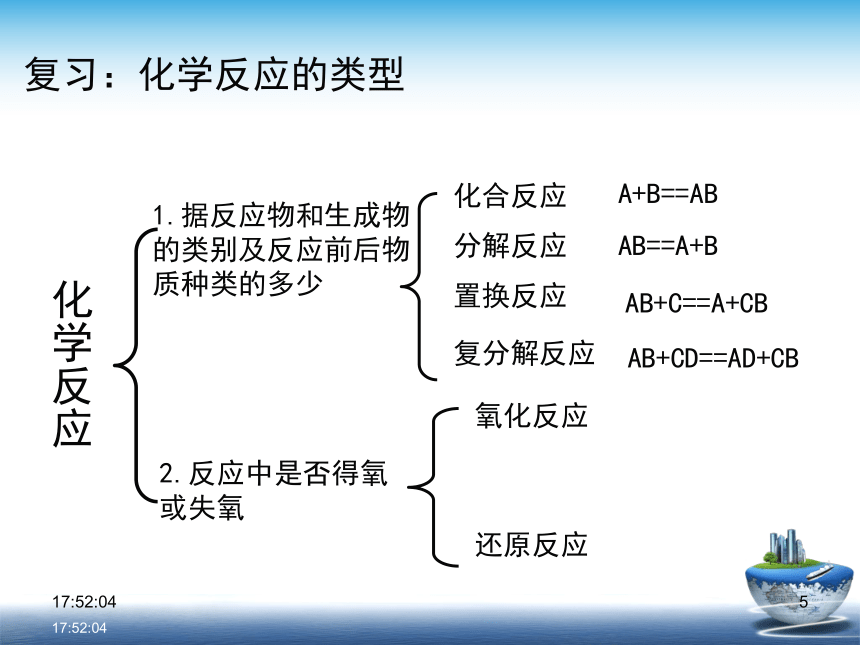
溶液反应:+1 -1 +1 +5 –1 +1 –1 +1 +5 -2 0 +2 -2 0 +1 -20 +2 +6 -2 0 +2 +6 -20:29:001〖小结〗化学反应的又一种分类方法化学反应依据:反应过程中有无化合价变化0:29:001复习:化学反应的类型化学反应1.据反应物和生成物的类别及反应前后物质种类的多少2.反应中是否得氧或失氧氧化反应还原反应0:29:0110:29:01CaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × 0:29:011化学反应 氧化还原反应与四种
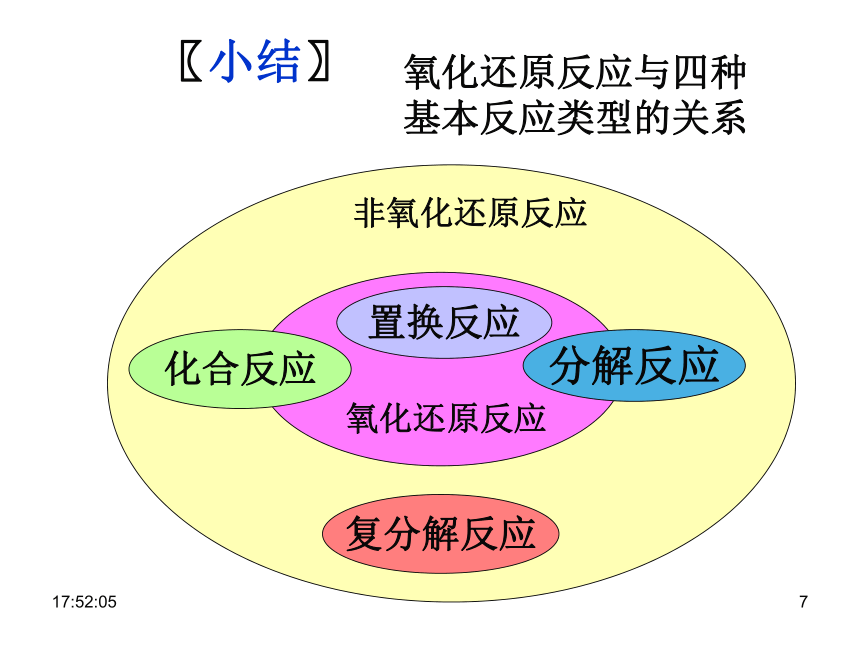
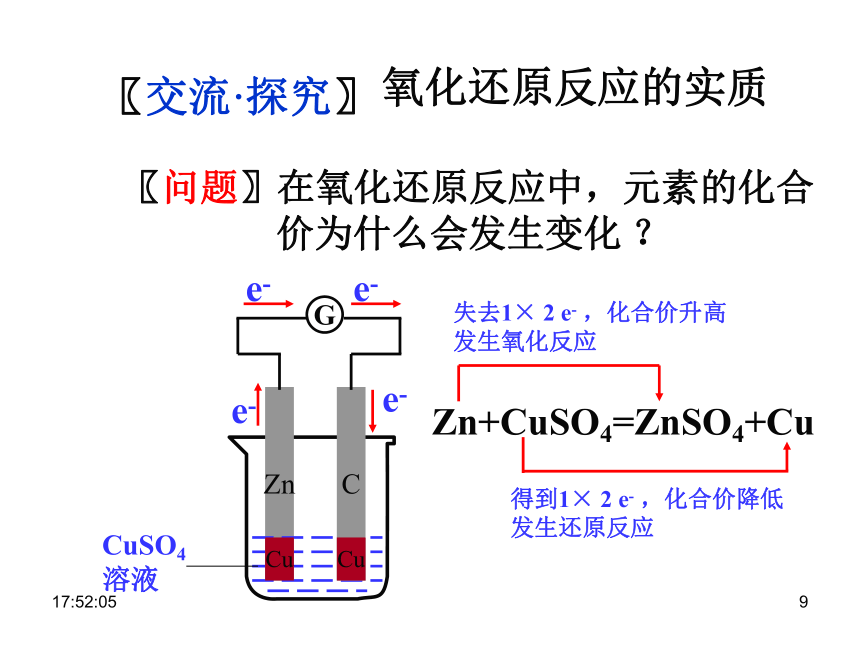
基本反应类型的关系〖小结〗复分解反应分解反应化合反应置换反应0:29:011〖交流·研讨〗0:29:011〖交流·探究〗〖问题〗在氧化还原反应中,元素的化合
价为什么会发生变化 ?氧化还原反应的实质ZnCuCCuZn+CuSO4=ZnSO4+Cu0:29:011〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
⑶失e- → 化合价升高 → 发生氧化反应
得e- → 化合价降低 → 发生 还原反应0:29:011〖做一做〗 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
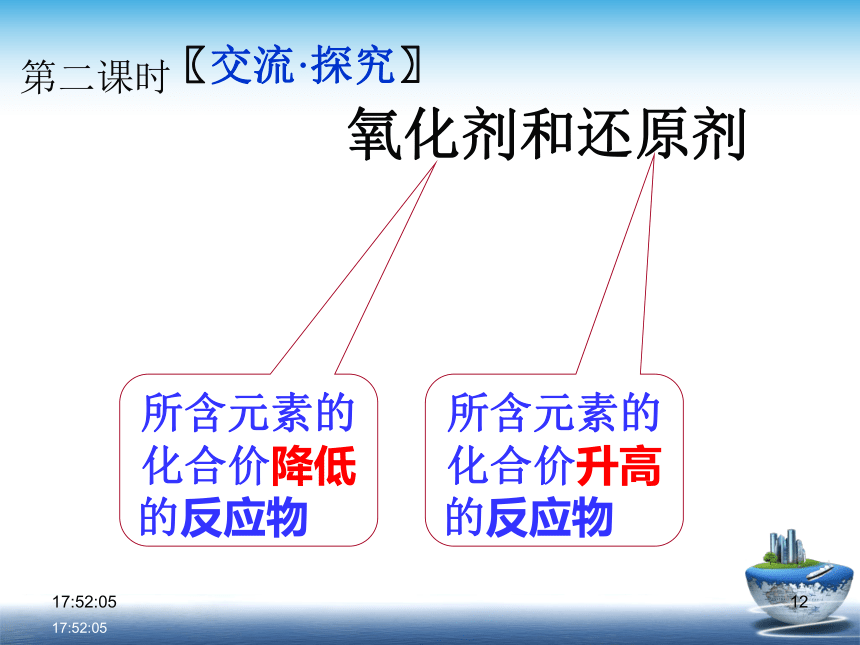
降低了?指出含有这些元素的具体物质。0:29:011〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 第二课时0:29:0110:29:01 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧
化剂?哪些是还原剂? 〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应0:29:0110:29:01〖交流·探究〗从电子转移的观点说明氧化
剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
0:29:0110:29:01〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系[演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂0:29:0110:29:01〖小结〗含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性
又有还原性。 0:29:0110:29:01〖做一做〗O2、Cl2、 HNO3、浓H2SO4、Fe3+
Na、Cu、C、 H2、 S2-
HCl 、SO2、H2O2在一般情况下,下列物质在化学反应中
是氧化剂,还是还原剂?0:29:0110:29:01〖迁移·应用〗常见的氧化剂和还原剂 活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐活泼非金属单质
含有较高价态无素的含氧酸
含有较高价态元素的盐0:29:0110:29:01常见的氧化剂和还原剂:氧气、氯气、次氯酸、硝酸、浓硫酸、高锰酸钾( KMnO4 )、氯化铁( FeCl3 )、臭氧等铁、钠、锌、氢气、碳、CO、亚硫酸钠(Na2SO3)、SO2 、Na2S、KI、硫酸亚铁(FeSO4)等氧化剂还原剂0:29:0110:29:01〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应对立统
一关系的两根推断线0:29:0110:29:010:29:01 探究铁及其化合物的氧化性和还原性
第三课时0:29:0110:29:01自然界中的铁单质新疆陨铁南极洲陨铁0:29:0210:29:02含铁元素的矿物黄铁矿
磁铁矿赤铁矿(主要成分为FeS2)(主要成分为Fe2O3)(主要成分为Fe3O4 )0:29:021铁的锈蚀工厂炼铁0:29:0210:29:020:29:02实验室里的含铁试剂FeSO4·7H2O
(绿矾)FeCl3·6H2OFe(OH)3 沉淀0:29:0210:29:02铁的存在形态及其化合价金属铁FeO﹑Fe(OH)2﹑FeCl2 ﹑ FeSO4·7H2O 等
Fe2O3﹑Fe(OH)3﹑Fe2(SO4)3﹑ FeCl3·6H2O 等
0:29:0210:29:02研究物质的基本程序观察物质的外观性质预测物质的性质实验和观察解释和结论方法引导0:29:021活动探究 Fe 有还原性
Fe3+ 有氧化性
Fe2+ 既有氧化性又有还原性0:29:02 铁及其化合物的氧化性和还原性 以Fe、 FeCl2 、 FeCl3为例进行探究 预测:0:29:0210:29:02实 验 方 案1 探究铁单质的还原性:3 探究 Fe 2+的氧化性:4 探究Fe2+还原性:2 探究 Fe3+的氧化性:结论:铁单质有还原性。结论:Fe3+有氧化性。结论:Fe2+有氧化性。结论:Fe2+有还原性。0:29:021Fe3+Fe2+ Fe0:29:02Fe、 Fe2+ 、 Fe3+的转换关系 还原剂:Zn,Mg等还原剂: Fe, Cu等氧化剂: 稀HNO3, 氯水等 还原剂:Zn,Mg等0:29:0210:29:02问 题 探 索 检验补铁保健食品中铁元素的化合价
请你设计实验探究补铁保健食品中铁元素的化合价
你所选用的试剂和仪器:
你的实验步骤和实验记录:0:29:0210:29:02 要除去FeCl2 溶液中的少量FeCl3 ,可行的办法是:
A 加入KSCN溶液 B 通入氯气
C 加入铜粉 D 加入铁粉
问 题 探 索0:29:021
2、氧化还原反应的本质是什么?0:29:001〖交流·研讨〗写出下列反应的化学方程
式,标出各元素的化合价NaCl与AgNO3
溶液反应:H2还原
CuO:Zn与CuSO4
溶液反应:+1 -1 +1 +5 –1 +1 –1 +1 +5 -2 0 +2 -2 0 +1 -20 +2 +6 -2 0 +2 +6 -20:29:001〖小结〗化学反应的又一种分类方法化学反应依据:反应过程中有无化合价变化0:29:001复习:化学反应的类型化学反应1.据反应物和生成物的类别及反应前后物质种类的多少2.反应中是否得氧或失氧氧化反应还原反应0:29:0110:29:01CaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × 0:29:011化学反应 氧化还原反应与四种
基本反应类型的关系〖小结〗复分解反应分解反应化合反应置换反应0:29:011〖交流·研讨〗0:29:011〖交流·探究〗〖问题〗在氧化还原反应中,元素的化合
价为什么会发生变化 ?氧化还原反应的实质ZnCuCCuZn+CuSO4=ZnSO4+Cu0:29:011〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
⑶失e- → 化合价升高 → 发生氧化反应
得e- → 化合价降低 → 发生 还原反应0:29:011〖做一做〗 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
降低了?指出含有这些元素的具体物质。0:29:011〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 第二课时0:29:0110:29:01 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧
化剂?哪些是还原剂? 〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应0:29:0110:29:01〖交流·探究〗从电子转移的观点说明氧化
剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
0:29:0110:29:01〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系[演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂0:29:0110:29:01〖小结〗含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性
又有还原性。 0:29:0110:29:01〖做一做〗O2、Cl2、 HNO3、浓H2SO4、Fe3+
Na、Cu、C、 H2、 S2-
HCl 、SO2、H2O2在一般情况下,下列物质在化学反应中
是氧化剂,还是还原剂?0:29:0110:29:01〖迁移·应用〗常见的氧化剂和还原剂 活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐活泼非金属单质
含有较高价态无素的含氧酸
含有较高价态元素的盐0:29:0110:29:01常见的氧化剂和还原剂:氧气、氯气、次氯酸、硝酸、浓硫酸、高锰酸钾( KMnO4 )、氯化铁( FeCl3 )、臭氧等铁、钠、锌、氢气、碳、CO、亚硫酸钠(Na2SO3)、SO2 、Na2S、KI、硫酸亚铁(FeSO4)等氧化剂还原剂0:29:0110:29:01〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应对立统
一关系的两根推断线0:29:0110:29:010:29:01 探究铁及其化合物的氧化性和还原性
第三课时0:29:0110:29:01自然界中的铁单质新疆陨铁南极洲陨铁0:29:0210:29:02含铁元素的矿物黄铁矿
磁铁矿赤铁矿(主要成分为FeS2)(主要成分为Fe2O3)(主要成分为Fe3O4 )0:29:021铁的锈蚀工厂炼铁0:29:0210:29:020:29:02实验室里的含铁试剂FeSO4·7H2O
(绿矾)FeCl3·6H2OFe(OH)3 沉淀0:29:0210:29:02铁的存在形态及其化合价金属铁FeO﹑Fe(OH)2﹑FeCl2 ﹑ FeSO4·7H2O 等
Fe2O3﹑Fe(OH)3﹑Fe2(SO4)3﹑ FeCl3·6H2O 等
0:29:0210:29:02研究物质的基本程序观察物质的外观性质预测物质的性质实验和观察解释和结论方法引导0:29:021活动探究 Fe 有还原性
Fe3+ 有氧化性
Fe2+ 既有氧化性又有还原性0:29:02 铁及其化合物的氧化性和还原性 以Fe、 FeCl2 、 FeCl3为例进行探究 预测:0:29:0210:29:02实 验 方 案1 探究铁单质的还原性:3 探究 Fe 2+的氧化性:4 探究Fe2+还原性:2 探究 Fe3+的氧化性:结论:铁单质有还原性。结论:Fe3+有氧化性。结论:Fe2+有氧化性。结论:Fe2+有还原性。0:29:021Fe3+Fe2+ Fe0:29:02Fe、 Fe2+ 、 Fe3+的转换关系 还原剂:Zn,Mg等还原剂: Fe, Cu等氧化剂: 稀HNO3, 氯水等 还原剂:Zn,Mg等0:29:0210:29:02问 题 探 索 检验补铁保健食品中铁元素的化合价
请你设计实验探究补铁保健食品中铁元素的化合价
你所选用的试剂和仪器:
你的实验步骤和实验记录:0:29:0210:29:02 要除去FeCl2 溶液中的少量FeCl3 ,可行的办法是:
A 加入KSCN溶液 B 通入氯气
C 加入铜粉 D 加入铁粉
问 题 探 索0:29:021
