人教版高中化学必修一第四章《非金属及其化合物》单元检测题(解析版)
文档属性
| 名称 | 人教版高中化学必修一第四章《非金属及其化合物》单元检测题(解析版) | 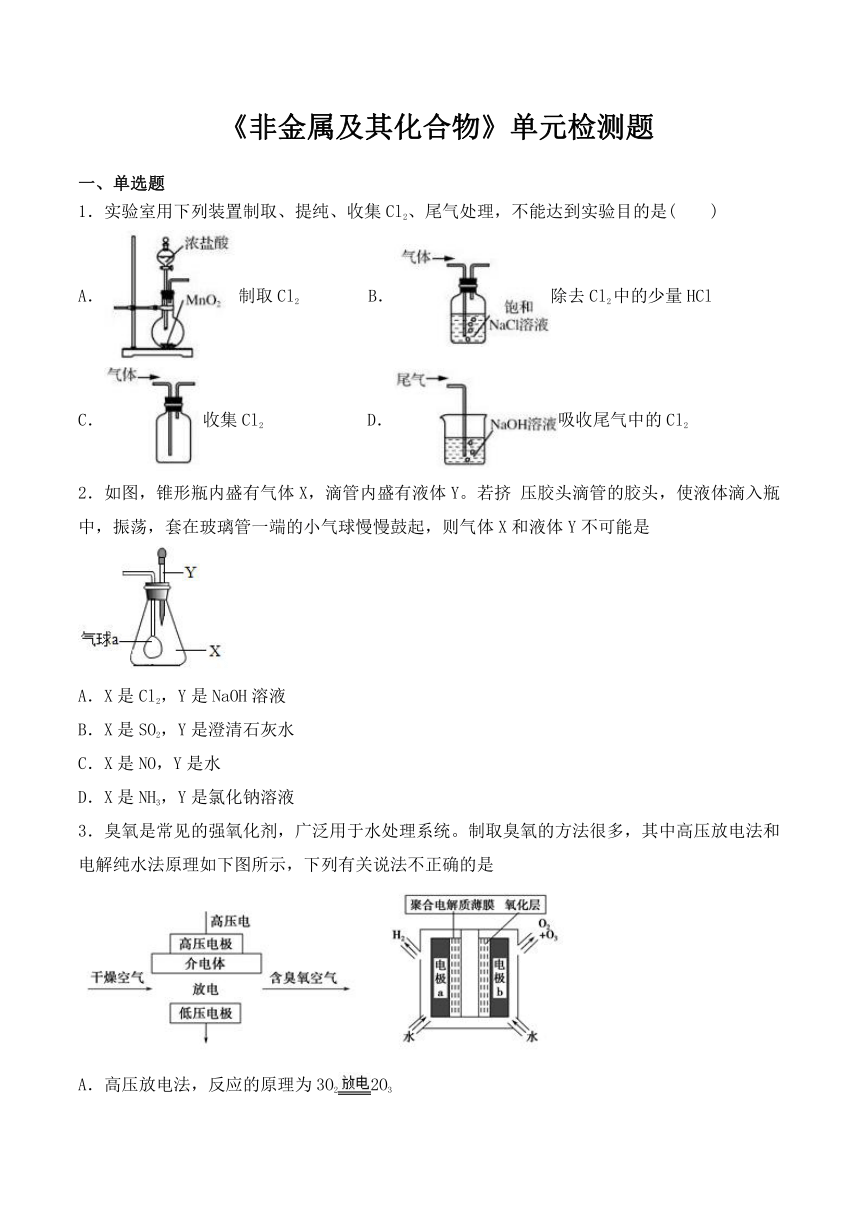 | |
| 格式 | zip | ||
| 文件大小 | 405.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-16 15:33:56 | ||
图片预览




文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
《非金属及其化合物》单元检测题
一、单选题
1.实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( )
A.制取Cl2 B.除去Cl2中的少量HCl
C.收集Cl2 D.吸收尾气中的Cl2
2.如图,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤 压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是
A.X是Cl2,Y是NaOH溶液
B.X是SO2,Y是澄清石灰水
C.X是NO,Y是水
D.X是NH3,Y是氯化钠溶液
3.臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是
A.高压放电法,反应的原理为3O22O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解时,由电极经聚合固体电解质膜流向电极
D.电解时,电极周围发生的电极反应有和
4.由SiO2制备高纯度硅的工业流程如图所示:
下列说法错误的是
A.SiO2与纯硅都是硬度大、熔沸点高的晶体
B.X为CO气体
C.反应②产生的H2与反应③产生的HCl可以循环使用
D.反应①②③均为在高温条件下的非氧化还原反应
5.关于下列图示的说法中正确的是
A.该反应为吸热反应 B.形成铜锌原电池
C.实验室制氯气 D.收集氯气
6.化学和日常生活息息相关,下列化学常识错误的是
A.生理盐水是0.9%的NaCl浓液
B.纯碱的主要成分是NaHCO3,可以用来洗涤厨房油污
C.夜晚回家时,发现家里天然气泄漏,首先要开门开窗
D.“84”消毒液的有效成分为NaClO,它与洁厕灵 (主要成分为盐酸)混合会生成氯气
7.下列反应属于人工固氮的是
A.N2 和 H2 在一定条件下反应生成 NH3
B.雷雨闪电时空气中的 N2 和 O2 化合生成 NO
C.用 NH3 和 CO2 合成尿素
D.用硫酸吸收氨气得到硫酸铵
8.下列用品的有效成分与用途对应有错误的是
A B C D
用品
有效成分 NaCl Na2SiO3 Al(OH)3 NaClO
用途 作调味品 刻蚀玻璃 可作抗酸药 作消毒剂
A.A B.B C.C D.D
9.下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓
B.铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑
C.氯气与水反应:Cl2 + H2O =2H+ +C1- + ClO-
D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+
10.能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2通入可溶性硅酸盐中析出硅酸沉淀
B.CO2溶于水形成碳酸,SiO2难溶于水
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,HCl通入可溶性硅酸盐溶液中生成沉淀
11.下列气体溶解于水,没有发生氧化还原反应的是( )
A.SO2溶解于水 B.NO2溶解于水 C.F2溶解于水 D.Cl2溶解于水
12.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中可能含CO32-、SO42-、NO3-
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
二、实验题
13.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 氯水 氨水
沉淀的化学式 ________ ________
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
14.某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
已知:氮化镁易跟水发生反应;装置B中发生的主要反应为:3Br2+2NH3=6HBr+N2、HBr+NH3=NH4Br。
实验步骤及现象:
①连接仪器并检查装置的气密性。
②通入惰性气体。
③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④点燃酒精灯,观察E中固体变成了黄绿色。
回答下列问题:
(1)A装置中仪器a的名称为______,通入惰性气体的目的是__________________。
(2)装置C的作用是______________________。
(3)D装置中的P2O5是一种非氧化性的酸性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______。
a.NH3 b. HI c. SO2 d. CO2
(4)E装置中发生反应的化学方程式为:___________________________。
(5)此装置中存在着明显缺陷,你的改进措施是_________________________。
三、推断题
15.如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
16.已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
四、计算题
17.在4mol/L的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,则①原混合酸中c( H+)为________________。
②溶液中发生反应的离子方程式为_______。
③充分反应后最多可收集到标准状况下的气体的体积为__________,被还原硝酸的物质的量为_____________________________。
18.某同学购买了一瓶“84消毒液”,包装说明如下。请根据说明信息和相关知识分析:
(1)该“84消毒液”中,NaClO的物质的量浓度约为_______ mol/L(保留至小数点后一位)
(2)某化学课外活动小组计划使用NaOH溶液制取消毒液,反应原理为:Cl2+2NaOH=NaCl+ NaClO+H2O。制取时,需要多少升4.0mol/L的NaOH溶液才能与2.24L(标准状况下)的氯气恰好完全反应_________。(简要计算过程)
19.含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应(假设硝酸只被还原为NO),所得氧化产物与铁粉物质的量的关系如图所示,回答下列问题:
(1)曲线a表示_______________,曲线b表示_____________(填Fe2+或 Fe3+)
(2)Q点时反应的离子方程式为__________________________________________
(3)n3︰n1=________________
参考答案
1.A 2.C 3.C 4.D 5.D 6.B 7.A 8.B 9.D 10.A 11.A 12.B
13.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O B试管中品红溶液褪色 BaSO4 BaSO3 SO2+Cl2+2H2O===4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-) 除去剩余的SO2(或尾气处理) 当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡
14.分液漏斗 排除装置中的空气 吸收氮气中混有的HBr(Br2)气体 b N2+3MgMg3N2 在E后连接装有碱石灰的干燥管,防止空气中的水蒸气进入E装置中
15.CO2 CaCl2 HClO O2 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO ①⑤
16.Cl2 NH3 NO NaOH H++ClO-=HClO NH3+H2ONH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
17.10mol/L 3Cu+8H++2NO3-=2NO↑+4H2O+3Cu2+ 224mL 0.01mol
18.4.0mol/L 0.05L
19.Fe3+ Fe2+ Fe+4?H++NO3-=Fe3++NO↑+2H2O 3:2
答案第1页,总2页
《非金属及其化合物》单元检测题
一、单选题
1.实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( )
A.制取Cl2 B.除去Cl2中的少量HCl
C.收集Cl2 D.吸收尾气中的Cl2
2.如图,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤 压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是
A.X是Cl2,Y是NaOH溶液
B.X是SO2,Y是澄清石灰水
C.X是NO,Y是水
D.X是NH3,Y是氯化钠溶液
3.臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是
A.高压放电法,反应的原理为3O22O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解时,由电极经聚合固体电解质膜流向电极
D.电解时,电极周围发生的电极反应有和
4.由SiO2制备高纯度硅的工业流程如图所示:
下列说法错误的是
A.SiO2与纯硅都是硬度大、熔沸点高的晶体
B.X为CO气体
C.反应②产生的H2与反应③产生的HCl可以循环使用
D.反应①②③均为在高温条件下的非氧化还原反应
5.关于下列图示的说法中正确的是
A.该反应为吸热反应 B.形成铜锌原电池
C.实验室制氯气 D.收集氯气
6.化学和日常生活息息相关,下列化学常识错误的是
A.生理盐水是0.9%的NaCl浓液
B.纯碱的主要成分是NaHCO3,可以用来洗涤厨房油污
C.夜晚回家时,发现家里天然气泄漏,首先要开门开窗
D.“84”消毒液的有效成分为NaClO,它与洁厕灵 (主要成分为盐酸)混合会生成氯气
7.下列反应属于人工固氮的是
A.N2 和 H2 在一定条件下反应生成 NH3
B.雷雨闪电时空气中的 N2 和 O2 化合生成 NO
C.用 NH3 和 CO2 合成尿素
D.用硫酸吸收氨气得到硫酸铵
8.下列用品的有效成分与用途对应有错误的是
A B C D
用品
有效成分 NaCl Na2SiO3 Al(OH)3 NaClO
用途 作调味品 刻蚀玻璃 可作抗酸药 作消毒剂
A.A B.B C.C D.D
9.下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓
B.铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑
C.氯气与水反应:Cl2 + H2O =2H+ +C1- + ClO-
D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+
10.能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2通入可溶性硅酸盐中析出硅酸沉淀
B.CO2溶于水形成碳酸,SiO2难溶于水
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,HCl通入可溶性硅酸盐溶液中生成沉淀
11.下列气体溶解于水,没有发生氧化还原反应的是( )
A.SO2溶解于水 B.NO2溶解于水 C.F2溶解于水 D.Cl2溶解于水
12.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中可能含CO32-、SO42-、NO3-
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
二、实验题
13.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 氯水 氨水
沉淀的化学式 ________ ________
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
14.某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
已知:氮化镁易跟水发生反应;装置B中发生的主要反应为:3Br2+2NH3=6HBr+N2、HBr+NH3=NH4Br。
实验步骤及现象:
①连接仪器并检查装置的气密性。
②通入惰性气体。
③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④点燃酒精灯,观察E中固体变成了黄绿色。
回答下列问题:
(1)A装置中仪器a的名称为______,通入惰性气体的目的是__________________。
(2)装置C的作用是______________________。
(3)D装置中的P2O5是一种非氧化性的酸性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______。
a.NH3 b. HI c. SO2 d. CO2
(4)E装置中发生反应的化学方程式为:___________________________。
(5)此装置中存在着明显缺陷,你的改进措施是_________________________。
三、推断题
15.如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
16.已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
四、计算题
17.在4mol/L的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,则①原混合酸中c( H+)为________________。
②溶液中发生反应的离子方程式为_______。
③充分反应后最多可收集到标准状况下的气体的体积为__________,被还原硝酸的物质的量为_____________________________。
18.某同学购买了一瓶“84消毒液”,包装说明如下。请根据说明信息和相关知识分析:
(1)该“84消毒液”中,NaClO的物质的量浓度约为_______ mol/L(保留至小数点后一位)
(2)某化学课外活动小组计划使用NaOH溶液制取消毒液,反应原理为:Cl2+2NaOH=NaCl+ NaClO+H2O。制取时,需要多少升4.0mol/L的NaOH溶液才能与2.24L(标准状况下)的氯气恰好完全反应_________。(简要计算过程)
19.含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应(假设硝酸只被还原为NO),所得氧化产物与铁粉物质的量的关系如图所示,回答下列问题:
(1)曲线a表示_______________,曲线b表示_____________(填Fe2+或 Fe3+)
(2)Q点时反应的离子方程式为__________________________________________
(3)n3︰n1=________________
参考答案
1.A 2.C 3.C 4.D 5.D 6.B 7.A 8.B 9.D 10.A 11.A 12.B
13.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O B试管中品红溶液褪色 BaSO4 BaSO3 SO2+Cl2+2H2O===4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-) 除去剩余的SO2(或尾气处理) 当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡
14.分液漏斗 排除装置中的空气 吸收氮气中混有的HBr(Br2)气体 b N2+3MgMg3N2 在E后连接装有碱石灰的干燥管,防止空气中的水蒸气进入E装置中
15.CO2 CaCl2 HClO O2 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO ①⑤
16.Cl2 NH3 NO NaOH H++ClO-=HClO NH3+H2ONH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
17.10mol/L 3Cu+8H++2NO3-=2NO↑+4H2O+3Cu2+ 224mL 0.01mol
18.4.0mol/L 0.05L
19.Fe3+ Fe2+ Fe+4?H++NO3-=Fe3++NO↑+2H2O 3:2
答案第1页,总2页
