2019秋化学·选修4化学反应原理(鲁科版)课件:第1章第1节第1课时反应热焓变(共51张ppt)
文档属性
| 名称 | 2019秋化学·选修4化学反应原理(鲁科版)课件:第1章第1节第1课时反应热焓变(共51张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-18 14:51:51 | ||
图片预览











文档简介
(共51张PPT)
第1章 化学反应与能量转化
反应物化学键的断裂和生成物化学键的形成
吸收
释放
BE
ACD
反应物
生成物
放出
放热
吸热
反应类型 放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
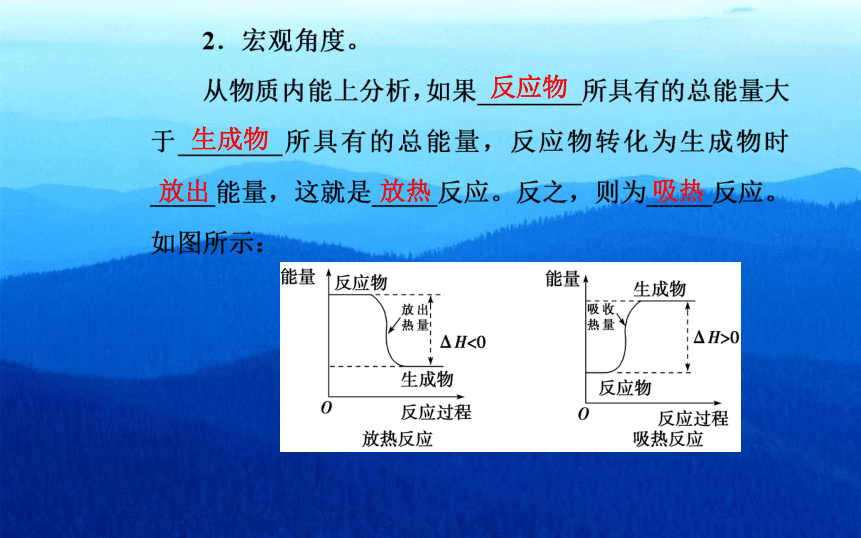
宏观角度 比较 E(反应物)>
E(生成物) E(反应物)<
E(生成物)
宏观角度 图示
微观角度 Q(吸)<Q(放) Q(吸)>Q(放)
表示方法 ΔH<0 ΔH>0
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收436 kJ 共吸收679 kJ
Cl—Cl 吸收243 kJ
H—Cl 放出431 kJ 共放出862 kJ
结论 H2(g)+Cl2(g)===2HCl(g)的反应热ΔH=-183 kJ·mol-1
能量↑反应物
能量
生成物
放出
吸收
热量
热量
△H<0
1△H0
生成物
反应物
反应过程
反应过程
放热反应
吸热反应
能量
反应物
生成物
反应过程
个能量生成物
反应物
反应过程
能量/( kJ- mol-)
2 mol ab(g
1 mol A2(g+1 mol B2g
反应过程
1molH的共价键断裂
2H
吸收436kJ能量
mol c2(g)共价键断裂
O2(g)
吸收246kJ能量
形成1molH2O的共价键
H,ocg)
释放930kJ能量
436kJ-mol-1
①①D断裂①①
能量
假想的中
键
十C
物
ClC
断裂
243 kJ-mol-I
能量
绌静)+
键形成
①C⑩C
431 kJmol
431 kJ mol
能量
能量
P4O10
温度计作用:测量反应前后溶液温度的变化值
搅拌器作用:①搅拌使反应充分进行;②使体系温度均匀
段外简作用:保温
内筒作用:作为反应容器
温度计
硬纸板
碎纸条
课堂小结
Q吸>Q放吸热反应
△0
Q吸△Hk0
吸
O
放
反应物旧键断新键成
生成物
E(反
E(生)
E(反)>E(生)放热反应△H<0
E反)<(生)吸热反应
△压0
吸收能量Q
反应物旧化学键断裂,生成物
新化学键形成
放出能量Q2
自主学习夯实双基
合作探究讲练互动
第1章 化学反应与能量转化
反应物化学键的断裂和生成物化学键的形成
吸收
释放
BE
ACD
反应物
生成物
放出
放热
吸热
反应类型 放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
宏观角度 比较 E(反应物)>
E(生成物) E(反应物)<
E(生成物)
宏观角度 图示
微观角度 Q(吸)<Q(放) Q(吸)>Q(放)
表示方法 ΔH<0 ΔH>0
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收436 kJ 共吸收679 kJ
Cl—Cl 吸收243 kJ
H—Cl 放出431 kJ 共放出862 kJ
结论 H2(g)+Cl2(g)===2HCl(g)的反应热ΔH=-183 kJ·mol-1
能量↑反应物
能量
生成物
放出
吸收
热量
热量
△H<0
1△H0
生成物
反应物
反应过程
反应过程
放热反应
吸热反应
能量
反应物
生成物
反应过程
个能量生成物
反应物
反应过程
能量/( kJ- mol-)
2 mol ab(g
1 mol A2(g+1 mol B2g
反应过程
1molH的共价键断裂
2H
吸收436kJ能量
mol c2(g)共价键断裂
O2(g)
吸收246kJ能量
形成1molH2O的共价键
H,ocg)
释放930kJ能量
436kJ-mol-1
①①D断裂①①
能量
假想的中
键
十C
物
ClC
断裂
243 kJ-mol-I
能量
绌静)+
键形成
①C⑩C
431 kJmol
431 kJ mol
能量
能量
P4O10
温度计作用:测量反应前后溶液温度的变化值
搅拌器作用:①搅拌使反应充分进行;②使体系温度均匀
段外简作用:保温
内筒作用:作为反应容器
温度计
硬纸板
碎纸条
课堂小结
Q吸>Q放吸热反应
△0
Q吸
吸
O
放
反应物旧键断新键成
生成物
E(反
E(生)
E(反)>E(生)放热反应△H<0
E反)<(生)吸热反应
△压0
吸收能量Q
反应物旧化学键断裂,生成物
新化学键形成
放出能量Q2
自主学习夯实双基
合作探究讲练互动
