2019秋化学·选修4化学反应原理(鲁科版)课件:第2章第2节第2课时反应条件对化学平衡的影响45张
文档属性
| 名称 | 2019秋化学·选修4化学反应原理(鲁科版)课件:第2章第2节第2课时反应条件对化学平衡的影响45张 |

|
|
| 格式 | zip | ||
| 文件大小 | 954.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-18 15:42:46 | ||
图片预览










文档简介
(共45张PPT)
2019秋鲁科版化学选修四课件
第2章 化学反应的方向、限度与速率
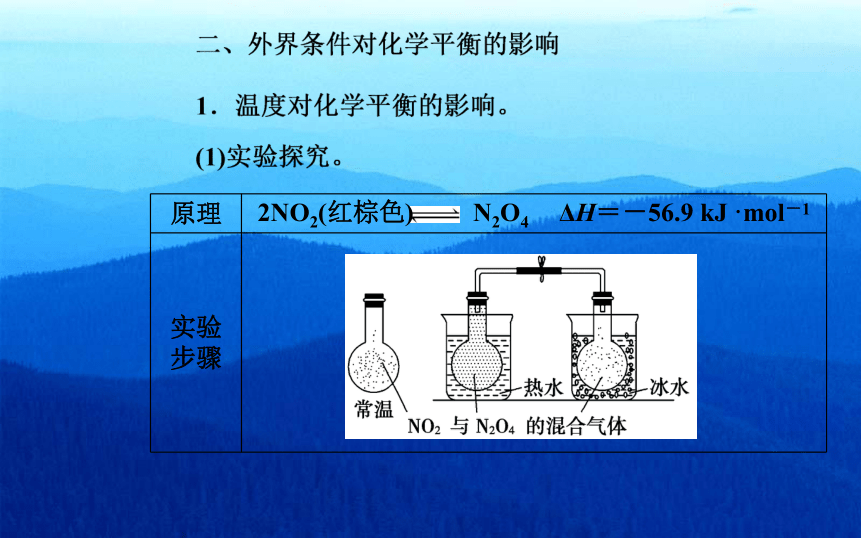
原理 2NO2(红棕色) N2O4 ΔH=-56.9 kJ·mol-1
实验
步骤
实验(Ⅰ)步骤
:
热水冰水
常温
NO2与N2O4的混合气体
自主学习夯实双基
正向反应
改变条件
定时间
(正)>07G逆)
(正)=(逆)
U(正)≠v(逆)
定时间
(正)=U(逆)
反应开始
化学平衡
正向或逆
新的化学
尚未平衡
状态
向移动
平衡状态
建立平衡
化学平衡移动
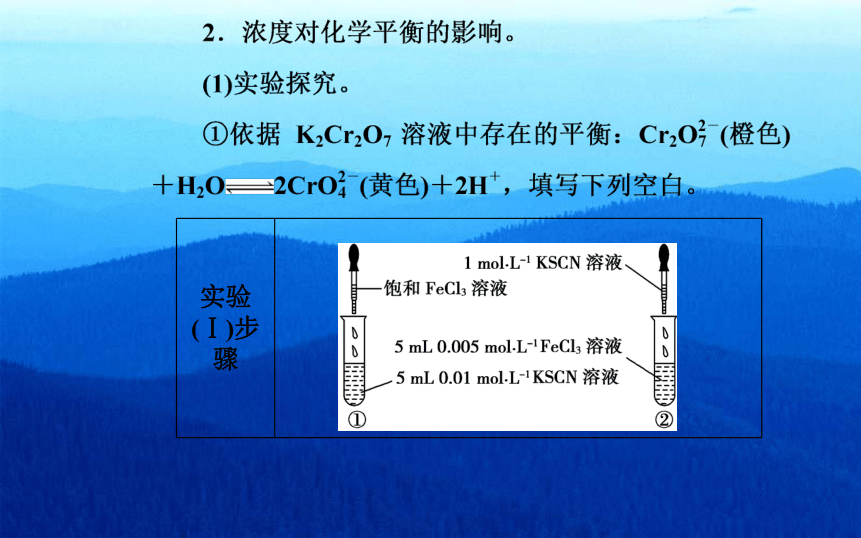
molL1KsCN溶液
饱和FeCl3溶液
|5mL0005 molL- FeCl3溶液
5mL001molL1KSCN溶液
②
合作探究讲练互动
NO2NO2加压NO2
N204 N204
n2O4
NO2减压NO2NO2
N2O4
N2O4 i N2O4
Ⅲ
2
Ⅱ|1
课堂小结
温度:升温,平衡向吸热反应方向移动;降温,平衡向放
反热反应方向移动
应
条浓度:增大反应物浓度,减小生成物浓度,平衡正向移
对动;反之,平衡逆向移动
化
学压强:增大压强,平衡向气体体积减小的方向移动;减
平小压强,平衡向气体体积增大的方向移动
衡
的|勒·夏特列原理:在封闭体系中,如果仅改变平衡体系
响的一个条件(温度、浓度压强)、平衡将向减弱这个
改变的方向移动
2019秋鲁科版化学选修四课件
第2章 化学反应的方向、限度与速率
原理 2NO2(红棕色) N2O4 ΔH=-56.9 kJ·mol-1
实验
步骤
实验(Ⅰ)步骤
:
热水冰水
常温
NO2与N2O4的混合气体
自主学习夯实双基
正向反应
改变条件
定时间
(正)>07G逆)
(正)=(逆)
U(正)≠v(逆)
定时间
(正)=U(逆)
反应开始
化学平衡
正向或逆
新的化学
尚未平衡
状态
向移动
平衡状态
建立平衡
化学平衡移动
molL1KsCN溶液
饱和FeCl3溶液
|5mL0005 molL- FeCl3溶液
5mL001molL1KSCN溶液
②
合作探究讲练互动
NO2NO2加压NO2
N204 N204
n2O4
NO2减压NO2NO2
N2O4
N2O4 i N2O4
Ⅲ
2
Ⅱ|1
课堂小结
温度:升温,平衡向吸热反应方向移动;降温,平衡向放
反热反应方向移动
应
条浓度:增大反应物浓度,减小生成物浓度,平衡正向移
对动;反之,平衡逆向移动
化
学压强:增大压强,平衡向气体体积减小的方向移动;减
平小压强,平衡向气体体积增大的方向移动
衡
的|勒·夏特列原理:在封闭体系中,如果仅改变平衡体系
响的一个条件(温度、浓度压强)、平衡将向减弱这个
改变的方向移动
