2019秋化学·选修4化学反应原理(鲁科版)课件:第3章第2节第2课时盐类的水解37张
文档属性
| 名称 | 2019秋化学·选修4化学反应原理(鲁科版)课件:第3章第2节第2课时盐类的水解37张 |

|
|
| 格式 | zip | ||
| 文件大小 | 905.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-18 20:14:07 | ||
图片预览










文档简介
(共37张PPT)
2019秋鲁科版化学选修四第三章课件
第3章 物质在水溶液中的行为
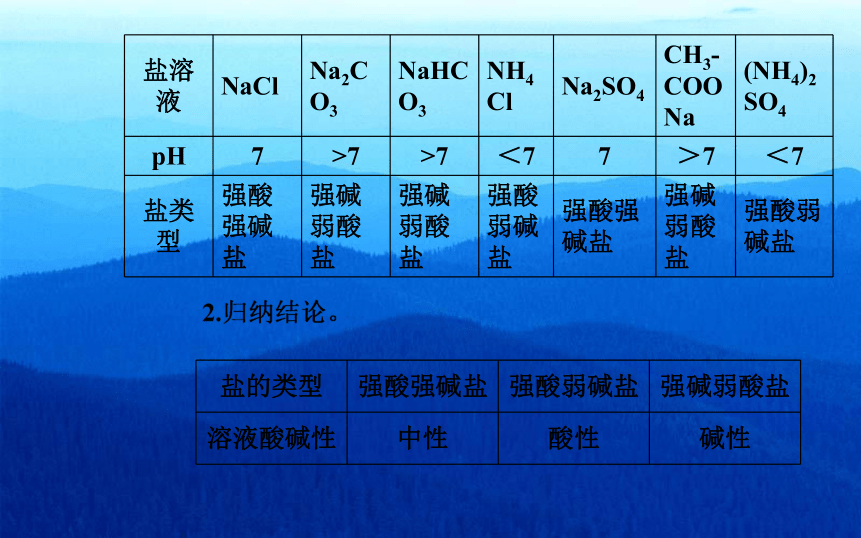
盐溶液 NaCl Na2CO3 NaHCO3 NH4Cl Na2SO4 CH3?
COONa (NH4)2
SO4
pH 7 >7 >7 <7 7 >7 <7
盐类型 强酸强碱盐 强碱弱酸盐 强碱弱酸盐 强酸弱碱盐 强酸强
碱盐 强碱弱酸盐 强酸弱
碱盐
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液酸碱性 中性 酸性 碱性
项目 NH4Cl溶于水 CH3COONa溶于水 NaCl溶于水
电离方
程式
NaCl===Na++Cl-,H2O
H++OH-
选项 物质 离子种类
A NaHCO3 4
B Na3PO4 6
C NH4Cl 3
D AlCl3 3
选项 A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
自主学习夯实双基
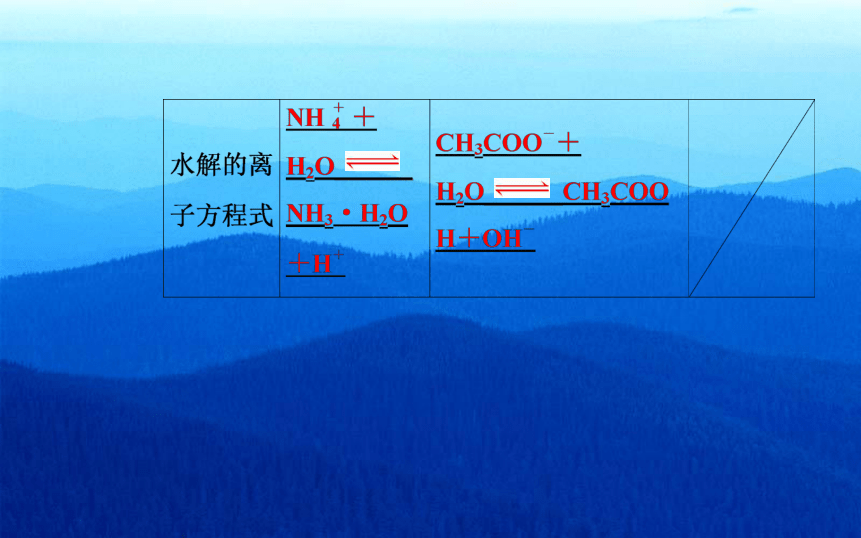
H20、H++OH
NH4CI-CI-+INH4
NH3·H2Oi
H2O÷0H+
H+
CH3COoNa=Na++ CH3COo
Ch&COoH
合作探究讲练互动
强酸弱碱盐
pH<7
有弱才水解{强碱弱酸盐p7+谁强显谁性
弱酸弱碱盐}都弱都水解
K解
无弱不水
强酸强碱盐
=7
中性
同强显中
课堂小结
定义:盐电离出的离子与H2O电离产生的H或
OH结合生成弱电解质的反应
类实质:打破了水的电离平衡,使溶液中11≠[OH
的表示盐类水解的离了方程式
水律:有弱才水解,越弱越水解;谁强显谁性,同强显
解
中性
影响因素:温度、浓度、外加酸、碱等外界条件对水解平
衡的影响,遵循平衡移动原理
2019秋鲁科版化学选修四第三章课件
第3章 物质在水溶液中的行为
盐溶液 NaCl Na2CO3 NaHCO3 NH4Cl Na2SO4 CH3?
COONa (NH4)2
SO4
pH 7 >7 >7 <7 7 >7 <7
盐类型 强酸强碱盐 强碱弱酸盐 强碱弱酸盐 强酸弱碱盐 强酸强
碱盐 强碱弱酸盐 强酸弱
碱盐
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液酸碱性 中性 酸性 碱性
项目 NH4Cl溶于水 CH3COONa溶于水 NaCl溶于水
电离方
程式
NaCl===Na++Cl-,H2O
H++OH-
选项 物质 离子种类
A NaHCO3 4
B Na3PO4 6
C NH4Cl 3
D AlCl3 3
选项 A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
自主学习夯实双基
H20、H++OH
NH4CI-CI-+INH4
NH3·H2Oi
H2O÷0H+
H+
CH3COoNa=Na++ CH3COo
Ch&COoH
合作探究讲练互动
强酸弱碱盐
pH<7
有弱才水解{强碱弱酸盐p7+谁强显谁性
弱酸弱碱盐}都弱都水解
K解
无弱不水
强酸强碱盐
=7
中性
同强显中
课堂小结
定义:盐电离出的离子与H2O电离产生的H或
OH结合生成弱电解质的反应
类实质:打破了水的电离平衡,使溶液中11≠[OH
的表示盐类水解的离了方程式
水律:有弱才水解,越弱越水解;谁强显谁性,同强显
解
中性
影响因素:温度、浓度、外加酸、碱等外界条件对水解平
衡的影响,遵循平衡移动原理
