山东省淄博市实验中学2020届高三上学期暑假收心考试化学试题
文档属性
| 名称 | 山东省淄博市实验中学2020届高三上学期暑假收心考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 252.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-18 20:24:09 | ||
图片预览



文档简介
淄博实验中学高三级部第一学期暑假学习效果检测试题 2019.8
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。试题分值100分,考试时间90分钟。
可能用到的相对原子质量:
H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 Fe 56
Cu 64 Zn 65 Ga 70 As 75 Ce 140
第Ⅰ卷 选择题(42分)
一、选择题(本题包括14小题,每小题3分,共42分;且每小题只有1个选项符合题意)
1.2019年2月,在世界移动通信大会(MWC)上发布了中国制造首款5G折叠屏手机的消息。下列说法不正确的是 ( )
A.制造手机芯片的关键材料是硅 B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池工作时,电池中化学能完全转化为电能
2.化学与生产生活息息相关,下列说法错误的是 ( )
A.秸秆大量焚烧将产生雾霾 B.由地沟油炼制的生物柴油属于烃类物质
C.为防止富脂食品氧化变质,常在包装袋中放入硫酸亚铁
D.建设港珠澳大桥时采用超高分子量聚乙烯(UHMWPE)纤维吊绳,UHMWPE属于有机高分子化合物
3.下列叙述正确的是( )
A.两种非金属原子间不可能形成离子键
B.Na 2 CO3和CaCl2中化学键类型(离子键、共价键)完全相同
C.阴、阳离子通过静电引力而形成的化学键叫做离子键
D.含有共价键的化合物一定是共价化合物
4.N A 代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.HNO3作为氧化剂得到的电子数一定为3 NA
B.0.4mol?L-1 Na2SO4溶液中,所含的Na+ 和SO42— 总数为1.2 NA
C.常温常压下,16g O3含有的氧原子数为N A
D.12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2 N A
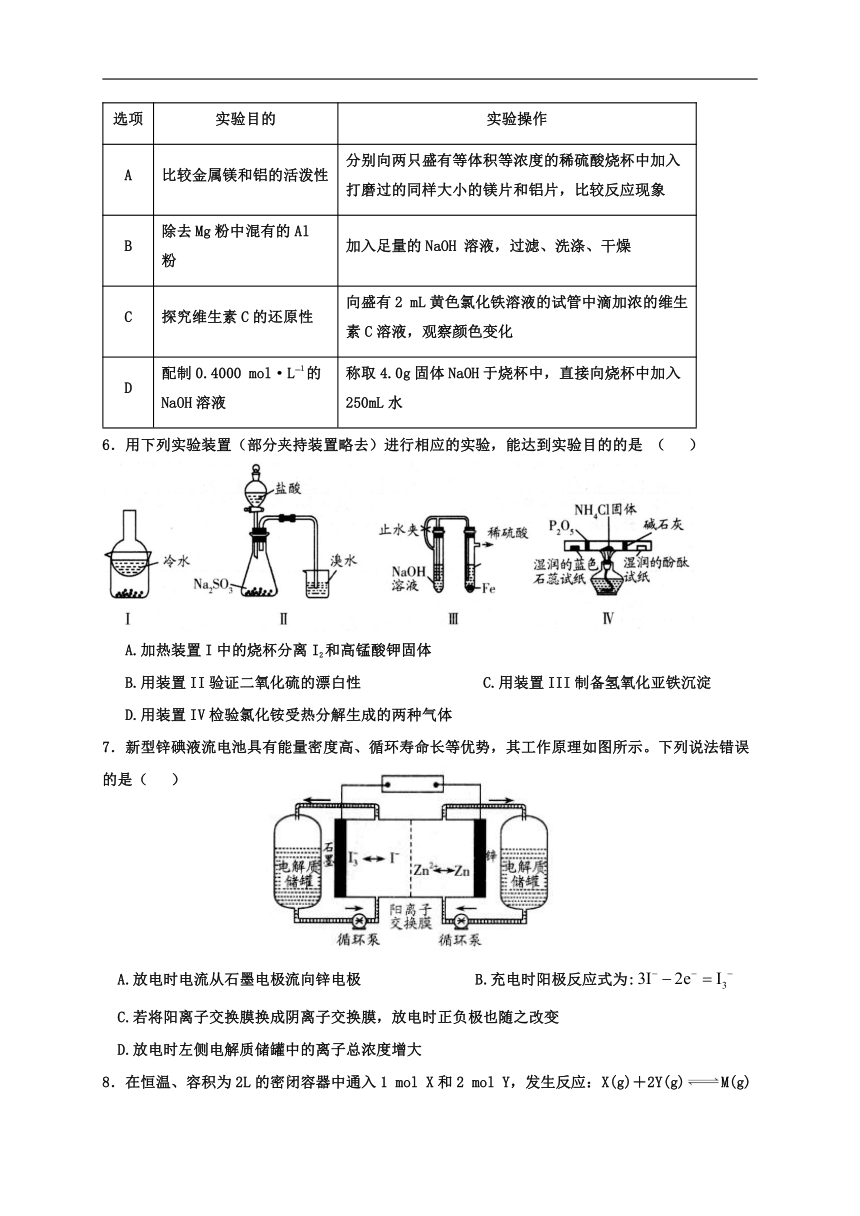
5.下列实验操作不能达到实验目的的是 ( )
选项
实验目的
实验操作
A
比较金属镁和铝的活泼性
分别向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象
B
除去Mg粉中混有的Al 粉
加入足量的NaOH 溶液,过滤、洗涤、干燥
C
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D
配制0.4000 mol·L?1的NaOH溶液
称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水
6.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
A.加热装置I中的烧杯分离I2和高锰酸钾固体
B.用装置II验证二氧化硫的漂白性 C.用装置III制备氢氧化亚铁沉淀
D.用装置IV检验氯化铵受热分解生成的两种气体
7.新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是( )
A.放电时电流从石墨电极流向锌电极 B.充电时阳极反应式为:
C.若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D.放电时左侧电解质储罐中的离子总浓度增大
8.在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是 ( )
A.0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B.当容器中混合气体密度不变时达到平衡状态
C.平衡后升高温度,X的反应速率降低
D.到达平衡状态时,反应放出的热量为a kJ
9.有机化合物甲与乙在一定条件下可反应生成丙:
。下列说法正确的是 ( )
甲 乙 丙
A.甲与乙生成丙的反应属于取代反应 B.甲分子中所有原子共平面
C.乙的一氯代物有2种
D.丙在酸性条件下水解生成和CH318OH
10.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。常温时下列有关说法中正确的是 ( )
A.饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B.25℃时,FeS的溶解度大于CuS的溶解度
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na 2 S,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
11.下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO3—、SO32—
B.pH=12的溶液中:OH—、K+、Cl—、HCO3—
C.加入铝粉能放出氢气的溶液中一定存在:NH4+、NO3—、AlO2—、SO42—
D.25oC时pH=7的无色溶液中:Na+、Cl—、SO42—、K+
12.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的ΔH=+91 kJ·mol-1 B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
13.已知氧化性Fe3+ > Cu2+,向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入
a mol铁粉,充分反应后,下列说法正确的是 ( )
A.当a≤1时,发生的反应为Fe + Cu2+ =Fe2+ + Cu
B.当固体有剩余时,溶液中存一定存在Fe2+、Fe3+ 离子
C.当1≤a<2时,溶液中 n(Fe2+ )=( 2+a )mol
D.若有固体剩余,则固体中一定有铁,可能有铜
14.甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O CH3NH3+ + OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是 ( )
A.b点对应加入盐酸的体积V<20.00mL
B.常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C.b点可能存在关系:
c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D.V = 20.00mL时,溶液呈弱酸性
第Ⅱ卷 非选择题(58分)
15.(12分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
(1)沉淀A的化学式是 ,试剂a的化学式为 ;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为 ;
(3)Al2O3中所含的化学键的类型为 ;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其阳极反应式为 ;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂。下列氧化物中不能与铝粉组成铝热剂的是( )
a.MgO b.V 2 O 5 c.Fe 3 O 4 d.MnO2
16.(12分)研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I、CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= kJ/mol
II、某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0?15 min内用二氧化碳表示平均反应速率
①v(CO2)= ,计算此条件下该反应的平衡常数②K= 。
III、捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
①c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的
顺序为 。
17. (10分)铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:
(已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。)
滤渣的成分是________ ,反应②的离子方程式是________________ 。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为____________________ 。
(3)利用电解方法也可以实现铈的回收。
在酸性条件下电解Ce2O3 (如图):阳极电极反应式为________ ,
离子交换膜为________ (填“阴”或“阳”)离子交换膜。
18.(10分)冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为__________________________________
_。
(4)PM2.5富含NO;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,
则该晶体的密度 g/cm3
(只列式不计算,Kr摩尔质量为85g·mol—1)
19.(14分)
抗丙肝新药的中间体合成路线图如下:
已知:-Et为乙基,DCM与DMF均为有机溶剂。
(1) 的名称是_____________,所含官能团的名称是______________。
(2) 的分子式为____________ _。
(3) 反应①化学方程式为_______________ ___,(不用写反应条件)反应类型属于是___________。
(4)写出一种与 互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____________________________
(5) 设计由乙醇、1,3-丁二烯和甲氨( CH 3 NH 2 )合成 路线(其他试剂任选,不需写每一步的化学方程式,应写必要的反应条件)。
淄博实验中学高三级部第一学期暑假学习效果检测试题 2019.8
化 学答案
DBACD/DCADB/DDCC
15.(12分,每空2分)(1)SiO2 (2分) NaOH (2分)
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)或 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
(3)离子键(2分)(4)2O2-- 4e- =O2↑(2分)(5)a(2分)
16.(12分)I.(2a+b)/3(2 分)II.①0.2mol/(L·min) (2 分)② 1.8(2 分)
III.(1)C D(2 分) (2)①<(2 分)②K b>K c >Kd (2 分)
17.(10分)(1)CeO2(1分)、SiO2(1分)2 CeO2 +H2O2 +6H+=2Ce3++O2↑+4H2O (2分)
(2)4 Ce(OH)3 +2H2O+ O2=4 Ce(OH)4(2分)
(3)Ce2O3 -2e- + 6H+ = 2Ce4++3 H2O(2分)阳(2分)
18.(10分)(1)2(1 分) 3d104s1(1 分)(2)O(1 分) 正四面体(1 分)
(3)sp3(1 分) H2O2 为极性分子,CCl4 为非极性溶剂,所以 H2O2 难溶于 CCl4 中。(2 分)
(4)6 (1 分)
(5) (2 分)
19.(14分)(1)乙苯 (2分) 醛基、酯基 (2 分)
(2)C12H15NO2 (2 分)
(3)
(4)
(5)
(3 分)
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。试题分值100分,考试时间90分钟。
可能用到的相对原子质量:
H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 Fe 56
Cu 64 Zn 65 Ga 70 As 75 Ce 140
第Ⅰ卷 选择题(42分)
一、选择题(本题包括14小题,每小题3分,共42分;且每小题只有1个选项符合题意)
1.2019年2月,在世界移动通信大会(MWC)上发布了中国制造首款5G折叠屏手机的消息。下列说法不正确的是 ( )
A.制造手机芯片的关键材料是硅 B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池工作时,电池中化学能完全转化为电能
2.化学与生产生活息息相关,下列说法错误的是 ( )
A.秸秆大量焚烧将产生雾霾 B.由地沟油炼制的生物柴油属于烃类物质
C.为防止富脂食品氧化变质,常在包装袋中放入硫酸亚铁
D.建设港珠澳大桥时采用超高分子量聚乙烯(UHMWPE)纤维吊绳,UHMWPE属于有机高分子化合物
3.下列叙述正确的是( )
A.两种非金属原子间不可能形成离子键
B.Na 2 CO3和CaCl2中化学键类型(离子键、共价键)完全相同
C.阴、阳离子通过静电引力而形成的化学键叫做离子键
D.含有共价键的化合物一定是共价化合物
4.N A 代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.HNO3作为氧化剂得到的电子数一定为3 NA
B.0.4mol?L-1 Na2SO4溶液中,所含的Na+ 和SO42— 总数为1.2 NA
C.常温常压下,16g O3含有的氧原子数为N A
D.12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2 N A
5.下列实验操作不能达到实验目的的是 ( )
选项
实验目的
实验操作
A
比较金属镁和铝的活泼性
分别向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象
B
除去Mg粉中混有的Al 粉
加入足量的NaOH 溶液,过滤、洗涤、干燥
C
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D
配制0.4000 mol·L?1的NaOH溶液
称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水
6.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
A.加热装置I中的烧杯分离I2和高锰酸钾固体
B.用装置II验证二氧化硫的漂白性 C.用装置III制备氢氧化亚铁沉淀
D.用装置IV检验氯化铵受热分解生成的两种气体
7.新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是( )
A.放电时电流从石墨电极流向锌电极 B.充电时阳极反应式为:
C.若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D.放电时左侧电解质储罐中的离子总浓度增大
8.在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是 ( )
A.0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B.当容器中混合气体密度不变时达到平衡状态
C.平衡后升高温度,X的反应速率降低
D.到达平衡状态时,反应放出的热量为a kJ
9.有机化合物甲与乙在一定条件下可反应生成丙:
。下列说法正确的是 ( )
甲 乙 丙
A.甲与乙生成丙的反应属于取代反应 B.甲分子中所有原子共平面
C.乙的一氯代物有2种
D.丙在酸性条件下水解生成和CH318OH
10.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。常温时下列有关说法中正确的是 ( )
A.饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B.25℃时,FeS的溶解度大于CuS的溶解度
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na 2 S,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
11.下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO3—、SO32—
B.pH=12的溶液中:OH—、K+、Cl—、HCO3—
C.加入铝粉能放出氢气的溶液中一定存在:NH4+、NO3—、AlO2—、SO42—
D.25oC时pH=7的无色溶液中:Na+、Cl—、SO42—、K+
12.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的ΔH=+91 kJ·mol-1 B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
13.已知氧化性Fe3+ > Cu2+,向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入
a mol铁粉,充分反应后,下列说法正确的是 ( )
A.当a≤1时,发生的反应为Fe + Cu2+ =Fe2+ + Cu
B.当固体有剩余时,溶液中存一定存在Fe2+、Fe3+ 离子
C.当1≤a<2时,溶液中 n(Fe2+ )=( 2+a )mol
D.若有固体剩余,则固体中一定有铁,可能有铜
14.甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O CH3NH3+ + OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是 ( )
A.b点对应加入盐酸的体积V<20.00mL
B.常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C.b点可能存在关系:
c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D.V = 20.00mL时,溶液呈弱酸性
第Ⅱ卷 非选择题(58分)
15.(12分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
(1)沉淀A的化学式是 ,试剂a的化学式为 ;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为 ;
(3)Al2O3中所含的化学键的类型为 ;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其阳极反应式为 ;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂。下列氧化物中不能与铝粉组成铝热剂的是( )
a.MgO b.V 2 O 5 c.Fe 3 O 4 d.MnO2
16.(12分)研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I、CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= kJ/mol
II、某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0?15 min内用二氧化碳表示平均反应速率
①v(CO2)= ,计算此条件下该反应的平衡常数②K= 。
III、捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
①c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的
顺序为 。
17. (10分)铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:
(已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。)
滤渣的成分是________ ,反应②的离子方程式是________________ 。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为____________________ 。
(3)利用电解方法也可以实现铈的回收。
在酸性条件下电解Ce2O3 (如图):阳极电极反应式为________ ,
离子交换膜为________ (填“阴”或“阳”)离子交换膜。
18.(10分)冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为__________________________________
_。
(4)PM2.5富含NO;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,
则该晶体的密度 g/cm3
(只列式不计算,Kr摩尔质量为85g·mol—1)
19.(14分)
抗丙肝新药的中间体合成路线图如下:
已知:-Et为乙基,DCM与DMF均为有机溶剂。
(1) 的名称是_____________,所含官能团的名称是______________。
(2) 的分子式为____________ _。
(3) 反应①化学方程式为_______________ ___,(不用写反应条件)反应类型属于是___________。
(4)写出一种与 互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____________________________
(5) 设计由乙醇、1,3-丁二烯和甲氨( CH 3 NH 2 )合成 路线(其他试剂任选,不需写每一步的化学方程式,应写必要的反应条件)。
淄博实验中学高三级部第一学期暑假学习效果检测试题 2019.8
化 学答案
DBACD/DCADB/DDCC
15.(12分,每空2分)(1)SiO2 (2分) NaOH (2分)
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)或 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
(3)离子键(2分)(4)2O2-- 4e- =O2↑(2分)(5)a(2分)
16.(12分)I.(2a+b)/3(2 分)II.①0.2mol/(L·min) (2 分)② 1.8(2 分)
III.(1)C D(2 分) (2)①<(2 分)②K b>K c >Kd (2 分)
17.(10分)(1)CeO2(1分)、SiO2(1分)2 CeO2 +H2O2 +6H+=2Ce3++O2↑+4H2O (2分)
(2)4 Ce(OH)3 +2H2O+ O2=4 Ce(OH)4(2分)
(3)Ce2O3 -2e- + 6H+ = 2Ce4++3 H2O(2分)阳(2分)
18.(10分)(1)2(1 分) 3d104s1(1 分)(2)O(1 分) 正四面体(1 分)
(3)sp3(1 分) H2O2 为极性分子,CCl4 为非极性溶剂,所以 H2O2 难溶于 CCl4 中。(2 分)
(4)6 (1 分)
(5) (2 分)
19.(14分)(1)乙苯 (2分) 醛基、酯基 (2 分)
(2)C12H15NO2 (2 分)
(3)
(4)
(5)
(3 分)
同课章节目录
