鲁教版九年级上册化学 3.3 到实验室去:配制一定溶质质量分数的溶液 课件(21张PPT)
文档属性
| 名称 | 鲁教版九年级上册化学 3.3 到实验室去:配制一定溶质质量分数的溶液 课件(21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-20 10:45:33 | ||
图片预览








文档简介
(共21张PPT)
第三单元 溶液
配制一定溶质质量分数的溶液
溶质质量分数=
溶质质量
溶液质量
×100%
定义:溶质质量与溶液质量的比值。
复习提高
1、复习有关溶质质量分数的计算
①溶液的质量×溶质的质量分数= ;
②溶液的质量-溶质的质量 = ;
③溶剂的质量/溶剂的密度 = 。
溶质的质量
溶剂的质量
溶剂的体积
2、托盘天平的使用
①称量固体溶质 需要使用 ,称量前应先检查 。称量时,药品放在 盘,砝码放在 盘,用 取砝码,先加质量 的,再加质量 的,最后移动 。
②称量物的质量= + ,当砝码和称量物位置颠倒时,称量物的质量 = 砝码的质量 - 。
③称量干燥的固体药品时,应在两个托盘上各放一张 ,然后把药品放在其上称量。易潮解的药品(如氢氧化钠)必须放在 中称量。
④练习称取2.5g氯化钠。
复习提高
质量相同的纸
玻璃器皿
3、量筒的使用
①取用一定量的液体需要的仪器是 和 。
②读数时,视线必须与 保持水平。
③如果量取30ml的水时, 若仰视刻度,所取水比30ml (多或少), 若俯视刻度,所取水的体积比30ml 。
④练习量取45ml水。
复习提高
凹液面的最低处
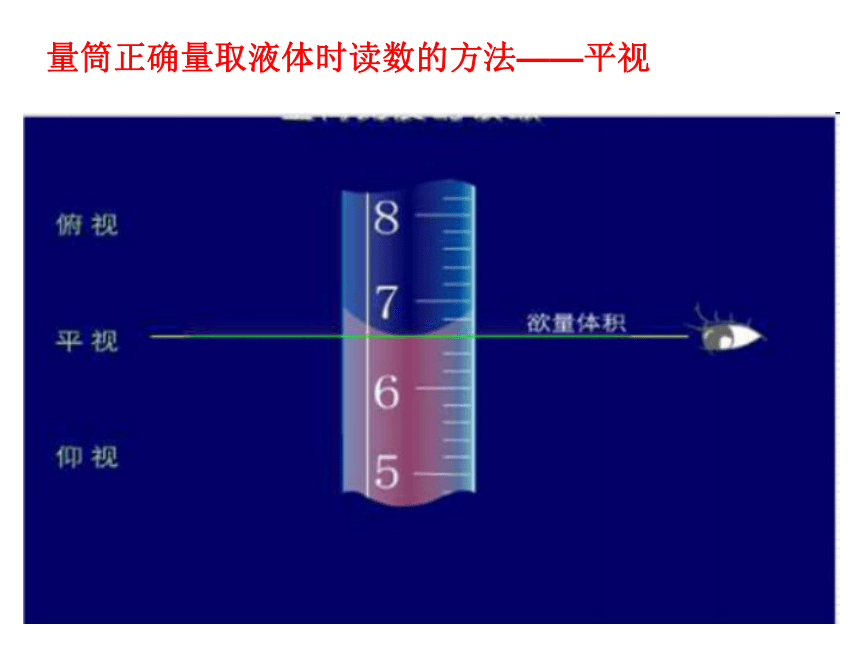
量筒正确量取液体时读数的方法——平视
俯视读数:
仰视读数:
量取液体体积偏少,读数偏大;
量取液体体积偏多,读数偏小。
3、量筒的使用
①取用一定量的液体需要的仪器是 。
②读数时,视线必须与 保持水平。
③如果量取30ml的水时, 若仰视刻度,所取水比30ml (多或少), 若俯视刻度,所取水的体积比30ml 。
④练习量取45ml水。
复习提高
多
少
1、合作配制50g6%的氯化钠溶液,完成以下内容。
①计算:计算所需的氯化钠的质量和水的体积。
②称量:用 称量 g氯化钠,用 量取 ml水。
③溶解:将称好的氯化钠固体和量好的水,倒 入 中,用 搅拌使之完全溶解。其中玻璃棒的作用是 。
④装瓶存放:把配制好的溶液装入试剂瓶中,盖好盖,贴上标签(注明药品的名称和溶质的质量分数)。
合作探究
一、配制溶质质量分数一定的溶液
1、步骤
计算,
称量,
溶解,
装瓶存放
一、配制溶质质量分数一定的溶液
2、仪器
托盘天平,
药匙,
量筒,
胶头滴管,
烧杯,
玻璃棒,
试剂瓶。
2、交流讨论
①实验中哪些不良操作会造成误差?哪些会使溶质的质量分数偏大?哪些会使溶质的质量分数偏小?如何避免?
②如果用溶质的质量分数是98%的浓硫酸,配制质量分数是30%的稀硫酸,其步骤有哪些?
合作探究
合作探究
2、交流讨论
①实验中哪些不良操作会造成误差?哪些会使溶质的质量分数偏大?哪些会使溶质的质量分数偏小?如何避免?
从结果分析可知:
只要是使溶质增多的操作都可以使溶质质量分数偏大,使溶质减少的操作可以使溶质质量分数偏小。
只要是使溶剂增加的操作都可以使溶质质量分数偏小,使溶质减少的操作可以使溶质质量分数偏大。
二、误差分析
1、溶质
2、溶剂
溶质增多,溶质质量分数 ;
偏大
溶质减少,溶质质量分数 ;
偏小
溶剂增多,溶质质量分数 ;
偏小
溶质减少,溶质质量分数 ;
偏大
2、交流讨论:
②如果用溶质的质量分数是98%的浓硫酸,配制质量分数是20%的稀硫酸,其步骤有哪些?
合作探究
步骤:
仪器:
计算
量取
稀释
装瓶存放
量筒 胶头滴管 烧杯 玻璃棒 试剂瓶
练习检测
1.配制一定溶质质量分数的溶液,正确的操作步骤是:( )
A、称量(量取) 计算 溶解
B、计算 溶解 称量(量取)
C、计算 称量(量取) 溶解
D、溶解 计算 称量(量取)
C
练习检测
2、在用食盐配制生理盐水时,下列仪器一定会用到的是( )
A、托盘天平 、药匙、烧杯、玻璃棒、酒精灯
B、量筒、 烧杯、 药匙、 玻璃棒、 酒精灯
C、量筒、托盘天平、玻璃棒、药匙、烧杯
D、烧杯、药匙,玻璃棒、漏斗
C
练习检测
3、下列操作会引起所配制的溶液质量分数降低的是 ( )
A、用托盘天平称量6.2g食盐,误将砝码放在左盘并使用了游码;
B、称量时,两盘分别垫上大小相同的纸;
C、用量筒量水时,俯视凹液面的最低处读数;
D、将配制好的溶液转移到试剂瓶时,不慎洒出。
A
练习检测
4.在实验室中,配制500g 0.9%的生理盐水:
(1)该实验的主要步骤有
计算、_________、溶解、装瓶并贴标签;
(2)通过计算,配制该溶液需要水的体积为
______mL(水的密度为1g/cm3)。
(3)在用量筒量取水的体积时,俯视读数,
则造成所配制的溶液中溶质质量分数________
(填“偏大”“偏小”或“不变”)。
第三单元 溶液
配制一定溶质质量分数的溶液
溶质质量分数=
溶质质量
溶液质量
×100%
定义:溶质质量与溶液质量的比值。
复习提高
1、复习有关溶质质量分数的计算
①溶液的质量×溶质的质量分数= ;
②溶液的质量-溶质的质量 = ;
③溶剂的质量/溶剂的密度 = 。
溶质的质量
溶剂的质量
溶剂的体积
2、托盘天平的使用
①称量固体溶质 需要使用 ,称量前应先检查 。称量时,药品放在 盘,砝码放在 盘,用 取砝码,先加质量 的,再加质量 的,最后移动 。
②称量物的质量= + ,当砝码和称量物位置颠倒时,称量物的质量 = 砝码的质量 - 。
③称量干燥的固体药品时,应在两个托盘上各放一张 ,然后把药品放在其上称量。易潮解的药品(如氢氧化钠)必须放在 中称量。
④练习称取2.5g氯化钠。
复习提高
质量相同的纸
玻璃器皿
3、量筒的使用
①取用一定量的液体需要的仪器是 和 。
②读数时,视线必须与 保持水平。
③如果量取30ml的水时, 若仰视刻度,所取水比30ml (多或少), 若俯视刻度,所取水的体积比30ml 。
④练习量取45ml水。
复习提高
凹液面的最低处
量筒正确量取液体时读数的方法——平视
俯视读数:
仰视读数:
量取液体体积偏少,读数偏大;
量取液体体积偏多,读数偏小。
3、量筒的使用
①取用一定量的液体需要的仪器是 。
②读数时,视线必须与 保持水平。
③如果量取30ml的水时, 若仰视刻度,所取水比30ml (多或少), 若俯视刻度,所取水的体积比30ml 。
④练习量取45ml水。
复习提高
多
少
1、合作配制50g6%的氯化钠溶液,完成以下内容。
①计算:计算所需的氯化钠的质量和水的体积。
②称量:用 称量 g氯化钠,用 量取 ml水。
③溶解:将称好的氯化钠固体和量好的水,倒 入 中,用 搅拌使之完全溶解。其中玻璃棒的作用是 。
④装瓶存放:把配制好的溶液装入试剂瓶中,盖好盖,贴上标签(注明药品的名称和溶质的质量分数)。
合作探究
一、配制溶质质量分数一定的溶液
1、步骤
计算,
称量,
溶解,
装瓶存放
一、配制溶质质量分数一定的溶液
2、仪器
托盘天平,
药匙,
量筒,
胶头滴管,
烧杯,
玻璃棒,
试剂瓶。
2、交流讨论
①实验中哪些不良操作会造成误差?哪些会使溶质的质量分数偏大?哪些会使溶质的质量分数偏小?如何避免?
②如果用溶质的质量分数是98%的浓硫酸,配制质量分数是30%的稀硫酸,其步骤有哪些?
合作探究
合作探究
2、交流讨论
①实验中哪些不良操作会造成误差?哪些会使溶质的质量分数偏大?哪些会使溶质的质量分数偏小?如何避免?
从结果分析可知:
只要是使溶质增多的操作都可以使溶质质量分数偏大,使溶质减少的操作可以使溶质质量分数偏小。
只要是使溶剂增加的操作都可以使溶质质量分数偏小,使溶质减少的操作可以使溶质质量分数偏大。
二、误差分析
1、溶质
2、溶剂
溶质增多,溶质质量分数 ;
偏大
溶质减少,溶质质量分数 ;
偏小
溶剂增多,溶质质量分数 ;
偏小
溶质减少,溶质质量分数 ;
偏大
2、交流讨论:
②如果用溶质的质量分数是98%的浓硫酸,配制质量分数是20%的稀硫酸,其步骤有哪些?
合作探究
步骤:
仪器:
计算
量取
稀释
装瓶存放
量筒 胶头滴管 烧杯 玻璃棒 试剂瓶
练习检测
1.配制一定溶质质量分数的溶液,正确的操作步骤是:( )
A、称量(量取) 计算 溶解
B、计算 溶解 称量(量取)
C、计算 称量(量取) 溶解
D、溶解 计算 称量(量取)
C
练习检测
2、在用食盐配制生理盐水时,下列仪器一定会用到的是( )
A、托盘天平 、药匙、烧杯、玻璃棒、酒精灯
B、量筒、 烧杯、 药匙、 玻璃棒、 酒精灯
C、量筒、托盘天平、玻璃棒、药匙、烧杯
D、烧杯、药匙,玻璃棒、漏斗
C
练习检测
3、下列操作会引起所配制的溶液质量分数降低的是 ( )
A、用托盘天平称量6.2g食盐,误将砝码放在左盘并使用了游码;
B、称量时,两盘分别垫上大小相同的纸;
C、用量筒量水时,俯视凹液面的最低处读数;
D、将配制好的溶液转移到试剂瓶时,不慎洒出。
A
练习检测
4.在实验室中,配制500g 0.9%的生理盐水:
(1)该实验的主要步骤有
计算、_________、溶解、装瓶并贴标签;
(2)通过计算,配制该溶液需要水的体积为
______mL(水的密度为1g/cm3)。
(3)在用量筒量取水的体积时,俯视读数,
则造成所配制的溶液中溶质质量分数________
(填“偏大”“偏小”或“不变”)。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
