第1章 物质及其变化 核心知识记忆(教师版+学生版)
文档属性
| 名称 | 第1章 物质及其变化 核心知识记忆(教师版+学生版) |  | |
| 格式 | zip | ||
| 文件大小 | 423.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-09-23 10:52:37 | ||
图片预览




文档简介
第1章 物质及其变化 核心知识记忆(学生版)
一、物质的化学式
1、含义:这种用 来表示物质组成的式子称为 。一种纯净物,只有1个化学式。
2、单质和化合物的概念
由 组成的 称为单质。由 组成的 称为化合物。
二、化学式表示的含义
1、表示 ;
2、表示 ;
3、表示 ;
4、表示 ;
5、表示 。
三、化合价及根据化合价书写物质的化学式
1、化合价的含义:各种元素在相互化合时,原子的个数比总是一定的,这种性质用________表示。
2、化合价的表示方法:在元素符号________用带“+”与“-”的小数字表示。
3、在化合物中氢元素通常显______价、氧元素______价。金属元素在化合物中通常显______价。非金属元素与氧元素结合时显______价,与氢元素或金属元素结合形成化合物时显______价。单质里元素的化合价为______。在化合物中,元素正负化合价的代数和为______。
4、常见元素的化合价口诀:
钾钠 氢 +1价;钙 钡锌 价;氟氯溴碘 价;通常 是-2价;
一二铜二三铁, 铝四硅五价磷;二四六硫二四碳,单质元素化合价为 。
5、常见原子团的化合价:
原子团 离子符号 电荷 化合价 原子团 离子符号 电荷 化合价
氢氧根 铵根
硝酸根 硫酸根
碳酸氢根 碳酸根
亚硫酸根
关系:离子所带的电荷数与元素化合价在数值上是相等的;离子所带的电荷的正负与元素化合价的正负相一致。
6、根据化合价书写化学式的口诀:
、 、 。
四、酸、碱、盐的定义
(1)酸: 。
(2)碱: 。
(3)盐: 。
五、部分酸、碱、盐物质在水中的溶解性口诀表
; ; ; 。
对于一水合氨的化学式,较早的教科书上有NH4OH的写法,现已禁用。本质的原因是,实验证明一水合氨是分子晶体,而不是离子晶体,不能写成铵根离子 (?http:?/??/?baike.baidu.com?/?item?/?%E9%93%B5%E6%A0%B9%E7%A6%BB%E5%AD%90" \t "http:?/??/?baike.baidu.com?/?_blank?)和氢氧根离子 (?http:?/??/?baike.baidu.com?/?item?/?%E6%B0%A2%E6%B0%A7%E6%A0%B9%E7%A6%BB%E5%AD%90" \t "http:?/??/?baike.baidu.com?/?_blank?)的组合体,一水合氨正确的化学式是NH3·H2O。
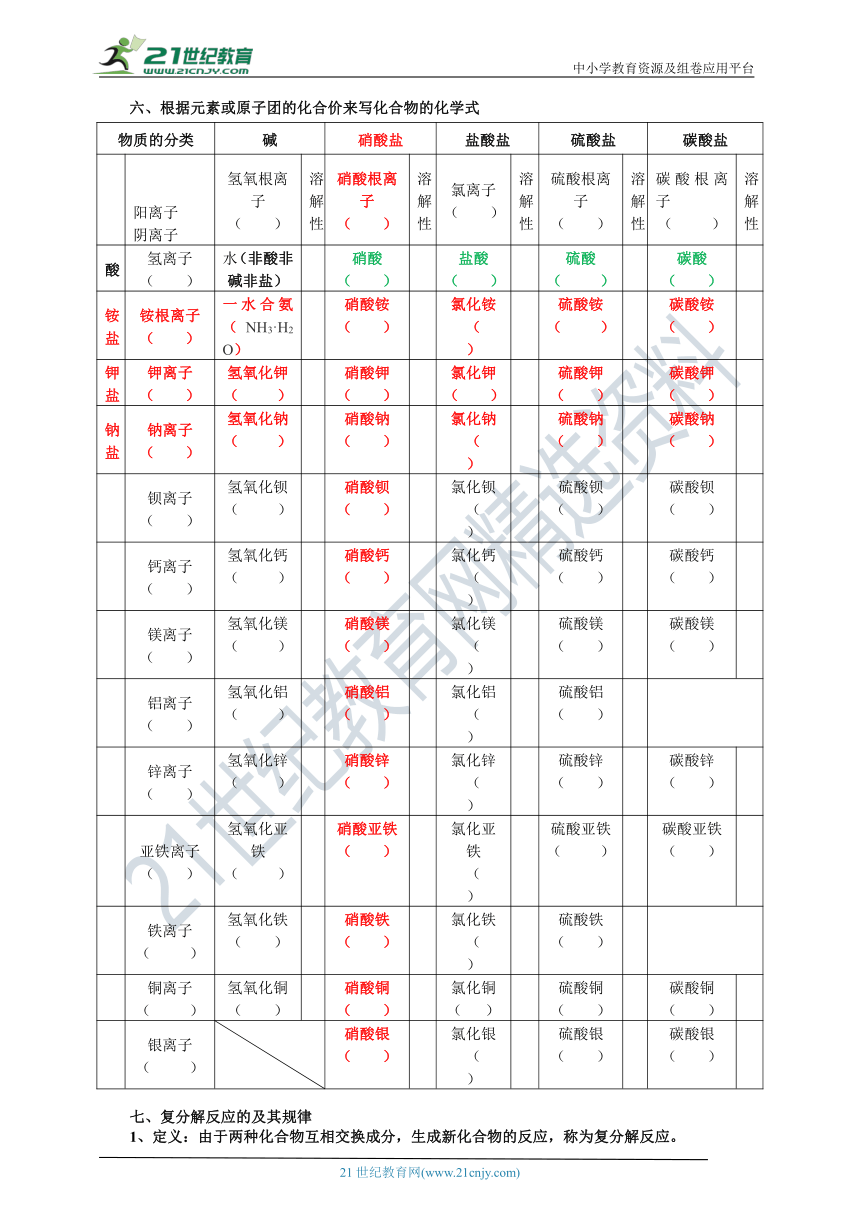
六、根据元素或原子团的化合价来写化合物的化学式
物质的分类 碱 硝酸盐 盐酸盐 硫酸盐 碳酸盐
阳离子阴离子 氢氧根离子 ( ) 溶解性 硝酸根离子 ( ) 溶解性 氯离子 ( ) 溶解性 硫酸根离子 ( ) 溶解性 碳酸根离子 ( ) 溶解性
酸 氢离子 ( ) 水(非酸非碱非盐) 硝酸 ( ) 盐酸 ( ) 硫酸 ( ) 碳酸 ( )
铵盐 铵根离子 ( ) 一水合氨(NH3·H2O) 硝酸铵 ( ) 氯化铵 ( ) 硫酸铵 ( ) 碳酸铵 ( )
钾盐 钾离子 ( ) 氢氧化钾 ( ) 硝酸钾 ( ) 氯化钾 ( ) 硫酸钾 ( ) 碳酸钾 ( )
钠盐 钠离子 ( ) 氢氧化钠 ( ) 硝酸钠 ( ) 氯化钠 ( ) 硫酸钠 ( ) 碳酸钠 ( )
钡离子 ( ) 氢氧化钡 ( ) 硝酸钡 ( ) 氯化钡 ( ) 硫酸钡 ( ) 碳酸钡 ( )
钙离子 ( ) 氢氧化钙 ( ) 硝酸钙 ( ) 氯化钙 ( ) 硫酸钙 ( ) 碳酸钙 ( )
镁离子 ( ) 氢氧化镁 ( ) 硝酸镁 ( ) 氯化镁 ( ) 硫酸镁 ( ) 碳酸镁 ( )
铝离子 ( ) 氢氧化铝 ( ) 硝酸铝 ( ) 氯化铝 ( ) 硫酸铝 ( )
锌离子 ( ) 氢氧化锌 ( ) 硝酸锌 ( ) 氯化锌 ( ) 硫酸锌 ( ) 碳酸锌 ( )
亚铁离子 ( ) 氢氧化亚铁 ( ) 硝酸亚铁 ( ) 氯化亚铁 ( ) 硫酸亚铁 ( ) 碳酸亚铁 ( )
铁离子 ( ) 氢氧化铁 ( ) 硝酸铁 ( ) 氯化铁 ( ) 硫酸铁 ( )
铜离子 ( ) 氢氧化铜 ( ) 硝酸铜 ( ) 氯化铜 ( ) 硫酸铜 ( ) 碳酸铜 ( )
银离子 ( ) 硝酸银 ( ) 氯化银 ( ) 硫酸银 ( ) 碳酸银 ( )
七、复分解反应的及其规律
1、定义:由于两种化合物互相交换成分,生成新化合物的反应,称为复分解反应。
2、酸、碱、盐之间发生的反应大多是复分解反应,复分解反应必须遵循以下规律:
反应类型 反应物 生成物
盐+盐
盐+碱
盐+酸
酸+碱
理解记忆口诀:反应物条件符合:有酸酸溶,无酸两溶。生成物满足:有沉淀、或气体、或水生成。
八、酸的5条通性
1、酸能使紫色石蕊试液变红色,不能使无色酚酞试液变色。
2、酸+金属盐+
Mg + H2SO4 MgSO4 + H2↑ (剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热。)
Mg+ 2HCl MgCl2 + H2↑
2Al +3H2SO4 Al2(SO4)3 +3H2↑
2Al + 6HC 2AlCl3 + 3H2↑
Zn + 2HCl ZnCl2 + H2↑
Fe + H2SO4 FeSO4 + H2↑ (反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色。)
Fe + 2HCl FeCl2 + H2↑
3、酸+碱性氧化物盐+水
Fe2O3 + 6HCl 2FeCl3 + 3H2O (现象:铁锈逐渐消失,溶液变黄色。应用于除锈。)
Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O
CuO + 2HCl CuCl2 + H2O
(现象:黑色粉未逐渐消失,溶液变蓝色。)
4、酸+碱盐+水 (酸和碱反应的实质是酸电离产生的H+和碱电离产生的OH-结合成中性的水)
HCl + NaOH NaCl +H2O
2HCl + Ca(OH)2 CaCl2 + 2H2O
3HCl + Al(OH)3 AlCl3 + 3H2O (用途:常用于治疗胃酸过多)
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2CO3 + Ca(OH)2 CaCO3↓+ 2H2O
5、酸+盐新酸+新盐
(注意生成物不要写成H2CO3)
CaCO3 + 2HCl CaCl2 + H2O + CO2↑ (用途:实验室制取二氧化碳、清除水垢、鸡蛋壳与盐酸反应。)
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
H2SO4 + BaCl2 BaSO4 ↓+ 2HCl
HCl + AgNO3 AgCl↓+ HNO3
九、可溶性碱的4条通性
1、碱能使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
2、碱+酸性氧化物盐+水
(常用于除去二氧化碳,也是氢氧化钠在空气中变质的原因。)
2NaOH + SO2 Na2SO3 + H2O (用于吸收二氧化硫气体。)
2NaOH + SO3 Na2SO4 + H2O
Ca(OH)2 + CO2 CaCO3 ↓+ H2O (用于检验是否有二氧化碳气体。)
Ca(OH)2 + SO2 CaSO3 ↓+ H2O
3、酸+碱盐+水
HCl + NaOH NaCl +H2O
2HCl + Ca(OH)2 CaCl2 + 2H2O
3HCl + Al(OH)3 AlCl3 + 3H2O (用途:常用于治疗胃酸过多)
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2CO3 + Ca(OH)2 CaCO3↓+ 2H2O
4、碱+盐新碱+新盐
(现象:有蓝色絮状沉淀生成。)
Ca(OH)2 + Na2CO3 CaCO3↓+ 2NaOH
3NaOH + FeCl3 3NaCl+ Fe(OH)3↓ (现象:有红褐色絮状沉淀生成。)
Ba(OH)2 + Cu2SO4 BaSO4↓+ Cu(OH)2↓ (有两种沉淀生成的复分解反应。)
拓展补充:
1、碱性氧化物(可溶)+水碱(可溶)
(可溶性碱可由其对应金属氧化物与水化合而得,而难溶性碱一般不能用其对应金属氧化物与水反应而得。如CuO与H2O不反应,即CuO─→Cu(OH)2不能通过一步反应完成。)
(现象:放出大量的热。用途:生石灰易与水反应,可以做干燥剂。Ca(OH)2有腐蚀性,不能食用。)
BaO+H2O Ba(OH)2
2、碱(难溶)碱氧(难溶)+水
(大多数难溶性碱受热容易分解,而可溶性碱通常是很稳定的,受热不易分解。)
十、盐的性质
1、使指示剂变色视情况而定情况,盐溶液有的呈中性,有的呈酸性,有的呈碱性。
2、盐+盐两种新盐
Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
3、碱+盐新碱+新盐
(现象:有蓝色絮状沉淀生成。)
Ca(OH)2 + Na2CO3 CaCO3↓+ 2NaOH
3NaOH + FeCl3 3NaCl+ Fe(OH)3↓ (现象:有红褐色絮状沉淀生成。)
Ba(OH)2 + Cu2SO4 BaSO4↓+ Cu(OH)2↓ (有两种沉淀生成的复分解反应。)
4、酸+盐新酸+新盐
(注意生成物不要写成H2CO3)
CaCO3 + 2HCl CaCl2 + H2O + CO2↑ (用途:实验室制取二氧化碳、清除水垢、鸡蛋壳与盐酸反应。)
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
H2SO4 + BaCl2 BaSO4 ↓+ 2HCl
HCl + AgNO3 AgCl↓+ HNO3
十一、常见溶液、物质的颜色
1.黄色溶液:含Fe3+的溶液,如Fe2(SO4)3、FeCl3、Fe(NO3)3溶液
2.蓝色溶液:含Cu2+的溶液,如CuSO4、CuCl2、Cu(NO3)2溶液
3.浅绿色溶液:含Fe2+的溶液,如FeSO4、FeCl2、Fe(NO3)2溶液
4.紫红色溶液:KMnO4溶液
5.无色溶液中,不含Cu2+、Fe3+、Fe2+、MnO4-(高锰酸根)离子的溶液一般为无色溶液
6.红褐色沉淀:Fe(OH)3
7.蓝色沉淀:Cu(OH)2
8.白色沉淀:AgCl、BaSO4(不溶于稀硝酸)
9.白色沉淀:CaCO3 、BaCO3 (可溶于稀硝酸)
10.黑色固体粉末:CuO、C粉、Fe3O4、Fe粉、MnO2
11.红色固体粉末:Cu粉、Fe2O3 、红磷
第1章 物质及其变化 核心知识记忆(教师版)
一、物质的化学式
1、含义:这种用 元素符号 来表示 物质组成 的式子称为化学式。一种纯净物,只有1个化学式。
2、单质和化合物的概念
由同种元素组成的纯净物称为单质。由不同种元素组成的纯净物称为化合物。
二、化学式表示的含义
1、表示某种物质;
2、表示某种物质的一个分子;
3、表示某种物质是由什么元素组成的;
4、表示某种物质的一个分子由几个什么原子构成的;
5、表示某种物质的相对分子质量为多少。
三、化合价及根据化合价书写物质的化学式
1、化合价的含义:各种元素在相互化合时,原子的个数比总是一定的,这种性质用化合价表示。
2、化合价的表示方法:在元素符号正上方用带“+”与“-”的小数字表示。
3、在化合物中氢元素通常显+1价、氧元素-2价。金属元素在化合物中通常显正价。非金属元素与氧元素结合时显正价,与氢元素或金属元素结合形成化合物时显负价。单质里元素的化合价为0。在化合物中,元素正负化合价的代数和为0。
4、常见元素的化合价口诀:
钾钠 银 氢 +1价;钙 镁 钡锌 +2 价;
氟氯溴碘 -1 价;通常 氧 是-2价;
一二铜二三铁, 三 铝四硅五价磷;
二四六硫二四碳,单质元素化合价为 0 。
5、常见原子团的化合价:
原子团 离子符号 电荷 化合价 原子团 离子符号 电荷 化合价
氢氧根 OH- -1 -1 铵根 NH4+ +1 +1
硝酸根 NO3- -1 -1 硫酸根 SO42- -2 -2
碳酸氢根 HCO3- -1 -1 碳酸根 CO32- -2 -2
亚硫酸根 SO32- -2 -2
关系:离子所带的电荷数与元素化合价在数值上是相等的;离子所带的电荷的正负与元素化合价的正负相一致。
6、根据化合价书写化学式的口诀:
正前负后 、 上方标价 、 交叉约分 。
四、酸、碱、盐的定义
(1)酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
(2)碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
(3)盐:电离时生成金属阳离子(或铵根离子)和酸根离子的化合物叫盐。
五、部分酸、碱、盐物质在水中的溶解性口诀表
钾、钠、铵、硝均可溶;盐酸盐不溶氯化银;硫酸盐不溶钡钙银;碳酸盐只溶钾钠铵。
对于一水合氨的化学式,较早的教科书上有NH4OH的写法,现已禁用。本质的原因是,实验证明一水合氨是分子晶体,而不是离子晶体,不能写成铵根离子 (?http:?/??/?baike.baidu.com?/?item?/?%E9%93%B5%E6%A0%B9%E7%A6%BB%E5%AD%90" \t "http:?/??/?baike.baidu.com?/?_blank?)和氢氧根离子 (?http:?/??/?baike.baidu.com?/?item?/?%E6%B0%A2%E6%B0%A7%E6%A0%B9%E7%A6%BB%E5%AD%90" \t "http:?/??/?baike.baidu.com?/?_blank?)的组合体,一水合氨正确的化学式是NH3·H2O。
六、根据元素或原子团的化合价来写化合物的化学式
物质的分类 碱 硝酸盐 盐酸盐 硫酸盐 碳酸盐
阳离子阴离子 氢氧根离子 ( OH- ) 溶解性 硝酸根离子 ( NO3- ) 溶解性 氯离子 ( Cl- ) 溶解性 硫酸根离子 ( SO42- ) 溶解性 碳酸根离子 ( CO32- ) 溶解性
氢离子 ( H+ ) (H2O) HNO3 溶 HCl 溶 H2SO4 溶 H2CO3 溶
铵根离子 ( NH4+ ) NH3·H2O 溶 NH4NO3 溶 NH4Cl 溶 (NH4)2SO4 溶 (NH4)2CO3 溶
钾离子 ( K+ ) KOH 溶 KNO3 溶 KCl 溶 K2SO4 溶 K2CO3 溶
钠离子 ( Na+ ) NaOH 溶 NaNO3 溶 NaCl 溶 Na2SO4 溶 Na2CO3 溶
钡离子 ( Ba2+ ) Ba(OH)2 溶 Ba(NO3)2 溶 BaCl2 溶 BaSO4 不 BaCO3 不
钙离子 ( Ca2+ ) Ca(OH)2 微 Ca(NO3)2 溶 CaCl2 溶 CaSO4 微 CaCO3 不
镁离子 ( Mg2+ ) Mg(OH)2 不 Mg(NO3)2 溶 MgCl2 溶 MgSO4 溶 MgCO3 不
铝离子 ( Al3+ ) Al(OH)3 不 Al (NO3)3 溶 Al Cl3 溶 Al 2(SO4)3 溶
锌离子 ( Zn2+ ) Zn(OH)2 不 Zn (NO3)2 溶 ZnCl2 溶 ZnSO4 溶 ZnCO3 不
亚铁离子 ( Fe2+) Fe(OH)2 不 Fe (NO3)2 溶 Fe Cl2 溶 Fe SO4 溶
铁离子 ( Fe3+ ) Fe(OH)3 不 Fe (NO3)3 溶 FeCl3 溶 Fe 2(SO4)3 溶 Fe 2(CO3)3 不
铜离子 ( Cu2+ ) Cu(OH)2 不 Cu (NO3)2 溶 CuCl2 溶 CuSO4 溶 CuCO3 不
银离子 (Ag+ ) Ag NO3 溶 Ag Cl 不 Ag2 SO4 微 Ag2 CO3 不
七、复分解反应的及其规律
1、定义:由于两种化合物互相交换成分,生成新化合物的反应,称为复分解反应。
2、酸、碱、盐之间发生的反应大多是复分解反应,复分解反应必须遵循以下规律:
反应类型 反应物 生成物
盐+盐 两种都可溶 生成物有要沉淀、或者气体、或者水。
盐+碱
盐+酸 酸可溶
酸+碱
理解记忆口诀:反应物条件符合:有酸酸溶,无酸两溶。生成物满足:有沉淀、或气体、或水生成。
八、酸的5条通性
1、酸能使紫色石蕊试液变红色,不能使无色酚酞试液变色。
2、酸+金属盐+
Mg + H2SO4 MgSO4 + H2↑ (剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热。)
Mg+ 2HCl MgCl2 + H2↑
2Al +3H2SO4 Al2(SO4)3 +3H2↑
2Al + 6HC 2AlCl3 + 3H2↑
Zn + 2HCl ZnCl2 + H2↑
Fe + H2SO4 FeSO4 + H2↑ (反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色。)
Fe + 2HCl FeCl2 + H2↑
3、酸+碱性氧化物盐+水
Fe2O3 + 6HCl 2FeCl3 + 3H2O (现象:铁锈逐渐消失,溶液变黄色。应用于除锈。)
Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O
CuO + 2HCl CuCl2 + H2O
(现象:黑色粉未逐渐消失,溶液变蓝色。)
4、酸+碱盐+水 (酸和碱反应的实质是酸电离产生的H+和碱电离产生的OH-结合成中性的水)
HCl + NaOH NaCl +H2O
2HCl + Ca(OH)2 CaCl2 + 2H2O
3HCl + Al(OH)3 AlCl3 + 3H2O (用途:常用于治疗胃酸过多)
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2CO3 + Ca(OH)2 CaCO3↓+ 2H2O
5、酸+盐新酸+新盐
(注意生成物不要写成H2CO3)
CaCO3 + 2HCl CaCl2 + H2O + CO2↑ (用途:实验室制取二氧化碳、清除水垢、鸡蛋壳与盐酸反应。)
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
H2SO4 + BaCl2 BaSO4 ↓+ 2HCl
HCl + AgNO3 AgCl↓+ HNO3
九、可溶性碱的4条通性
1、碱能使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
2、碱+酸性氧化物盐+水
(常用于除去二氧化碳,也是氢氧化钠在空气中变质的原因。)
2NaOH + SO2 Na2SO3 + H2O (用于吸收二氧化硫气体。)
2NaOH + SO3 Na2SO4 + H2O
Ca(OH)2 + CO2 CaCO3 ↓+ H2O (用于检验是否有二氧化碳气体。)
Ca(OH)2 + SO2 CaSO3 ↓+ H2O
3、酸+碱盐+水
HCl + NaOH NaCl +H2O
2HCl + Ca(OH)2 CaCl2 + 2H2O
3HCl + Al(OH)3 AlCl3 + 3H2O (用途:常用于治疗胃酸过多)
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2CO3 + Ca(OH)2 CaCO3↓+ 2H2O
4、碱+盐新碱+新盐
(现象:有蓝色絮状沉淀生成。)
Ca(OH)2 + Na2CO3 CaCO3↓+ 2NaOH
3NaOH + FeCl3 3NaCl+ Fe(OH)3↓ (现象:有红褐色絮状沉淀生成。)
Ba(OH)2 + Cu2SO4 BaSO4↓+ Cu(OH)2↓ (有两种沉淀生成的复分解反应。)
拓展补充:
1、碱性氧化物(可溶)+水碱(可溶)
(可溶性碱可由其对应金属氧化物与水化合而得,而难溶性碱一般不能用其对应金属氧化物与水反应而得。如CuO与H2O不反应,即CuO─→Cu(OH)2不能通过一步反应完成。)
(现象:放出大量的热。用途:生石灰易与水反应,可以做干燥剂。Ca(OH)2有腐蚀性,不能食用。)
BaO+H2O Ba(OH)2
2、碱(难溶)碱氧(难溶)+水
(大多数难溶性碱受热容易分解,而可溶性碱通常是很稳定的,受热不易分解。)
十、盐的性质
1、使指示剂变色视情况而定情况,盐溶液有的呈中性,有的呈酸性,有的呈碱性。
2、盐+盐两种新盐
Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
3、碱+盐新碱+新盐
(现象:有蓝色絮状沉淀生成。)
Ca(OH)2 + Na2CO3 CaCO3↓+ 2NaOH
3NaOH + FeCl3 3NaCl+ Fe(OH)3↓ (现象:有红褐色絮状沉淀生成。)
Ba(OH)2 + Cu2SO4 BaSO4↓+ Cu(OH)2↓ (有两种沉淀生成的复分解反应。)
4、酸+盐新酸+新盐
(注意生成物不要写成H2CO3)
CaCO3 + 2HCl CaCl2 + H2O + CO2↑ (用途:实验室制取二氧化碳、清除水垢、鸡蛋壳与盐酸反应。)
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
H2SO4 + BaCl2 BaSO4 ↓+ 2HCl
HCl + AgNO3 AgCl↓+ HNO3
十一、常见溶液、物质的颜色
1.黄色溶液:含Fe3+的溶液,如Fe2(SO4)3、FeCl3、Fe(NO3)3溶液
2.蓝色溶液:含Cu2+的溶液,如CuSO4、CuCl2、Cu(NO3)2溶液
3.浅绿色溶液:含Fe2+的溶液,如FeSO4、FeCl2、Fe(NO3)2溶液
4.紫红色溶液:KMnO4溶液
5.无色溶液中,不含Cu2+、Fe3+、Fe2+、MnO4-(高锰酸根)离子的溶液一般为无色溶液
6.红褐色沉淀:Fe(OH)3
7.蓝色沉淀:Cu(OH)2
8.白色沉淀:AgCl、BaSO4(不溶于稀硝酸)
9.白色沉淀:CaCO3 、BaCO3 (可溶于稀硝酸)
10.黑色固体粉末:CuO、C粉、Fe3O4、Fe粉、MnO2
11.红色固体粉末:Cu粉、Fe2O3 、红磷
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
