人教版高中化学选修四第一章《化学反应与能量》检测题
文档属性
| 名称 | 人教版高中化学选修四第一章《化学反应与能量》检测题 |  | |
| 格式 | zip | ||
| 文件大小 | 95.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-26 10:10:09 | ||
图片预览


文档简介
《化学反应与能量》检测题
一、单选题
1.CH4与Cl2反应的历程有:
①Cl—Cl→2Cl· ΔH1=243 kJ·mol-1
②Cl·+CH3—H→·CH3+H—Cl ΔH2=4 kJ·mol-1
③·CH3+Cl—Cl→CH3—Cl+Cl· ΔH3=-106 kJ·mol-1
则反应CH4(g)+Cl2(g)===CH3Cl(g)+HCl(g)的焓变应为( )
A. 110 kJ·mol-1 B. 141 kJ·mol-1 C. -102 kJ·mol-1 D. 102 kJ·mol-1
2.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应热为3695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
3.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和小于2 mol HF气体的能量
D. 该反应中的能量变化可用下图来表示
4.根据以下3个热化学方程式:
2H2S(g)+3O2(g)====2SO2(g)+2H2O(l)ΔH=﹣Q1kJ·
2H2S(g)+O2(g)====2S(s)+2H2O(l)ΔH=﹣Q2kJ·
2H2S(g)+O2(g)====2S(s)+2H2O(g)ΔH=﹣Q3kJ·
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
5.学校食堂为了让煤充分燃烧,达到节能减排的目的,正确合理的措施是( )
A. 增加煤的用量 B. 粉碎煤块 C. 提高锅炉的耐热性 D. 减少空气的通入量
6.在各种各样的能源中,风能属于( )
A. 化石能源 B. 生物质能 C. 二次能源 D. 可再生能源
7.H2和I2在一定条件下能发生反应:H2(g) + I2(g)2HI(g) ΔH=﹣akJ·下列说法正确的是 ( )
A. H2、I2和HI分子中的化学键都是非极性共价键
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C. 相同条件下,1 mol H2(g)和1 mol I2(g)总能量小于2 mol HI (g)的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2akJ
8.下列关于热化学反应的描述中正确的是( )
A. 已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2 800 kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
9.天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为CH4+2O2―→CO2+2H2O,C3H8+5O2―→3CO2+4H2O。
将一套以天然气为燃料的灶具改用液化石油气为燃料,应采取的正确措施是( )
A. 增大空气进入量或减小石油气进入量
B. 同时增大空气和石油气进入量
C. 减小空气进入量或增大石油气进入量
D. 同时减小空气和石油气进入量
10.已知H2(g)+ Cl2(g)====2HCl(g)ΔH=-184.6 kJ·,则反应
HCl(g)═H2(g)+Cl2(g)的ΔH为 ( )
A. +184.6 kJ· B. -92.3 kJ· C. +92.3kJ D. +92.3 kJ·
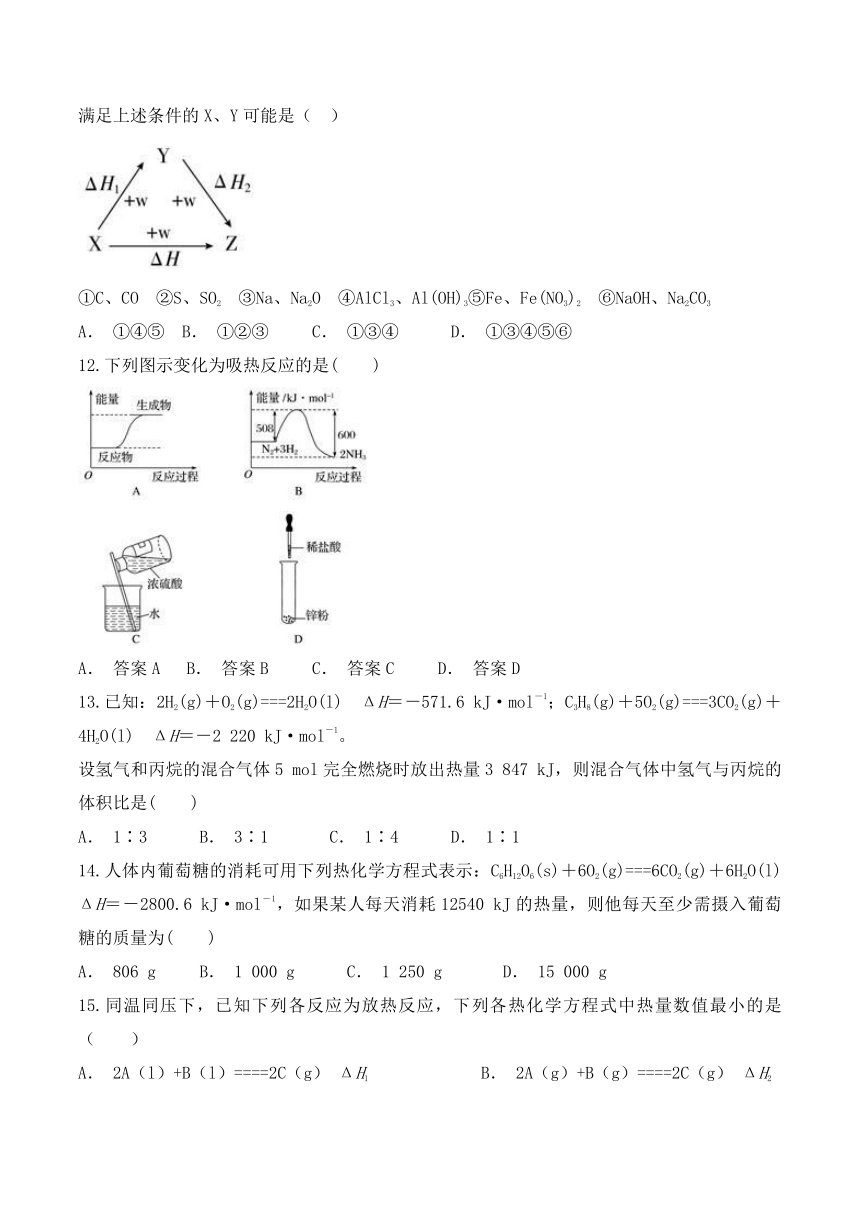
11.符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2满足上述条件的X、Y可能是( )
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
12.下列图示变化为吸热反应的是( )
A. 答案A B. 答案B C. 答案C D. 答案D
13.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1。
设氢气和丙烷的混合气体5 mol完全燃烧时放出热量3 847 kJ,则混合气体中氢气与丙烷的体积比是( )
A. 1∶3 B. 3∶1 C. 1∶4 D. 1∶1
14.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2800.6 kJ·mol-1,如果某人每天消耗12540 kJ的热量,则他每天至少需摄入葡萄糖的质量为( )
A. 806 g B. 1 000 g C. 1 250 g D. 15 000 g
15.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是( )
A. 2A(l)+B(l)====2C(g) ΔH1 B. 2A(g)+B(g)====2C(g) ΔH2
C. 2A(g)+B(g)====2C(l) ΔH3 D. 2A(l)+B(l)====2C(l) ΔH4
二、实验题
16.请写出影响燃烧的剧烈程度的一个因素并用实验进行验证:
17.小明在爸爸的实验室里看到如图所示的“保温瓶式量热计”。这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量。爸爸将不同浓度的酸(A)和碱(B)溶液各100 mL在量热计中混合,让小明记录了每次混合前后量热计温度的升高值Δt,得到下表:
请就此实验回答下列问题:
(1)盐酸、硫酸与NaOH反应是____(填“吸热”或“放热”)反应。
(2)第1次和第3次实验中温度升高相同的可能原因是______________________________
________________________________________________________________________。
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是________。
A.使用盐酸还是硫酸
B.量热计的保温效果
C.参加反应的酸或碱的量
三、计算题
18.已知:450 ℃时,2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1。将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中反应,在一定条件下测得c(SO3)=0.040 mol·L-1,计算此过程中放出的热量________。
19.白磷与氧可发生如下反应:P4+5O2====P4O10。已知断裂下列化学键需要吸收的能量分别为:P—PakJ·、P—ObkJ·、P==OckJ·、O==OdkJ·根据图示的分子结构和有关数据计算该反应的反应热 。
20.乙炔(C2H2)气体的燃烧热为ΔH=-1 299.6 kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式。
答案解析
1.C 2.B 3.D 4.A 5.B 6.D 7.B 8.D 9.A 10.D 11.A 12.A 13.B 14.A 15.A
16.
17.(1)放热 (2)两次反应消耗的NaOH质量相等 (3)C
18.3.932 kJ
19.(6a+5d﹣4c﹣12b)kJ·
20.2C2H2(g)+ 5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1
C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1
一、单选题
1.CH4与Cl2反应的历程有:
①Cl—Cl→2Cl· ΔH1=243 kJ·mol-1
②Cl·+CH3—H→·CH3+H—Cl ΔH2=4 kJ·mol-1
③·CH3+Cl—Cl→CH3—Cl+Cl· ΔH3=-106 kJ·mol-1
则反应CH4(g)+Cl2(g)===CH3Cl(g)+HCl(g)的焓变应为( )
A. 110 kJ·mol-1 B. 141 kJ·mol-1 C. -102 kJ·mol-1 D. 102 kJ·mol-1
2.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应热为3695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
3.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和小于2 mol HF气体的能量
D. 该反应中的能量变化可用下图来表示
4.根据以下3个热化学方程式:
2H2S(g)+3O2(g)====2SO2(g)+2H2O(l)ΔH=﹣Q1kJ·
2H2S(g)+O2(g)====2S(s)+2H2O(l)ΔH=﹣Q2kJ·
2H2S(g)+O2(g)====2S(s)+2H2O(g)ΔH=﹣Q3kJ·
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
5.学校食堂为了让煤充分燃烧,达到节能减排的目的,正确合理的措施是( )
A. 增加煤的用量 B. 粉碎煤块 C. 提高锅炉的耐热性 D. 减少空气的通入量
6.在各种各样的能源中,风能属于( )
A. 化石能源 B. 生物质能 C. 二次能源 D. 可再生能源
7.H2和I2在一定条件下能发生反应:H2(g) + I2(g)2HI(g) ΔH=﹣akJ·下列说法正确的是 ( )
A. H2、I2和HI分子中的化学键都是非极性共价键
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C. 相同条件下,1 mol H2(g)和1 mol I2(g)总能量小于2 mol HI (g)的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2akJ
8.下列关于热化学反应的描述中正确的是( )
A. 已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2 800 kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
9.天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为CH4+2O2―→CO2+2H2O,C3H8+5O2―→3CO2+4H2O。
将一套以天然气为燃料的灶具改用液化石油气为燃料,应采取的正确措施是( )
A. 增大空气进入量或减小石油气进入量
B. 同时增大空气和石油气进入量
C. 减小空气进入量或增大石油气进入量
D. 同时减小空气和石油气进入量
10.已知H2(g)+ Cl2(g)====2HCl(g)ΔH=-184.6 kJ·,则反应
HCl(g)═H2(g)+Cl2(g)的ΔH为 ( )
A. +184.6 kJ· B. -92.3 kJ· C. +92.3kJ D. +92.3 kJ·
11.符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2满足上述条件的X、Y可能是( )
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
12.下列图示变化为吸热反应的是( )
A. 答案A B. 答案B C. 答案C D. 答案D
13.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1。
设氢气和丙烷的混合气体5 mol完全燃烧时放出热量3 847 kJ,则混合气体中氢气与丙烷的体积比是( )
A. 1∶3 B. 3∶1 C. 1∶4 D. 1∶1
14.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2800.6 kJ·mol-1,如果某人每天消耗12540 kJ的热量,则他每天至少需摄入葡萄糖的质量为( )
A. 806 g B. 1 000 g C. 1 250 g D. 15 000 g
15.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是( )
A. 2A(l)+B(l)====2C(g) ΔH1 B. 2A(g)+B(g)====2C(g) ΔH2
C. 2A(g)+B(g)====2C(l) ΔH3 D. 2A(l)+B(l)====2C(l) ΔH4
二、实验题
16.请写出影响燃烧的剧烈程度的一个因素并用实验进行验证:
17.小明在爸爸的实验室里看到如图所示的“保温瓶式量热计”。这种仪器由保温和测温两部分组成的,它不让反应产生的热散失出去,也不让外界的热传递进来,可用于测量化学反应产生的热量。爸爸将不同浓度的酸(A)和碱(B)溶液各100 mL在量热计中混合,让小明记录了每次混合前后量热计温度的升高值Δt,得到下表:
请就此实验回答下列问题:
(1)盐酸、硫酸与NaOH反应是____(填“吸热”或“放热”)反应。
(2)第1次和第3次实验中温度升高相同的可能原因是______________________________
________________________________________________________________________。
(3)分析上述数据可知下列因素中,与反应放出或吸收热量多少有关的是________。
A.使用盐酸还是硫酸
B.量热计的保温效果
C.参加反应的酸或碱的量
三、计算题
18.已知:450 ℃时,2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1。将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中反应,在一定条件下测得c(SO3)=0.040 mol·L-1,计算此过程中放出的热量________。
19.白磷与氧可发生如下反应:P4+5O2====P4O10。已知断裂下列化学键需要吸收的能量分别为:P—PakJ·、P—ObkJ·、P==OckJ·、O==OdkJ·根据图示的分子结构和有关数据计算该反应的反应热 。
20.乙炔(C2H2)气体的燃烧热为ΔH=-1 299.6 kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式。
答案解析
1.C 2.B 3.D 4.A 5.B 6.D 7.B 8.D 9.A 10.D 11.A 12.A 13.B 14.A 15.A
16.
17.(1)放热 (2)两次反应消耗的NaOH质量相等 (3)C
18.3.932 kJ
19.(6a+5d﹣4c﹣12b)kJ·
20.2C2H2(g)+ 5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1
C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1
