人教版高中化学必修一第二章第二节离子反应 课件(共26张ppt)
文档属性
| 名称 | 人教版高中化学必修一第二章第二节离子反应 课件(共26张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-28 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
[教学目标]
1、掌握概念——电解质、非电解质、强电解质和弱电解质、电离。
2、掌握电离方程式的书写。
3、区别电解质和非电解质。
区别强电解质和弱电解质
[教学重点难点]
电解质、非电解质的概念、探究碱和盐的定义
复习引入
溶液导电性实验
溶液导电性
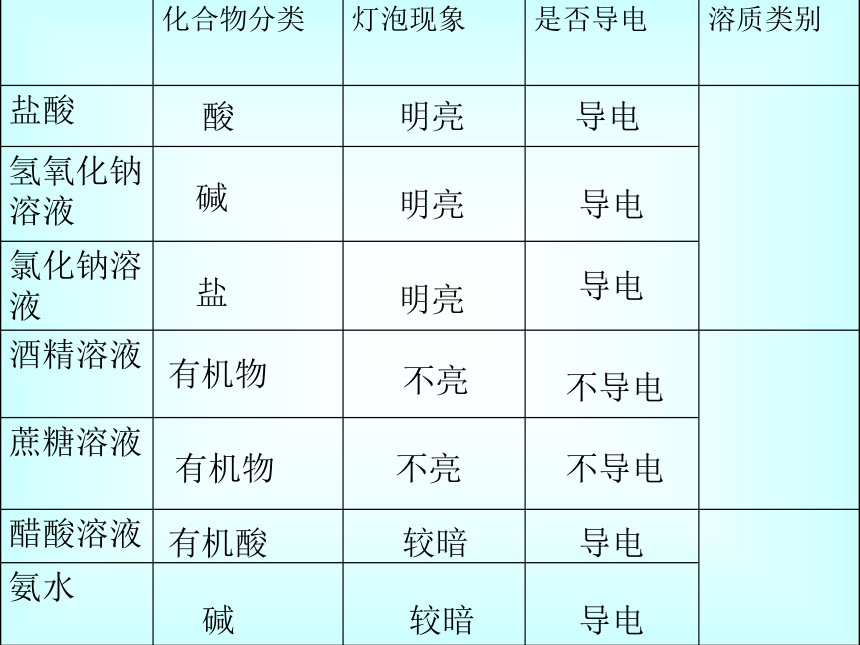
同浓度的盐酸、氢氧化钠溶液、氯化钠溶液、酒精、蔗糖溶液、醋酸溶液、氨水的导电性实验
观察现象(填表)
思考导电的原理
酸
碱
盐
碱
有机物
有机物
有机酸
明亮
明亮
明亮
不亮
不亮
较暗
较暗
导电
导电
导电
不导电
不导电
导电
导电
化合物分类 灯泡现象
是否导电
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
酒精溶液
蔗糖溶液
醋酸溶液
氨水
回顾物质的分类:
混和物
纯净物
化合物
单质
电解质
非电解质
物质
氧化物
酸
碱
盐
在水溶液或熔融状态下能否导电
电解质
非电解质
电解质
化合物分类 灯泡现象
是否导电
溶质类别
盐酸 酸 明亮 导电
氢氧化钠溶液 碱 明亮 导电
氯化钠溶液 盐 明亮 导电
酒精溶液 有机物 不亮 不导电
蔗糖溶液 有机物 不亮 不导电
醋酸溶液 有机酸 较暗 导电
氨水 碱 较暗 导电
非电解质:在水溶液里和熔融状态下都不能导电的化合物。如蔗糖、乙醇等。
一、电解质和非电解质
电解质:在水溶液里或熔融状态下能导电 的 化合物 。如HCl、NaOH、 NaCl、CH3COOH、 NH3·H2O等。
A:金属铁能导电,它是电解质。
B:NaCl溶液能导电,NaCl溶液是电解质。
C:固态NaCl不导电,但NaCl是电解质。
D:液态氯化氢不导电,HCl不是电解质。
E:SO3溶于水后所得溶液能导电,但SO3不是电解质。
√
X
X
√
X
F:BaSO4溶液几乎不导电, 但BaSO4是电解质。
X
√
G:Na2O是电解质是因为它的水溶液能导电
混和物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
物质
在水溶液或熔融状态下能否导电
注意!!!
1.电解质、非电解质是化合物。
2.电解质导电须有外界条件:水溶液或熔融状态。
3.电解质是在一定条件下本身电离而导电的化合物。
(1)酸性氧化物(如CO2、SO3等)虽然溶于水后能导电,但并非自身电离,且熔融不电离,故不是电解质。
(2)离子型氧化物(如Na2O、CaO等)虽然溶于水后并非自身电离,但熔融时却可电离,因此,是电解质。
4.某些难溶于水的化合物溶解部分完全电离,所以是电解质。
讨论分析下列物质哪些是电解质?哪些是非电解质?
①金属铜 ②固态NaCl ③SO3 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH溶液⑧蔗糖 ⑨ KOH ⑩MgO
电解质: 。
非电解质: 。
能导电的有: 。
②④⑨⑩
③⑧
①⑤ ⑦
回顾物质的分类:
混和物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
乙醇、蔗糖等
大部分有机物
非金属氧化物
NH3
物质
酸
碱
盐
水
金属氧化物
在水溶液或熔融状态下能否导电
二、电 离
电离:电解质在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么电解质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
酸
碱
盐
碱
有机物
有机物
有机酸
明亮
明亮
明亮
不亮
不亮
较暗
较暗
导电
导电
导电
不导电
不导电
导电
导电
溶液中有自由移动的离子
溶液中有自由移动的离子
溶液中无自由移动的离子
电解质
非电解质
电解质
化合物分类 灯泡现象
是否导电
性质分析
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
酒精溶液
蔗糖溶液
醋酸溶液
氨水
如书p30页 图2-9 NaCl在水中的溶解和电离示意图
1.酸:在水溶液中电离生成的阳离子全部是H+ 的化合物。
2.碱:在水溶液中电离生成的阴离子全部是OH-的化合物。
3.盐:在水溶液中电离时能生成金属阳离子(或者NH4+)和
酸根阴离子的化合物。
所以:酸、碱、盐都是电解质
电离的条件:
溶于水或高温熔化——不需要通电
酸、碱、盐的定义???
三、强电解质和弱电解质
不同电解质电离程度不同
为什么电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
酸
碱
盐
碱
有机酸
明亮
明亮
明亮
较暗
较暗
导电
导电
导电
导电
导电
溶液有自由移动的离子
溶液有自由移动的离子
电解质
电解质
强电解质
弱电解质
且
浓度大
且
浓度小
化合物分类 灯泡现象
是否导电
性质分析
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
醋酸溶液
氨水
H2O
H+ SO42-
H2O CH3COOH
H+ CH3COO-
硫酸溶液
醋酸溶液
H2SO4在水中全部电离
CH3COOH在水中部分电离
强电解质——在水溶液中全部电离的电解质。
如:强酸(HCl、HNO3、H2SO4、HBr、HI HClO4、HClO3)
强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]
大多数盐
弱电解质——在水溶液中部分电离的电解质。
如: 弱酸[H2CO3、醋酸(CH3COOH)等]
弱碱(NH3·H2O)
H2O
完全电离
部分电离
离子
分子,少量离子
强
弱
大多数盐类,强酸,强碱,(如 KOH, KNO3 , NaCl)
弱碱,水,弱酸
强电解质 弱电解质
电离程度
溶液中粒子
同浓度溶液导电性
物质
类别实例
四、电离方程式的书写:
1.强电解质一步完全电离,方程式中间用等号;
强酸一步电离出所有氢离子和酸根离子;
强碱一步电离出所有金属阳离子和氢氧根离子;
盐电离出所有金属阳离子(包括NH4+ )和酸根离子。
注意:电离方程式左右两边正负电荷之和相等。
2、必须遵守质量守恒和电荷守恒;
3、原子团不能拆开。
电离方程式:表示电解质的电离的式子。
例析:写出下列物质在水溶液的电离方程式
H2SO4
Ba(OH)2
NaCl
HCl
KOH
CuSO4
NaHSO4
NaHCO3
= 2H+ + SO42-
= Ba2+ + 2OH-
= Na+ + Cl-
= H+ + Cl-
= K+ + OH-
= Cu2+ + SO42-
= Na+ + H+ + SO42-
= Na+ + HCO3-
练习:写出溴化氢、硝酸钡、硫酸铝、碳酸钠在水溶液中的电离方程式。
HBr = H+ + Br-
Ba(NO3)2 = Ba2+ + 2NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
Na2CO3 = 2Na+ + CO32-
下列物质
① Cu ② NaCl固体 ③ CO2 ④熔融Na2O ⑤蔗糖⑥NaOH溶液⑦氨水⑧氯化氢⑨盐酸 ⑩硫酸钡
是电解质有
是非电解质有
能导电的有
水溶液能导电的有
练 习
②④⑧⑩
③⑤
①④⑥⑦⑨
②③④⑥⑦⑧⑨
小结
注意几个说法的区别:
电解质的强弱
导电性的强弱
溶解度的大小
概念:
电解质与非电解质,强电解质与非电解质;
电离与电离方程式。
强电解质的电离方程式的书写
?电解质导电,非电解质不导电
?强电解质导电性强,弱电解质导电性弱
——电离程度的大小
——自由移动离子浓度的大小
——溶质在水的分散情况
再见
2.弱电解质不完全电离,方程式中间用
可逆符号
多元弱酸分步电离出氢离子和酸根离子;
多元弱碱要求写一步电离出金属阳离子(包括NH4+ )和氢氧根离子;
水一步电离出氢离子和氢氧根离子。
[教学目标]
1、掌握概念——电解质、非电解质、强电解质和弱电解质、电离。
2、掌握电离方程式的书写。
3、区别电解质和非电解质。
区别强电解质和弱电解质
[教学重点难点]
电解质、非电解质的概念、探究碱和盐的定义
复习引入
溶液导电性实验
溶液导电性
同浓度的盐酸、氢氧化钠溶液、氯化钠溶液、酒精、蔗糖溶液、醋酸溶液、氨水的导电性实验
观察现象(填表)
思考导电的原理
酸
碱
盐
碱
有机物
有机物
有机酸
明亮
明亮
明亮
不亮
不亮
较暗
较暗
导电
导电
导电
不导电
不导电
导电
导电
化合物分类 灯泡现象
是否导电
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
酒精溶液
蔗糖溶液
醋酸溶液
氨水
回顾物质的分类:
混和物
纯净物
化合物
单质
电解质
非电解质
物质
氧化物
酸
碱
盐
在水溶液或熔融状态下能否导电
电解质
非电解质
电解质
化合物分类 灯泡现象
是否导电
溶质类别
盐酸 酸 明亮 导电
氢氧化钠溶液 碱 明亮 导电
氯化钠溶液 盐 明亮 导电
酒精溶液 有机物 不亮 不导电
蔗糖溶液 有机物 不亮 不导电
醋酸溶液 有机酸 较暗 导电
氨水 碱 较暗 导电
非电解质:在水溶液里和熔融状态下都不能导电的化合物。如蔗糖、乙醇等。
一、电解质和非电解质
电解质:在水溶液里或熔融状态下能导电 的 化合物 。如HCl、NaOH、 NaCl、CH3COOH、 NH3·H2O等。
A:金属铁能导电,它是电解质。
B:NaCl溶液能导电,NaCl溶液是电解质。
C:固态NaCl不导电,但NaCl是电解质。
D:液态氯化氢不导电,HCl不是电解质。
E:SO3溶于水后所得溶液能导电,但SO3不是电解质。
√
X
X
√
X
F:BaSO4溶液几乎不导电, 但BaSO4是电解质。
X
√
G:Na2O是电解质是因为它的水溶液能导电
混和物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
物质
在水溶液或熔融状态下能否导电
注意!!!
1.电解质、非电解质是化合物。
2.电解质导电须有外界条件:水溶液或熔融状态。
3.电解质是在一定条件下本身电离而导电的化合物。
(1)酸性氧化物(如CO2、SO3等)虽然溶于水后能导电,但并非自身电离,且熔融不电离,故不是电解质。
(2)离子型氧化物(如Na2O、CaO等)虽然溶于水后并非自身电离,但熔融时却可电离,因此,是电解质。
4.某些难溶于水的化合物溶解部分完全电离,所以是电解质。
讨论分析下列物质哪些是电解质?哪些是非电解质?
①金属铜 ②固态NaCl ③SO3 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH溶液⑧蔗糖 ⑨ KOH ⑩MgO
电解质: 。
非电解质: 。
能导电的有: 。
②④⑨⑩
③⑧
①⑤ ⑦
回顾物质的分类:
混和物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
乙醇、蔗糖等
大部分有机物
非金属氧化物
NH3
物质
酸
碱
盐
水
金属氧化物
在水溶液或熔融状态下能否导电
二、电 离
电离:电解质在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么电解质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
酸
碱
盐
碱
有机物
有机物
有机酸
明亮
明亮
明亮
不亮
不亮
较暗
较暗
导电
导电
导电
不导电
不导电
导电
导电
溶液中有自由移动的离子
溶液中有自由移动的离子
溶液中无自由移动的离子
电解质
非电解质
电解质
化合物分类 灯泡现象
是否导电
性质分析
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
酒精溶液
蔗糖溶液
醋酸溶液
氨水
如书p30页 图2-9 NaCl在水中的溶解和电离示意图
1.酸:在水溶液中电离生成的阳离子全部是H+ 的化合物。
2.碱:在水溶液中电离生成的阴离子全部是OH-的化合物。
3.盐:在水溶液中电离时能生成金属阳离子(或者NH4+)和
酸根阴离子的化合物。
所以:酸、碱、盐都是电解质
电离的条件:
溶于水或高温熔化——不需要通电
酸、碱、盐的定义???
三、强电解质和弱电解质
不同电解质电离程度不同
为什么电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
酸
碱
盐
碱
有机酸
明亮
明亮
明亮
较暗
较暗
导电
导电
导电
导电
导电
溶液有自由移动的离子
溶液有自由移动的离子
电解质
电解质
强电解质
弱电解质
且
浓度大
且
浓度小
化合物分类 灯泡现象
是否导电
性质分析
溶质类别
盐酸
氢氧化钠溶液
氯化钠溶液
醋酸溶液
氨水
H2O
H+ SO42-
H2O CH3COOH
H+ CH3COO-
硫酸溶液
醋酸溶液
H2SO4在水中全部电离
CH3COOH在水中部分电离
强电解质——在水溶液中全部电离的电解质。
如:强酸(HCl、HNO3、H2SO4、HBr、HI HClO4、HClO3)
强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]
大多数盐
弱电解质——在水溶液中部分电离的电解质。
如: 弱酸[H2CO3、醋酸(CH3COOH)等]
弱碱(NH3·H2O)
H2O
完全电离
部分电离
离子
分子,少量离子
强
弱
大多数盐类,强酸,强碱,(如 KOH, KNO3 , NaCl)
弱碱,水,弱酸
强电解质 弱电解质
电离程度
溶液中粒子
同浓度溶液导电性
物质
类别实例
四、电离方程式的书写:
1.强电解质一步完全电离,方程式中间用等号;
强酸一步电离出所有氢离子和酸根离子;
强碱一步电离出所有金属阳离子和氢氧根离子;
盐电离出所有金属阳离子(包括NH4+ )和酸根离子。
注意:电离方程式左右两边正负电荷之和相等。
2、必须遵守质量守恒和电荷守恒;
3、原子团不能拆开。
电离方程式:表示电解质的电离的式子。
例析:写出下列物质在水溶液的电离方程式
H2SO4
Ba(OH)2
NaCl
HCl
KOH
CuSO4
NaHSO4
NaHCO3
= 2H+ + SO42-
= Ba2+ + 2OH-
= Na+ + Cl-
= H+ + Cl-
= K+ + OH-
= Cu2+ + SO42-
= Na+ + H+ + SO42-
= Na+ + HCO3-
练习:写出溴化氢、硝酸钡、硫酸铝、碳酸钠在水溶液中的电离方程式。
HBr = H+ + Br-
Ba(NO3)2 = Ba2+ + 2NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
Na2CO3 = 2Na+ + CO32-
下列物质
① Cu ② NaCl固体 ③ CO2 ④熔融Na2O ⑤蔗糖⑥NaOH溶液⑦氨水⑧氯化氢⑨盐酸 ⑩硫酸钡
是电解质有
是非电解质有
能导电的有
水溶液能导电的有
练 习
②④⑧⑩
③⑤
①④⑥⑦⑨
②③④⑥⑦⑧⑨
小结
注意几个说法的区别:
电解质的强弱
导电性的强弱
溶解度的大小
概念:
电解质与非电解质,强电解质与非电解质;
电离与电离方程式。
强电解质的电离方程式的书写
?电解质导电,非电解质不导电
?强电解质导电性强,弱电解质导电性弱
——电离程度的大小
——自由移动离子浓度的大小
——溶质在水的分散情况
再见
2.弱电解质不完全电离,方程式中间用
可逆符号
多元弱酸分步电离出氢离子和酸根离子;
多元弱碱要求写一步电离出金属阳离子(包括NH4+ )和氢氧根离子;
水一步电离出氢离子和氢氧根离子。
