鲁教版九年级上册化学 4.4 到实验室去:氧气的实验室制取与性质 课件(16张PPT)
文档属性
| 名称 | 鲁教版九年级上册化学 4.4 到实验室去:氧气的实验室制取与性质 课件(16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 598.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-30 14:55:05 | ||
图片预览






文档简介
课件16张PPT。 氧气的实验室制取与性质态度决定一切细节决定成败到实验室去教学目标1. 依据实验室制取氧气的反应原理,能选择合适的装置、能制备2—3瓶氧气,并会检验氧气;能用实验验证氧气的部分化学性质。
2. 初步学会实验探究法和运用比较学习法;3.激发学生学习化学的兴趣和合作探究的意识,培养良好的实验习惯和规范的实验操作能力。重点与难点
重点 :
难点:
实验室制取氧气的反应原理和方法
体会实验室制取氧气的一般思路和方法
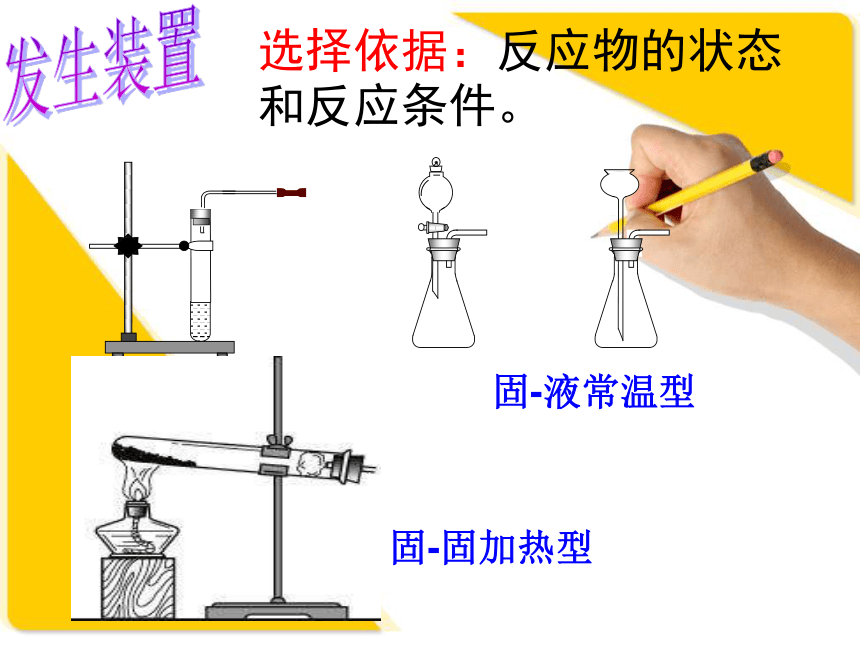
反应原理: 过氧化氢 水+氧气二氧化锰【复习回顾】 高锰酸钾 锰酸钾+二氧化锰+氧气加热发生装置固-液常温型固-固加热型选择依据:反应物的状态和反应条件。
d.分液漏斗装置的优点:可以随时添加液体,可以控制反应的速率。 过氧化氢制取氧气注意事项a.分液漏斗可以用长颈漏斗代替,但长颈漏斗下端应该伸入液面以下,防止生成的气体从长颈漏斗下端管口逸出;b.试管内导气管只需略露出橡皮塞即可;c.装药品时,先装固体后装液体 ;查(茶):检查装置的气密性;
装(庄):装药品,并在试管口放一团棉花;
定(定):固定仪器,使试管口稍向下倾斜;
点(点):点燃酒精灯加热;
收(收):收集氧气;
离(利):先将导管撤离水面,再移酒精灯。
熄(息):熄灭酒精灯。高锰酸钾制取氧气的操作步骤排水法向上排空气法向下排空气法选择依据:气体的水溶性、气体的密度。收集装置铁丝在空气中与在氧气中比较:木炭在氧气中燃烧:动手实验 注意合理安排时间;
保持地面和桌面的整洁;
注意实验操作规范性。
温馨提示反思与交流你是否顺利完成了本次实验?
有哪些经验与教训与同学们分享?2.在化学反应中,催化剂( )
A、质量减少 B、在反应后化学性质发生了变化
C、质量增加 D、能改变化学反应的速率1、过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解产生氧气,分液漏斗可以通过调节活塞控制液体的滴加速度。根据下图所示回答问题:
(1)分液漏斗中放入的物质是 ,
试管中放入的物质 ;
(2)写出该方法制取氧气的文字表达式
;D过氧化氢二氧化锰中考链接3、下图是实验室用高锰酸钾制取和收集氧气的装置图,指出其中的四处错误?②③④①
2. 初步学会实验探究法和运用比较学习法;3.激发学生学习化学的兴趣和合作探究的意识,培养良好的实验习惯和规范的实验操作能力。重点与难点
重点 :
难点:
实验室制取氧气的反应原理和方法
体会实验室制取氧气的一般思路和方法
反应原理: 过氧化氢 水+氧气二氧化锰【复习回顾】 高锰酸钾 锰酸钾+二氧化锰+氧气加热发生装置固-液常温型固-固加热型选择依据:反应物的状态和反应条件。
d.分液漏斗装置的优点:可以随时添加液体,可以控制反应的速率。 过氧化氢制取氧气注意事项a.分液漏斗可以用长颈漏斗代替,但长颈漏斗下端应该伸入液面以下,防止生成的气体从长颈漏斗下端管口逸出;b.试管内导气管只需略露出橡皮塞即可;c.装药品时,先装固体后装液体 ;查(茶):检查装置的气密性;
装(庄):装药品,并在试管口放一团棉花;
定(定):固定仪器,使试管口稍向下倾斜;
点(点):点燃酒精灯加热;
收(收):收集氧气;
离(利):先将导管撤离水面,再移酒精灯。
熄(息):熄灭酒精灯。高锰酸钾制取氧气的操作步骤排水法向上排空气法向下排空气法选择依据:气体的水溶性、气体的密度。收集装置铁丝在空气中与在氧气中比较:木炭在氧气中燃烧:动手实验 注意合理安排时间;
保持地面和桌面的整洁;
注意实验操作规范性。
温馨提示反思与交流你是否顺利完成了本次实验?
有哪些经验与教训与同学们分享?2.在化学反应中,催化剂( )
A、质量减少 B、在反应后化学性质发生了变化
C、质量增加 D、能改变化学反应的速率1、过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解产生氧气,分液漏斗可以通过调节活塞控制液体的滴加速度。根据下图所示回答问题:
(1)分液漏斗中放入的物质是 ,
试管中放入的物质 ;
(2)写出该方法制取氧气的文字表达式
;D过氧化氢二氧化锰中考链接3、下图是实验室用高锰酸钾制取和收集氧气的装置图,指出其中的四处错误?②③④①
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
