沪教版(上海)化学专题讲义:第四章:碳及其化合物 (含部分答案)
文档属性
| 名称 | 沪教版(上海)化学专题讲义:第四章:碳及其化合物 (含部分答案) | 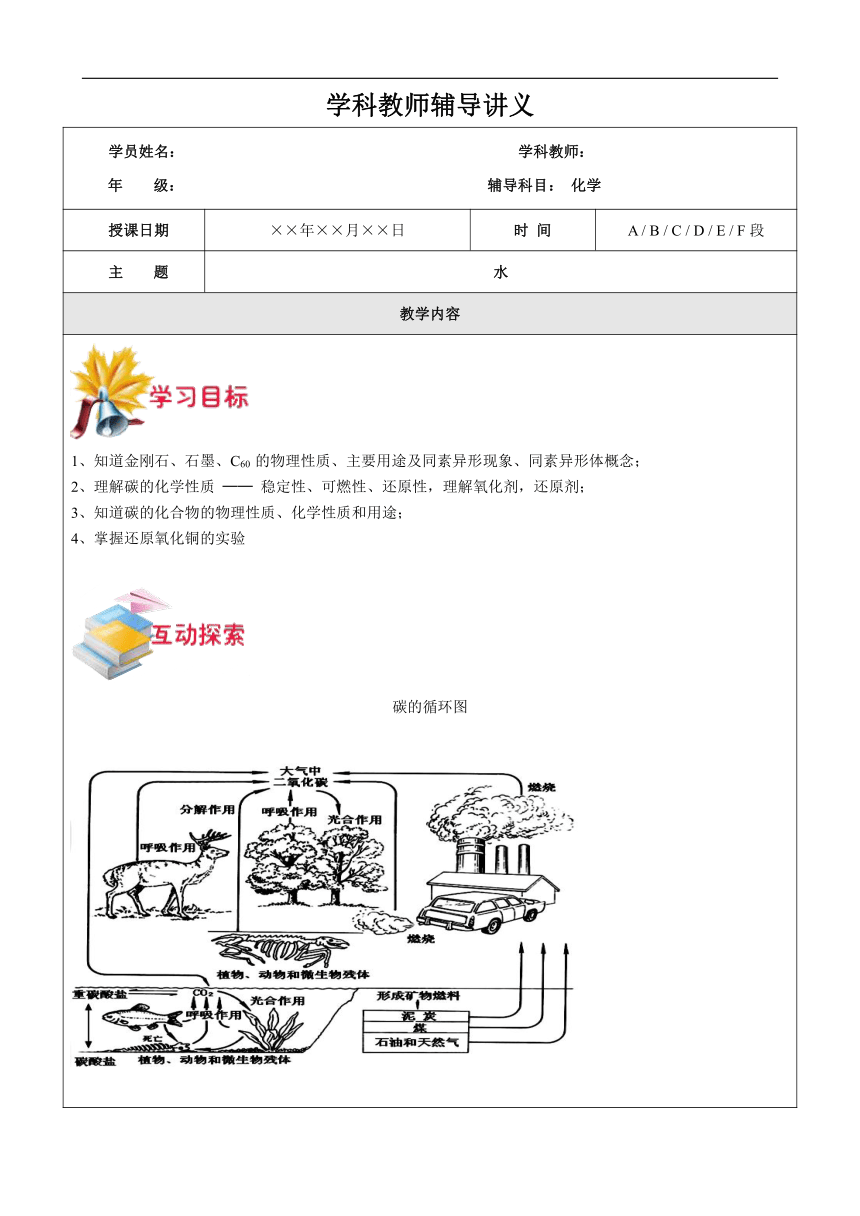 | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-30 16:41:19 | ||
图片预览





文档简介
学科教师辅导讲义
学员姓名: 学科教师:
年 级: 辅导科目: 化学
授课日期
××年××月××日
时 间
A / B / C / D / E / F段
主 题
水
教学内容
1、知道金刚石、石墨、C60 的物理性质、主要用途及同素异形现象、同素异形体概念;
2、理解碳的化学性质 ── 稳定性、可燃性、还原性,理解氧化剂,还原剂;
3、知道碳的化合物的物理性质、化学性质和用途;
4、掌握还原氧化铜的实验
碳的循环图
一、碳单质
C60 —— 足球烯:C60 分子是由 60 个碳原子构成,形似足球,很稳定。C60 有许多优异的性能,可制碳纳米管。具有抗腐蚀性、耐高压等功能。
【问】金刚石、石墨和 C60 物理性质上为什么有那么大的差异?
微观结构:
金刚石、石墨、C60 都是由碳元素组成的不同单质,性质上有如此大的差异是由于碳原子的排列顺序不同,即结构决定性质,性质决定用途。
1、同素异形体
同素异形现象:这种同一种元素组成的不同单质的现象。
金刚石、石墨与C60 ,氧气 (O2) 与臭氧 (O3),白磷与红磷都互为同素异形体。 因此,说“由同种元素组成的物质是单质”是错误的,有可能是单质,也可能是混合物,但绝不会是化合物。
2、无定形碳
3、碳与炭
“碳”是元素的名称,元素符号为 C。常在书写碳元素的单质及含有碳元素的化合物名称时使用。如碳元素、碳-60、一氧化碳、二氧化碳、碳酸、碳酸钙、碳氢化合物等。
“炭”仅在书写由碳元素组成的无定形碳的名称时使用,如木炭、活性炭、焦炭、炭黑等,因为这些物质的组成中除碳单质还含有其它的一些杂质。所以,严格的说,无定形碳不属于碳的同素异形体。
【实验】木炭的吸附性
实验内容:
1、把木炭放入盛满 NO2 气体的锥形瓶,塞好塞子,摇动片刻,观察现象。
2、把木炭放入滴有红墨水的锥形瓶,摇动片刻,观察现象。
实验现象:
1、盛满 NO2 气体的锥形瓶放入木炭,红棕色褪去;
2、滴有红墨水的锥形瓶中红色也消失。
实验结论:
木炭能吸附红色和棕红色物质,说明木炭具有吸附性。
实验分析:
由于木炭具有疏松多孔的结构,能把大量气体、液体或溶液中的某些溶质吸附在其表面,这是一个物理变化过程。吸附性是物理性质。活性炭的吸附能力比木炭还要强。
举出生活中运用吸附原理的具体事例:
防毒面具里的滤毒罐就是利用活性炭来吸附毒气;
净水器中的滤芯装有活性炭来吸附水中杂质;
制糖工业中利用活性炭来脱色制白糖;
冰箱中放一些柚子皮来吸附异味……
二、碳的化学性质
古代用墨写的字、绘的画、历经数千年却不褪色,说明了碳的什么性质?
古画 王羲之的书法
稳定性:
在常温下,单质碳性质稳定,不易跟其他物质发生反应。但随温度升高其活泼性会增强,能跟很多物质反应。
可燃性:
在点燃条件下,单质碳能在氧气(或空气)里燃烧,并放出大量的热。
【注意】
一般情况下,如果未注明碳燃烧时氧气(或空气)不充足,通常都是指碳跟氧气生成二氧化碳的反应。
【思考】怎样证明碳燃烧后的产物是二氧化碳?
还原性:
我国古代的金属冶炼就是利用木炭的还原性。
【实验】木炭还原氧化铜
实验现象:
黑色粉末变红色固体,生成的气体能
使澄清的石灰水变浑浊。
化学方程式:
【实验操作】① 把刚烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管; ② 将试管固定在铁架台上。试管口装有通入澄清石灰水的导管; ③ 集中加热; ④ 过几分钟后,先撤出导管后熄灭酒精灯,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。 【实验现象】 。 【化学方程式】
反应开始的标志:澄清的石灰水变浑浊。
在酒精灯上加网罩的目的:使火焰集中并提高温度,可以将加有金属网罩的酒精灯换为酒精喷灯。
配制混合物时木炭粉应稍过量的目的:防止已经还原的铜被氧气重新氧化。
实验完毕后先熄灭酒精灯的后果:水倒流至试管底部,使热的试管炸裂 。
置换反应:
像这种由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
氧化还原反应
氧化剂:提供氧(失去氧),发生还原反应的物质
还原剂:夺取氧(得到氧),发生氧化反应的物质
以下都是氧化还原反应:
【练一练】
1、指出该反应中的氧化剂和还原剂:
2、完成下列反应方程式,指出氧化剂与还原剂 【例题】
典型例题
三、碳的氧化物
(一)一氧化碳
1、物理性质:无色无味的气体,密度比空气略小,难溶于水。
【问】煤气中毒实际就是指一氧化碳中毒。那有人说在煤炉上放一壶水就能防止煤气中毒,你认为对吗?
小常识: 煤气泄漏时能够闻到味道是因为在制造时人为地加入了有特殊气味的气体,这样能够有效防止煤气中毒。
2、化学性质:
(1)毒性:
(2)可燃性:
CO 具有可燃性,燃烧生成 CO2。
化学方程式:
产物的检验: 澄清石灰水
现象: 产生蓝色火焰,放热,将涂有澄清石灰水的烧杯罩在火焰的上方,澄清石灰水变浑浊。
(3)还原性:
从一氧化碳与二氧化碳的分子组成看,它们都是由碳原子和氧原子构成的,但是氧原子个数不同,CO是从氧气分子中夺取氧生成 CO2 ,O2 作为氧化剂,CO 作为还原剂,具有还原性。
【实验探究】CO 还原 CuO
实验装置:由木炭还原氧化铜的实验装置,设计一氧化碳还原氧化
铜的实验装置。
改进后的一氧化碳还原氧化铜的实验装置:
考虑产物的检验,尾气的处理 !
【注意】 该实验应该尽可能多地处理掉剩余的 CO,防止 CO 泄露,污染空气,危害人体健康!
实验步骤: ①先通一会儿已验纯的 CO 气体;
②点燃酒精灯加热;
③停止加热;
④继续通入 CO 到玻璃管冷却;
⑤尾气处理。
【问题】(1)加热前为什么先通一会儿 CO 气体?
赶走装置中的空气,防止一氧化碳与空气混合加热爆炸
(2)实验结束时为什么先要停止加热,再继续通入 CO 到玻璃管冷却?
是为了防止生成的铜重新被氧化为氧化铜
(3)为什么用酒精灯点燃是进行尾气处理?
防止一氧化碳污染空气
【实验现象】 ①黑色固体变成红色 ②澄清石灰水变浑浊
化学方程式:
【想一想】(1)该反应的氧化剂,还原剂分别是什么?
(2)该反应是置换反应吗?
不是,反应物中 CO 和 CuO 都是化合物,没有单质
【实验结论】 CO 还原氧化铜生成了铜
【总结】步骤简易记:一通、二点、三灭、四停、五处理
操作注意事项:CO 早出晚归,酒精灯迟到早退
3、一氧化碳的用途
① 作燃料 (因为具有可燃性)
② 冶炼金属 (因为具有还原性)
氢气也具有还原性,也能还原氧化铜
H2 + CuO Cu + H2O
比较氢气,木炭,一氧化碳还原氧化铜:
(二)二氧化碳
1、二氧化碳的性质
2、比较一氧化碳和二氧化碳的物理性质
CO2
CO
颜色
无色
无色
状态
气体
气体
气味
无味
无味
密度
比空气大
比空气略小
溶解性
能溶于水
难溶于水
【例题】
(此部分10分钟左右,以学生自我总结为主,TR引导为辅,为本次课做一个总结回顾)
【巩固练习】
(此部分内容包含本次课所学内容相关的练习题及综合练习题。建议题量保持在30分钟左右可以完成的范围内)
【预习思考】
(此部分旨在对下节课将要学习的内容进行提前预习。可根据下节课主题进行设置。)
学员姓名: 学科教师:
年 级: 辅导科目: 化学
授课日期
××年××月××日
时 间
A / B / C / D / E / F段
主 题
水
教学内容
1、知道金刚石、石墨、C60 的物理性质、主要用途及同素异形现象、同素异形体概念;
2、理解碳的化学性质 ── 稳定性、可燃性、还原性,理解氧化剂,还原剂;
3、知道碳的化合物的物理性质、化学性质和用途;
4、掌握还原氧化铜的实验
碳的循环图
一、碳单质
C60 —— 足球烯:C60 分子是由 60 个碳原子构成,形似足球,很稳定。C60 有许多优异的性能,可制碳纳米管。具有抗腐蚀性、耐高压等功能。
【问】金刚石、石墨和 C60 物理性质上为什么有那么大的差异?
微观结构:
金刚石、石墨、C60 都是由碳元素组成的不同单质,性质上有如此大的差异是由于碳原子的排列顺序不同,即结构决定性质,性质决定用途。
1、同素异形体
同素异形现象:这种同一种元素组成的不同单质的现象。
金刚石、石墨与C60 ,氧气 (O2) 与臭氧 (O3),白磷与红磷都互为同素异形体。 因此,说“由同种元素组成的物质是单质”是错误的,有可能是单质,也可能是混合物,但绝不会是化合物。
2、无定形碳
3、碳与炭
“碳”是元素的名称,元素符号为 C。常在书写碳元素的单质及含有碳元素的化合物名称时使用。如碳元素、碳-60、一氧化碳、二氧化碳、碳酸、碳酸钙、碳氢化合物等。
“炭”仅在书写由碳元素组成的无定形碳的名称时使用,如木炭、活性炭、焦炭、炭黑等,因为这些物质的组成中除碳单质还含有其它的一些杂质。所以,严格的说,无定形碳不属于碳的同素异形体。
【实验】木炭的吸附性
实验内容:
1、把木炭放入盛满 NO2 气体的锥形瓶,塞好塞子,摇动片刻,观察现象。
2、把木炭放入滴有红墨水的锥形瓶,摇动片刻,观察现象。
实验现象:
1、盛满 NO2 气体的锥形瓶放入木炭,红棕色褪去;
2、滴有红墨水的锥形瓶中红色也消失。
实验结论:
木炭能吸附红色和棕红色物质,说明木炭具有吸附性。
实验分析:
由于木炭具有疏松多孔的结构,能把大量气体、液体或溶液中的某些溶质吸附在其表面,这是一个物理变化过程。吸附性是物理性质。活性炭的吸附能力比木炭还要强。
举出生活中运用吸附原理的具体事例:
防毒面具里的滤毒罐就是利用活性炭来吸附毒气;
净水器中的滤芯装有活性炭来吸附水中杂质;
制糖工业中利用活性炭来脱色制白糖;
冰箱中放一些柚子皮来吸附异味……
二、碳的化学性质
古代用墨写的字、绘的画、历经数千年却不褪色,说明了碳的什么性质?
古画 王羲之的书法
稳定性:
在常温下,单质碳性质稳定,不易跟其他物质发生反应。但随温度升高其活泼性会增强,能跟很多物质反应。
可燃性:
在点燃条件下,单质碳能在氧气(或空气)里燃烧,并放出大量的热。
【注意】
一般情况下,如果未注明碳燃烧时氧气(或空气)不充足,通常都是指碳跟氧气生成二氧化碳的反应。
【思考】怎样证明碳燃烧后的产物是二氧化碳?
还原性:
我国古代的金属冶炼就是利用木炭的还原性。
【实验】木炭还原氧化铜
实验现象:
黑色粉末变红色固体,生成的气体能
使澄清的石灰水变浑浊。
化学方程式:
【实验操作】① 把刚烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管; ② 将试管固定在铁架台上。试管口装有通入澄清石灰水的导管; ③ 集中加热; ④ 过几分钟后,先撤出导管后熄灭酒精灯,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。 【实验现象】 。 【化学方程式】
反应开始的标志:澄清的石灰水变浑浊。
在酒精灯上加网罩的目的:使火焰集中并提高温度,可以将加有金属网罩的酒精灯换为酒精喷灯。
配制混合物时木炭粉应稍过量的目的:防止已经还原的铜被氧气重新氧化。
实验完毕后先熄灭酒精灯的后果:水倒流至试管底部,使热的试管炸裂 。
置换反应:
像这种由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
氧化还原反应
氧化剂:提供氧(失去氧),发生还原反应的物质
还原剂:夺取氧(得到氧),发生氧化反应的物质
以下都是氧化还原反应:
【练一练】
1、指出该反应中的氧化剂和还原剂:
2、完成下列反应方程式,指出氧化剂与还原剂 【例题】
典型例题
三、碳的氧化物
(一)一氧化碳
1、物理性质:无色无味的气体,密度比空气略小,难溶于水。
【问】煤气中毒实际就是指一氧化碳中毒。那有人说在煤炉上放一壶水就能防止煤气中毒,你认为对吗?
小常识: 煤气泄漏时能够闻到味道是因为在制造时人为地加入了有特殊气味的气体,这样能够有效防止煤气中毒。
2、化学性质:
(1)毒性:
(2)可燃性:
CO 具有可燃性,燃烧生成 CO2。
化学方程式:
产物的检验: 澄清石灰水
现象: 产生蓝色火焰,放热,将涂有澄清石灰水的烧杯罩在火焰的上方,澄清石灰水变浑浊。
(3)还原性:
从一氧化碳与二氧化碳的分子组成看,它们都是由碳原子和氧原子构成的,但是氧原子个数不同,CO是从氧气分子中夺取氧生成 CO2 ,O2 作为氧化剂,CO 作为还原剂,具有还原性。
【实验探究】CO 还原 CuO
实验装置:由木炭还原氧化铜的实验装置,设计一氧化碳还原氧化
铜的实验装置。
改进后的一氧化碳还原氧化铜的实验装置:
考虑产物的检验,尾气的处理 !
【注意】 该实验应该尽可能多地处理掉剩余的 CO,防止 CO 泄露,污染空气,危害人体健康!
实验步骤: ①先通一会儿已验纯的 CO 气体;
②点燃酒精灯加热;
③停止加热;
④继续通入 CO 到玻璃管冷却;
⑤尾气处理。
【问题】(1)加热前为什么先通一会儿 CO 气体?
赶走装置中的空气,防止一氧化碳与空气混合加热爆炸
(2)实验结束时为什么先要停止加热,再继续通入 CO 到玻璃管冷却?
是为了防止生成的铜重新被氧化为氧化铜
(3)为什么用酒精灯点燃是进行尾气处理?
防止一氧化碳污染空气
【实验现象】 ①黑色固体变成红色 ②澄清石灰水变浑浊
化学方程式:
【想一想】(1)该反应的氧化剂,还原剂分别是什么?
(2)该反应是置换反应吗?
不是,反应物中 CO 和 CuO 都是化合物,没有单质
【实验结论】 CO 还原氧化铜生成了铜
【总结】步骤简易记:一通、二点、三灭、四停、五处理
操作注意事项:CO 早出晚归,酒精灯迟到早退
3、一氧化碳的用途
① 作燃料 (因为具有可燃性)
② 冶炼金属 (因为具有还原性)
氢气也具有还原性,也能还原氧化铜
H2 + CuO Cu + H2O
比较氢气,木炭,一氧化碳还原氧化铜:
(二)二氧化碳
1、二氧化碳的性质
2、比较一氧化碳和二氧化碳的物理性质
CO2
CO
颜色
无色
无色
状态
气体
气体
气味
无味
无味
密度
比空气大
比空气略小
溶解性
能溶于水
难溶于水
【例题】
(此部分10分钟左右,以学生自我总结为主,TR引导为辅,为本次课做一个总结回顾)
【巩固练习】
(此部分内容包含本次课所学内容相关的练习题及综合练习题。建议题量保持在30分钟左右可以完成的范围内)
【预习思考】
(此部分旨在对下节课将要学习的内容进行提前预习。可根据下节课主题进行设置。)
