2.2 神奇的氧气 课件(共29张PPT)
文档属性
| 名称 | 2.2 神奇的氧气 课件(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 792.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-09-30 00:00:00 | ||
图片预览





文档简介
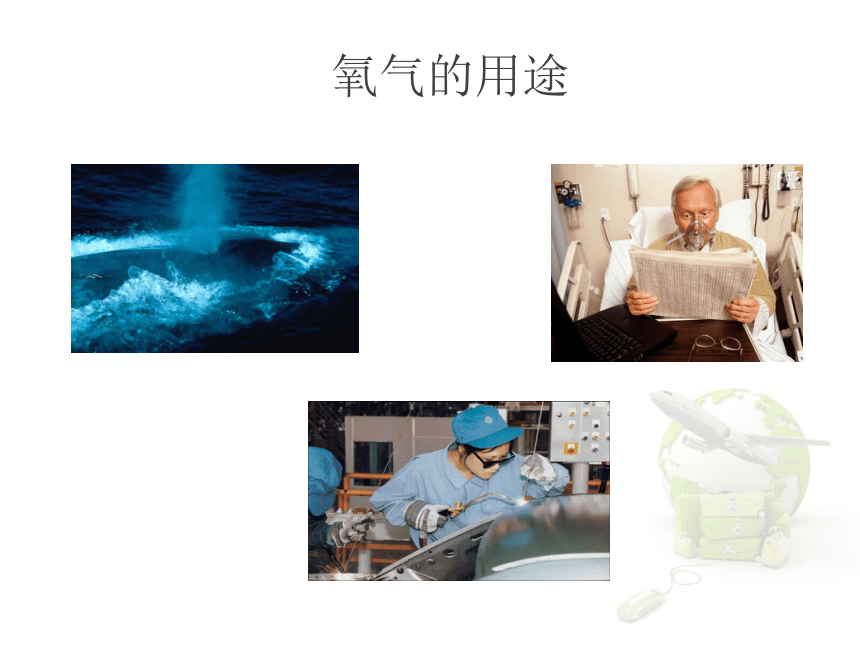
课件29张PPT。2.2 神奇的氧气氧气的用途氧气的“另一面”氧气是铁生锈 、 食物腐败 的罪魁祸首。
纯氧会对细胞发生毒害作用,称为氧中毒。在100kPa的纯氧环境中,人只能存活24小时。
过量吸氧会加速生命衰老。二、氧气的物理性质无色、无味的气体
不易溶于水
密度比空气略大
大气压为101.3kPa时,
沸点:-183oC,淡蓝色液体;
熔点:-283oC,淡蓝色雪花状的固体
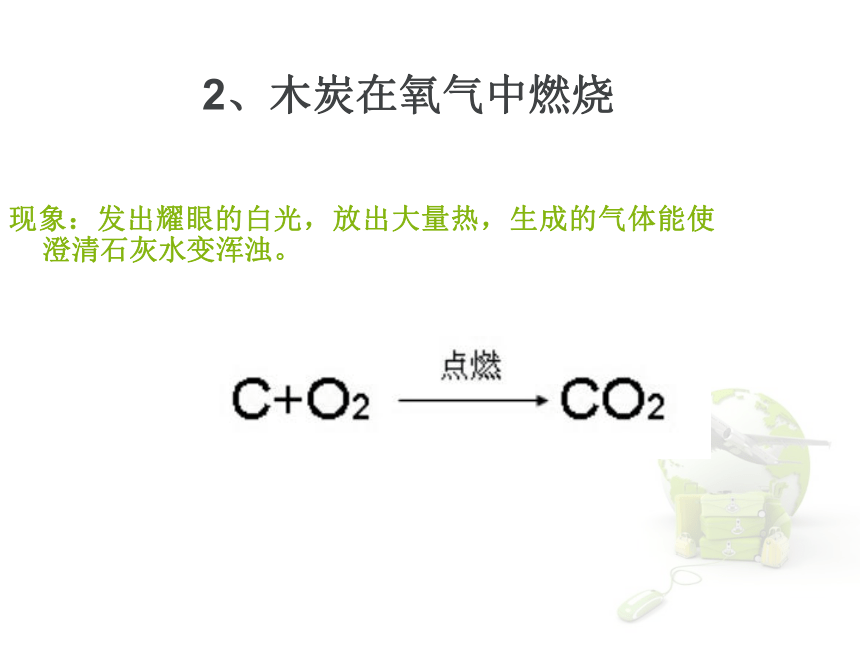
学生实验1. 将带火星的木条伸到盛满氧气的集气瓶中,观察木条是否复燃。现象:木条复燃结论:氧气能使带火星的木条复燃检验氧气的方法氧气化学性质活泼,能支持燃烧。现象:发出耀眼的白光,放出大量热,生成的气体能使澄清石灰水变浑浊。
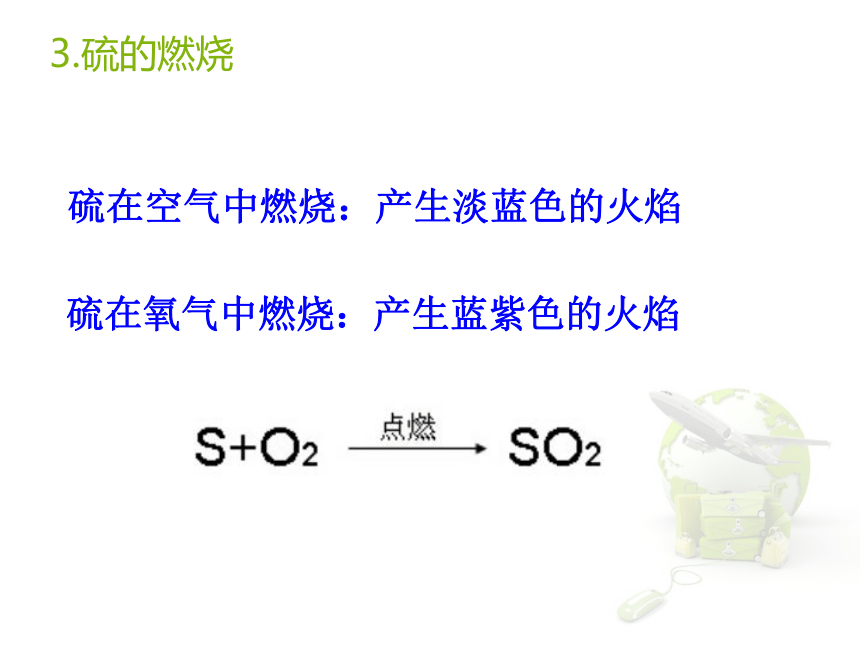
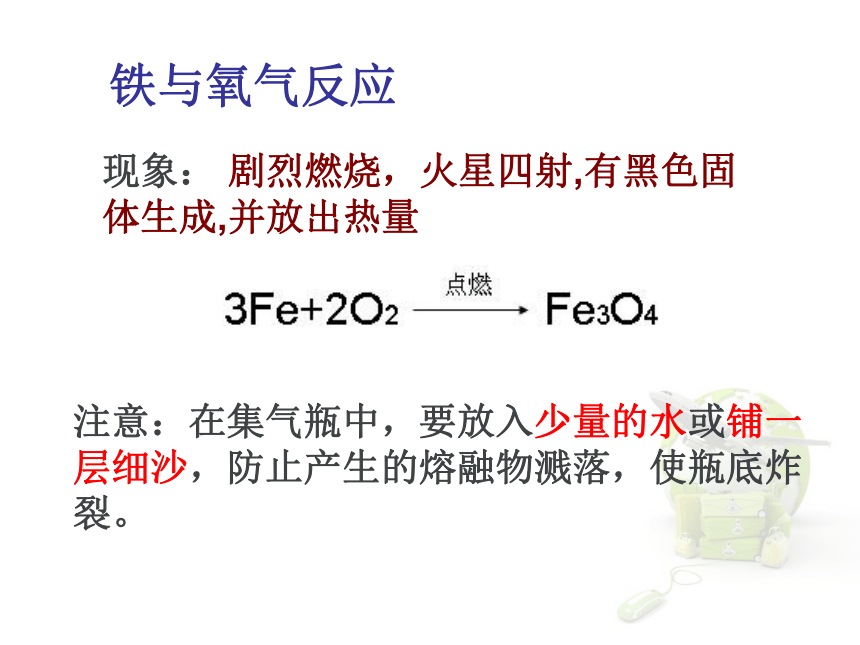
2、木炭在氧气中燃烧3.硫的燃烧硫在空气中燃烧:产生淡蓝色的火焰硫在氧气中燃烧:产生蓝紫色的火焰现象: 剧烈燃烧,火星四射,有黑色固体生成,并放出热量 注意:在集气瓶中,要放入少量的水或铺一层细沙,防止产生的熔融物溅落,使瓶底炸裂。铁与氧气反应氧气与蜡烛反应 现象:剧烈燃烧,瓶壁上有水珠燃烧后注入石灰水,石灰水变浑浊 产物:水 H2O 二氧化碳 CO2氧化反应物质跟氧(氧元素)发生的反应叫做氧化反应。如:氧化物由两种元素组成、其中一种元素是氧元素的化合物叫做氧化物。如:SO2、Fe3O4、CO2等下列物质哪些是氧化物?H2SO4、CaCO3、CO2、H2O
MgO、CuO氧化物:CO2、H2O、MgO、CuO金属氧化物:除氧元素外另一种元素是金属元素,如CuO、MgO非金属氧化物:除氧元素外另一种元素是非金属元素,如CO2、H2O 两种或两种以上的物质生成一种新物质的反应,叫做化合反应。
特征:只有一个产物化合反应如: 氧气的工业制法空气中主要成分的沸点:
氮气:-196℃,氧气:-183℃ 方法一:分离液态空气 空气加压、降温 液态空气氮气 先气化液氧 储存在钢瓶里氯酸钾制氧气原理:氯酸钾→氯化钾+氧气药品:氯酸钾、二氧化锰 在化学反应中,能使其他物质的反应速度变快,而本身的质量和化学性质保持不变。特征:一变二不变催化剂发生装置:实验装置4.试管口略向下倾斜2.导管只伸入橡皮塞少许3.铁夹应夹在离试管口1/3处1.药品要平铺在试管底部从下往上,从左往右搭建装置气体的收集方法向上排空气法向下排空气法
排水集气法与气体的密度与溶解性有关 收集氧气的方法①排水法氧气不易溶于水
且不与水反应 当有大量气体均匀、连续产生时,才开始收集气体。
集气瓶口有气泡时,说明氧气已收集满向上排空气法氧气密度大于空气
不与空气反应
※导管要插到集气瓶底部,使集气瓶中的空气顺利排出 验满:将带火星的木条放
在集气瓶口,木条
复燃,已集满
操作要点查检查装置气密性装填装药品(KClO3、MnO2)定固定装置点点燃酒精灯收收集氧气离导管离开水槽熄熄灭酒精灯检查装置气密性用手握住试管,如果有气泡产生,则气密性良好? 导管只要伸出橡皮塞少许药品要平铺找出装置的错误指出下列装置的错误之处(明显的3处)
以下气体分别可以用什么方法收集向上排空气法排水法
向下排空气法向下排空气法过氧化氢制氧气反应原理:实验药品:
过氧化氢溶液(双氧水)、二氧化锰过氧化氢→水+氧气实验装置发生装置:试管长颈漏斗分液漏斗随时添加液体随时添加液体,控制液体流速注意液封分解反应我们把一种物质生成两种或两种以上新物质的反应,叫做分解反应。如:过氧化氢→水+氧气
纯氧会对细胞发生毒害作用,称为氧中毒。在100kPa的纯氧环境中,人只能存活24小时。
过量吸氧会加速生命衰老。二、氧气的物理性质无色、无味的气体
不易溶于水
密度比空气略大
大气压为101.3kPa时,
沸点:-183oC,淡蓝色液体;
熔点:-283oC,淡蓝色雪花状的固体
学生实验1. 将带火星的木条伸到盛满氧气的集气瓶中,观察木条是否复燃。现象:木条复燃结论:氧气能使带火星的木条复燃检验氧气的方法氧气化学性质活泼,能支持燃烧。现象:发出耀眼的白光,放出大量热,生成的气体能使澄清石灰水变浑浊。
2、木炭在氧气中燃烧3.硫的燃烧硫在空气中燃烧:产生淡蓝色的火焰硫在氧气中燃烧:产生蓝紫色的火焰现象: 剧烈燃烧,火星四射,有黑色固体生成,并放出热量 注意:在集气瓶中,要放入少量的水或铺一层细沙,防止产生的熔融物溅落,使瓶底炸裂。铁与氧气反应氧气与蜡烛反应 现象:剧烈燃烧,瓶壁上有水珠燃烧后注入石灰水,石灰水变浑浊 产物:水 H2O 二氧化碳 CO2氧化反应物质跟氧(氧元素)发生的反应叫做氧化反应。如:氧化物由两种元素组成、其中一种元素是氧元素的化合物叫做氧化物。如:SO2、Fe3O4、CO2等下列物质哪些是氧化物?H2SO4、CaCO3、CO2、H2O
MgO、CuO氧化物:CO2、H2O、MgO、CuO金属氧化物:除氧元素外另一种元素是金属元素,如CuO、MgO非金属氧化物:除氧元素外另一种元素是非金属元素,如CO2、H2O 两种或两种以上的物质生成一种新物质的反应,叫做化合反应。
特征:只有一个产物化合反应如: 氧气的工业制法空气中主要成分的沸点:
氮气:-196℃,氧气:-183℃ 方法一:分离液态空气 空气加压、降温 液态空气氮气 先气化液氧 储存在钢瓶里氯酸钾制氧气原理:氯酸钾→氯化钾+氧气药品:氯酸钾、二氧化锰 在化学反应中,能使其他物质的反应速度变快,而本身的质量和化学性质保持不变。特征:一变二不变催化剂发生装置:实验装置4.试管口略向下倾斜2.导管只伸入橡皮塞少许3.铁夹应夹在离试管口1/3处1.药品要平铺在试管底部从下往上,从左往右搭建装置气体的收集方法向上排空气法向下排空气法
排水集气法与气体的密度与溶解性有关 收集氧气的方法①排水法氧气不易溶于水
且不与水反应 当有大量气体均匀、连续产生时,才开始收集气体。
集气瓶口有气泡时,说明氧气已收集满向上排空气法氧气密度大于空气
不与空气反应
※导管要插到集气瓶底部,使集气瓶中的空气顺利排出 验满:将带火星的木条放
在集气瓶口,木条
复燃,已集满
操作要点查检查装置气密性装填装药品(KClO3、MnO2)定固定装置点点燃酒精灯收收集氧气离导管离开水槽熄熄灭酒精灯检查装置气密性用手握住试管,如果有气泡产生,则气密性良好? 导管只要伸出橡皮塞少许药品要平铺找出装置的错误指出下列装置的错误之处(明显的3处)
以下气体分别可以用什么方法收集向上排空气法排水法
向下排空气法向下排空气法过氧化氢制氧气反应原理:实验药品:
过氧化氢溶液(双氧水)、二氧化锰过氧化氢→水+氧气实验装置发生装置:试管长颈漏斗分液漏斗随时添加液体随时添加液体,控制液体流速注意液封分解反应我们把一种物质生成两种或两种以上新物质的反应,叫做分解反应。如:过氧化氢→水+氧气
