鲁教版九年级上册化学 3.3 到实验室去:配制一定溶质质量分数的溶液 课件(18张PPT)
文档属性
| 名称 | 鲁教版九年级上册化学 3.3 到实验室去:配制一定溶质质量分数的溶液 课件(18张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 647.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-02 09:00:59 | ||
图片预览







文档简介
课件18张PPT。 配制一定溶质质量分数的溶液 态度决定一切细节决定成败到实验室去课堂目标1.通过实验活动,初步学会配制一定
溶质质量分数的溶液;
2.初步掌握称量、溶解等基本操作,会规范使用托盘天平、量筒、胶头滴管等仪器;3.培养良好的实验习惯和规范的
实验操作能力。重点与难点
重点 :
难点:
配制溶液的操作步骤及
基本实验的规范操作
对该实验的误差分析
【复习回顾】配制一定溶质质量分数溶液的一般步骤有哪些?
如何表示溶液中溶质质量分数?
【创设情景引入新课】问题:某医院急需500g0.9﹪的生理盐水急救病人,你能帮助医院解决吗? (1)称量前,检查游码是否在零刻度,天平是否平衡,如不平衡,应调节平衡螺母。右偏重向左调,左偏重向右调,以保证称量准确。(2)称量时,左物右码。放砝码时,先大后小。被称物要放在纸上或玻璃器皿中,以免腐蚀托盘或污染药品。天平接近平衡时,为使药品不过量,添加药品的技巧是一手持药匙,另一只手轻轻拍打持药匙的手腕,使少量药品落到左盘纸上。
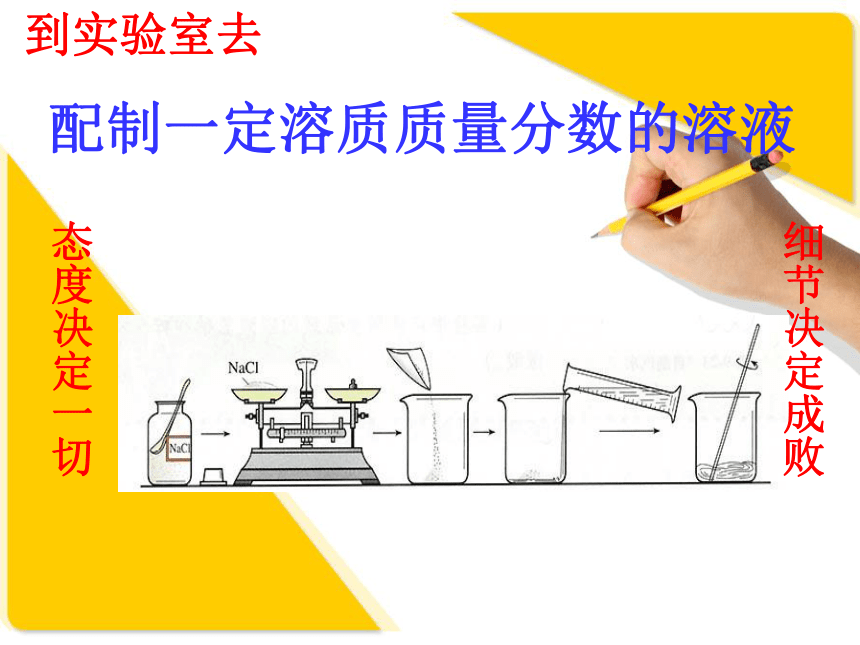
(3)用镊子夹取砝码,用后放回砝码盒,保证砝码不被腐蚀。(1)不能加热,不能配制溶液,也不能作反应容器。(2)与胶头滴管配套使用。(3)量液时,量筒必须水平放置。倒入的液体到接近刻度线时,改用胶头滴管,逐滴滴入量筒到刻度线。(4)读数时,视线要和凹液面最低处保持水平,再读出液体体积。(5)量筒选用:选用能一次性量取的最小规格的量筒。主要仪器:托盘天平、药匙、量筒、胶头滴管、玻璃棒、烧杯 实验步骤:①计算;②称量(量取);
③溶解;④装瓶,贴标签入柜。配制操作流程图配制50 g 6%的氯化钠溶液。动手实验 注意合理安排时间。
保持地面和桌面的整洁。
注意实验操作规范性。
温馨提示反思与交流你是否顺利完成了本次实验?
有哪些经验与教训与同学们分享?实验误差分析所配溶液溶质质量分数偏小原因
1、计算角度:水质量算多了/溶质质量算少了
2、天平角度:左物右码放反(用到游码时)/称量前指针偏左/只在左盘放纸
3、量筒角度:仰视读数导致水量多了
4、溶质药品角度:溶质不纯(含杂质)/受潮5、转移角度:溶质未全部倒入烧杯/烧杯不干燥或烧杯内有水(用水润湿)/固体损失(撒到外面)所配溶液溶质质量分数偏大原因1、(溶质)药品称取多了/称量前天平指针偏右/所用游码生锈或有油污
2、(溶剂)俯视读数导致水量少了/倾倒溶剂水时,洒出烧杯外
实验误差分析当堂检测:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
中考链接
1欲配制 100 g 质量分数为 10%
的氯化钠溶液,需要的仪器组合是()。①托盘天平;②烧杯;③玻璃棒;④100 mL 量筒。A.①②
C.①②③④B.①②③
D.①②④2配制 2000 g 生理盐水(溶质质
量分数为0.9%),需要称取 NaCl 的质量为()。A.9 gB.18 gC.90 gD.180 gCB达标检测 3、在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
点拨:配制溶液时,对量筒进行读数时视线应与凹液面最低处保持水平。
C 4.溶解:用量筒来量取60mL所需的水(水的密度
为 1 g/cm3),量筒的规格是________(从下列
中选用:10 mL、25 mL 、50 mL、100 mL) ;
溶 解 碳 酸 钠 要 用 到 玻 璃 棒 , 其 作 用 是________________。 反思:若称取的碳酸钠中含有水分,则所
配制的溶液的质量分数会________
(填“偏大”、“偏小”或“无影响”)。100 mL加快溶解偏小5.下列操作会导致所配溶液的溶质质量分数如
何变化?(用偏大”或“偏小”填空)
(1)砝码生锈__________;
(2)砝码缺角__________;
(3)药品中含有杂质__________;
(4)量取水时仰视读数__________;
(5)量取水时俯视读数__________;
(6)药品与砝码调反了(即右物左码)__________。偏大偏小偏小偏小偏大偏小
溶质质量分数的溶液;
2.初步掌握称量、溶解等基本操作,会规范使用托盘天平、量筒、胶头滴管等仪器;3.培养良好的实验习惯和规范的
实验操作能力。重点与难点
重点 :
难点:
配制溶液的操作步骤及
基本实验的规范操作
对该实验的误差分析
【复习回顾】配制一定溶质质量分数溶液的一般步骤有哪些?
如何表示溶液中溶质质量分数?
【创设情景引入新课】问题:某医院急需500g0.9﹪的生理盐水急救病人,你能帮助医院解决吗? (1)称量前,检查游码是否在零刻度,天平是否平衡,如不平衡,应调节平衡螺母。右偏重向左调,左偏重向右调,以保证称量准确。(2)称量时,左物右码。放砝码时,先大后小。被称物要放在纸上或玻璃器皿中,以免腐蚀托盘或污染药品。天平接近平衡时,为使药品不过量,添加药品的技巧是一手持药匙,另一只手轻轻拍打持药匙的手腕,使少量药品落到左盘纸上。
(3)用镊子夹取砝码,用后放回砝码盒,保证砝码不被腐蚀。(1)不能加热,不能配制溶液,也不能作反应容器。(2)与胶头滴管配套使用。(3)量液时,量筒必须水平放置。倒入的液体到接近刻度线时,改用胶头滴管,逐滴滴入量筒到刻度线。(4)读数时,视线要和凹液面最低处保持水平,再读出液体体积。(5)量筒选用:选用能一次性量取的最小规格的量筒。主要仪器:托盘天平、药匙、量筒、胶头滴管、玻璃棒、烧杯 实验步骤:①计算;②称量(量取);
③溶解;④装瓶,贴标签入柜。配制操作流程图配制50 g 6%的氯化钠溶液。动手实验 注意合理安排时间。
保持地面和桌面的整洁。
注意实验操作规范性。
温馨提示反思与交流你是否顺利完成了本次实验?
有哪些经验与教训与同学们分享?实验误差分析所配溶液溶质质量分数偏小原因
1、计算角度:水质量算多了/溶质质量算少了
2、天平角度:左物右码放反(用到游码时)/称量前指针偏左/只在左盘放纸
3、量筒角度:仰视读数导致水量多了
4、溶质药品角度:溶质不纯(含杂质)/受潮5、转移角度:溶质未全部倒入烧杯/烧杯不干燥或烧杯内有水(用水润湿)/固体损失(撒到外面)所配溶液溶质质量分数偏大原因1、(溶质)药品称取多了/称量前天平指针偏右/所用游码生锈或有油污
2、(溶剂)俯视读数导致水量少了/倾倒溶剂水时,洒出烧杯外
实验误差分析当堂检测:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
中考链接
1欲配制 100 g 质量分数为 10%
的氯化钠溶液,需要的仪器组合是()。①托盘天平;②烧杯;③玻璃棒;④100 mL 量筒。A.①②
C.①②③④B.①②③
D.①②④2配制 2000 g 生理盐水(溶质质
量分数为0.9%),需要称取 NaCl 的质量为()。A.9 gB.18 gC.90 gD.180 gCB达标检测 3、在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
点拨:配制溶液时,对量筒进行读数时视线应与凹液面最低处保持水平。
C 4.溶解:用量筒来量取60mL所需的水(水的密度
为 1 g/cm3),量筒的规格是________(从下列
中选用:10 mL、25 mL 、50 mL、100 mL) ;
溶 解 碳 酸 钠 要 用 到 玻 璃 棒 , 其 作 用 是________________。 反思:若称取的碳酸钠中含有水分,则所
配制的溶液的质量分数会________
(填“偏大”、“偏小”或“无影响”)。100 mL加快溶解偏小5.下列操作会导致所配溶液的溶质质量分数如
何变化?(用偏大”或“偏小”填空)
(1)砝码生锈__________;
(2)砝码缺角__________;
(3)药品中含有杂质__________;
(4)量取水时仰视读数__________;
(5)量取水时俯视读数__________;
(6)药品与砝码调反了(即右物左码)__________。偏大偏小偏小偏小偏大偏小
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
