高中化学人教版高一必修一2.1物质的分类(共计36张PPT)
文档属性
| 名称 | 高中化学人教版高一必修一2.1物质的分类(共计36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-03 19:36:57 | ||
图片预览











文档简介
课件36张PPT。第二章 化学物质及其变化
(第1课时) 本节课以生活中的商品分类导入新课,认识分类的意义,了解常用的两种分类方法。进而再用交叉分类法和树状分类法进行物质的分类,重点梳理酸、碱、盐和氧化物的分类。加固复习一些物质所能发生的反应,在此基础上归纳单质、氧化物、酸、碱、盐的性质规律,并进行反应的分类,强调分类标准不同,反应类型也不同。
课件结合图示了解分类的意义,并引导学生对物质和反应也进行分类,从而让学生知道,要通过代表物的学习研究了解一类物质的性质,提高学习效率。1.了解分类法的意义及分类方法。
2.了解分类法在化学中的应用,并实践对所学
的化学物质和化学反应进行分类。图书馆里有那么多的书籍,为什么你能很快就找到你需要的书?超市里有成千上万种商品,在不咨询其他人的情况下,你怎样能快速找到王老吉和洗发水?这是因为人们在将这些物品陈列到书架或货架之前,已经对它们进行了分类处理。便于快速查找,节约时间。分类:是把某些特征相似的物质归类到一起的方法.生活中分类的意义:能够提高人们工作,学习的效率,使人们更快,更便捷地达到目的等。
化学中分类的意义:分类是学习和研究化学物质及其变化的一种常用的科学方法。物质种类繁多,运用分类可以将许多具有共性的物质归为一类,触类旁通,避免重复研究,而且可以更深刻领会物质的内在的区别与联系。 联系实际.谈谈日常生活生活中应用分类法的例子,并讨论对它们进行分类的意义?,那么在化学中的意义?1.对于化学物质,如果按照所含物质种类的多少,可以怎样分类?
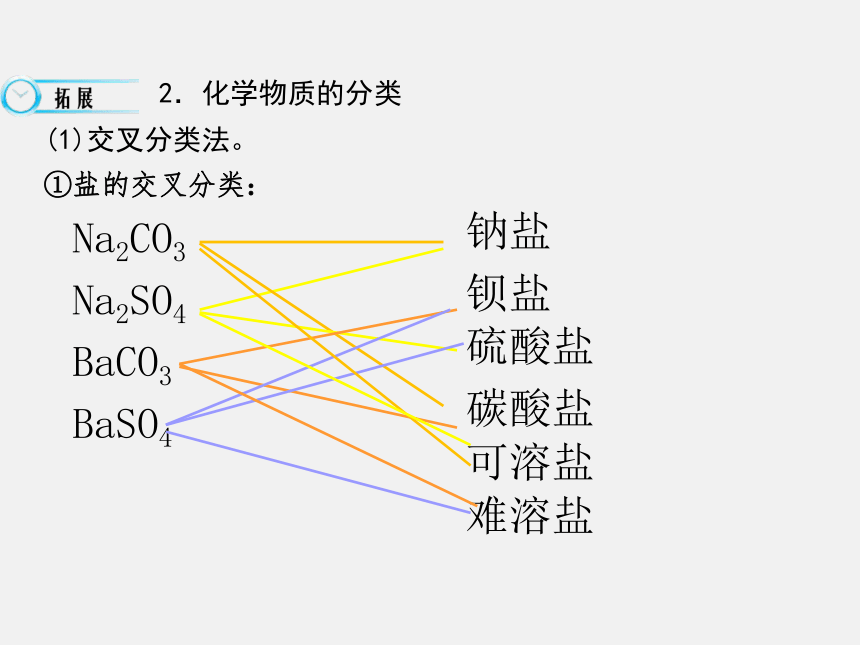
2.对于化合物我们按照不同的分类标准进行分类可以产生哪些分类结果?不同同一事物Na2CO3
Na2SO4
BaCO3
BaSO4钠盐
钡盐
硫酸盐
碳酸盐可溶盐难溶盐 2.化学物质的分类
(1)交叉分类法。①盐的交叉分类: ②某些碱的交叉分类
弱碱 NaOH
KOH 可溶性碱
强碱 Mg(OH)2
一元碱 NH3·H2O 不溶性碱
二元碱 Ba(OH)2③某些氧化物的交叉分类
CO2 非金属氧化物
酸性氧化物 SiO2 气体氧化物
SO2 固体氧化物
Al2O3
碱性氧化物 CuO 金属氧化物(2)树状分类法:
对同类事物按照属性进一步进行细化分类的方法,分级,递进,每一级一个分类标准。
物质纯净物混合物单质化合物金属非金属氧化物Fe、CuC、O2非金属氧化物
金属氧化物 CO2、H2O MgO、Fe2O3HCl、H2SO4、
NaOH、Ca(OH)2
NaCl、Na2CO3:空气、石灰石、溶液、合金酸 碱 盐交叉分类法和树状分类法有什么区别?
(1)交叉分类法中类别之间存在交叉关系;如Na2SO4、K2SO4分别属于钠盐和钾盐,但它们都属于硫酸盐。
(2)树状分类法中的物质类别之间存在从属关系;如盐属于化合物,而化合物又属于纯净物。交叉分类法:是对同一事物按照多种标准进行分类的方法,能对事物认识较全面,可弥补单一分类方法的不足。
树状分类法:是对同类事物按照属性进一步细化分类的方法,能把事物认识得更加深刻,促进科学发展。酸从酸性强弱分无氧酸中强酸弱酸H2SO4、HNO3、H3PO4、H2CO3HCl、H2SH2SO4、HNO3、HClH3PO4H2CO3据酸分子电离出的氢离子数多元酸二元酸HCl、HNO3、H2SO4、H2SO3、H2CO3H3PO4按有无挥发性挥发性酸难挥发性酸HCl、HNO3H2SO4、H3PO4碱从碱性强弱分难溶碱弱碱NaOH、KOH、Ca(OH) 2、Ba(OH)2、NH3·H2ONaOH、KOH、Ca(OH) 2、Ba(OH)2Cu(OH)2、Mg(OH)2、Fe(OH) 3NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3据碱分子电离出的氢氧根离子数多元碱二元碱NH3·H2O 、 NaOH、KOH、Cu(OH)2、Mg(OH)2、Fe(OH) 2
Ca(OH) 2、Ba(OH)2、Fe(OH) 3、Al(OH) 3
盐按阴阳离子分无氧酸盐按酸根是否含氧分难溶盐K+ Na+ NH4+ NO3- Cl- SO42-CaCO3、BaSO4、AgClKNO3、KMnO4、FeSO4NaCl、ZnS、CaCl2按组成分
**碱式盐酸式盐Cu2(OH)2CO3NaHCO3、NH4HCO3、NaHSO4KNO3、KMnO4、FeSO4 、 NaCl、ZnS、CaCl2氧化物酸性氧化物
碱性氧化物
不成盐氧化物CuO、Fe2O3、Na2OCO、P2O5、H2OCO2、P2O5、SO3CaO、CuO、K2OCO、NO非金属氧化物金属氧化物两性氧化物Al2O3、(1)金属氧化物不一定是碱性氧化物,如 Al2O3、Mn2O7 等。
(2)非金属氧化物不一定是酸性氧化物,如 CO、NO 等。
(3)酸性氧化物不一定是非金属氧化物,如 Mn2O7 等。
(4)碱性氧化物一定是金属氧化物。学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时的归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。 下列实验室常见的物质,它们能和哪些物质发生反应,写出反应的方程式。并总结反应的规律。Fe、O2 、 C、CO2、CaO、NaOH溶液、H2SO4、CuSO4溶液、Na2CO3溶液Fe+CuSO4==FeSO4+Cu与金属氧化物反应CO2+H2O==H2CO3CO2+2NaOH==Na2CO3+H2OCaO+H2O==Ca(OH)2CaO+H2SO4==CaSO4+H2OCO2+ CaO == CaCO3H2SO4 + CaO ==CaSO4+H2OH2SO4 + 2NaOH ==Na2SO4+2H2O酸+指示剂2NaOH+ H2SO4 ==Na2SO4+2H2O2NaOH + CO2 ==Na2CO3+H2O 盐的性质2、与某些酸反应生成新的盐和酸3、与某些碱反应生成新的盐和碱4、与某些盐反应生成两种新的盐1、与金属反应生成金属和盐5、正盐与酸式盐的转化正盐加酸加碱或固体受热分解酸式盐NaHCO3Na2CO3三个标准:
①是不是化合反应
②根据反应物的特点
③是不是氧化反应你会对下列化学反应进行怎样的分类?
(1)硫在氧气里燃烧
(2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧
(4)铝箔在氧气里燃烧硫在氧气里燃烧红磷在氧气里燃烧铁丝在氧气里燃烧铝箔在氧气里燃烧蜡烛在氧气里燃烧非金属与氧气反应化合反应金属与氧气反应氧化反应写出下列有关反应方程式,然后提出它的反应类型。①Zn与稀硫酸反应②加热高锰酸钾制氧气③盐酸与碳酸钠反应④铁在氧气中燃烧Zn+H2SO4==ZnSO4+H2↑2HCl+Na2CO3==2NaCl+CO2 ↑ +H2O置换反应分解反应复分解反应化合反应在初中学过四种基本化学反应类型,它们是按照什么标准进行分类的?这四种基本反应类型能概括所有的化学反应吗?化学反应还可以按照哪些不同的标准进行分类呢?我们应当用什么样的态度对待对已学知识?化学反应按反应前后物质种数和类别分类化合反应:A+B=AB分解反应:AB=A+B置换反应:A+BC=AB+C复分解反应:AB+CD=AD+BC按得氧或失氧分类氧化反应还原反应按反应中是否有离子参加一、简单分类法及其应用
1.分类 2.分类的意义
3.简单分类法
(1)交叉分类法
标准不唯一,根据分类的标准不同而不同
(2)树状分类法
对某一标准分类后的再分类化学物质及其变化化学物质化学反应纯净物混合物单
质化
合
物化合反应分解反应置换反应复分解反应离子反应氧化还原反应溶
液胶
体浊
液1.下列每组中都有一种物质与其他物质在分类上不同,试找出这种物质并说明理由。
①、NaCl KCl KClO3 BaCl2
②、CaO MgO K2O Na2CO3
③、Cl2 H2 I2 Fe
④、H3PO4 HNO3 HCl H2SO4
⑤、空气 N2 H2O CuSO4·H2O
⑥、Cu Au Pt NaKClO3Na2CO3 Fe HCl空气 Na2、完成下列转化关系,并指出各物质的类别和反应类型?Ca CaO Ca(OH)2 CaCO3 CCO2 H2CO3 CaCO3 金属 碱性氧化物 碱 盐 非金属 酸性氧化物 酸 盐 碱性氧化物都是金属氧化物,但金属氧化物不一定都是碱性氧化物 。酸性氧化物不一定都是非金属氧化物,非金属氧化物也不一定都是酸性氧化物。①②③④⑤⑥3. 请从下列每组中挑出1个与另外3个属于不同“分类”的物质,并说明挑选的依据:
(1)CO、CO2、SO2、P2O5
(2)S2-、I-、Fe、SO42-
(3) HCl、CO2、NH3、CaO
(4)蒸馏、分液、蒸发、中和P2O5
状态不同Fe是否带有电荷CaO
状态不同中和是否是物理变化还是化学变化 4.下列物质:①H2O ②NaCl ③H2SO4 ④Ca(OH)2 ⑤Fe2O3 ⑥FeSO4·7H2O ⑦HNO3 ⑧AgNO3 ⑨NaHCO3中,其中属于氧化物的是 ;属于碱的是 ;属于酸的是 ;属于盐的是 。(填写各物质的序号)①②④③⑦②⑥⑧⑨
(第1课时) 本节课以生活中的商品分类导入新课,认识分类的意义,了解常用的两种分类方法。进而再用交叉分类法和树状分类法进行物质的分类,重点梳理酸、碱、盐和氧化物的分类。加固复习一些物质所能发生的反应,在此基础上归纳单质、氧化物、酸、碱、盐的性质规律,并进行反应的分类,强调分类标准不同,反应类型也不同。
课件结合图示了解分类的意义,并引导学生对物质和反应也进行分类,从而让学生知道,要通过代表物的学习研究了解一类物质的性质,提高学习效率。1.了解分类法的意义及分类方法。
2.了解分类法在化学中的应用,并实践对所学
的化学物质和化学反应进行分类。图书馆里有那么多的书籍,为什么你能很快就找到你需要的书?超市里有成千上万种商品,在不咨询其他人的情况下,你怎样能快速找到王老吉和洗发水?这是因为人们在将这些物品陈列到书架或货架之前,已经对它们进行了分类处理。便于快速查找,节约时间。分类:是把某些特征相似的物质归类到一起的方法.生活中分类的意义:能够提高人们工作,学习的效率,使人们更快,更便捷地达到目的等。
化学中分类的意义:分类是学习和研究化学物质及其变化的一种常用的科学方法。物质种类繁多,运用分类可以将许多具有共性的物质归为一类,触类旁通,避免重复研究,而且可以更深刻领会物质的内在的区别与联系。 联系实际.谈谈日常生活生活中应用分类法的例子,并讨论对它们进行分类的意义?,那么在化学中的意义?1.对于化学物质,如果按照所含物质种类的多少,可以怎样分类?
2.对于化合物我们按照不同的分类标准进行分类可以产生哪些分类结果?不同同一事物Na2CO3
Na2SO4
BaCO3
BaSO4钠盐
钡盐
硫酸盐
碳酸盐可溶盐难溶盐 2.化学物质的分类
(1)交叉分类法。①盐的交叉分类: ②某些碱的交叉分类
弱碱 NaOH
KOH 可溶性碱
强碱 Mg(OH)2
一元碱 NH3·H2O 不溶性碱
二元碱 Ba(OH)2③某些氧化物的交叉分类
CO2 非金属氧化物
酸性氧化物 SiO2 气体氧化物
SO2 固体氧化物
Al2O3
碱性氧化物 CuO 金属氧化物(2)树状分类法:
对同类事物按照属性进一步进行细化分类的方法,分级,递进,每一级一个分类标准。
物质纯净物混合物单质化合物金属非金属氧化物Fe、CuC、O2非金属氧化物
金属氧化物 CO2、H2O MgO、Fe2O3HCl、H2SO4、
NaOH、Ca(OH)2
NaCl、Na2CO3:空气、石灰石、溶液、合金酸 碱 盐交叉分类法和树状分类法有什么区别?
(1)交叉分类法中类别之间存在交叉关系;如Na2SO4、K2SO4分别属于钠盐和钾盐,但它们都属于硫酸盐。
(2)树状分类法中的物质类别之间存在从属关系;如盐属于化合物,而化合物又属于纯净物。交叉分类法:是对同一事物按照多种标准进行分类的方法,能对事物认识较全面,可弥补单一分类方法的不足。
树状分类法:是对同类事物按照属性进一步细化分类的方法,能把事物认识得更加深刻,促进科学发展。酸从酸性强弱分无氧酸中强酸弱酸H2SO4、HNO3、H3PO4、H2CO3HCl、H2SH2SO4、HNO3、HClH3PO4H2CO3据酸分子电离出的氢离子数多元酸二元酸HCl、HNO3、H2SO4、H2SO3、H2CO3H3PO4按有无挥发性挥发性酸难挥发性酸HCl、HNO3H2SO4、H3PO4碱从碱性强弱分难溶碱弱碱NaOH、KOH、Ca(OH) 2、Ba(OH)2、NH3·H2ONaOH、KOH、Ca(OH) 2、Ba(OH)2Cu(OH)2、Mg(OH)2、Fe(OH) 3NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3据碱分子电离出的氢氧根离子数多元碱二元碱NH3·H2O 、 NaOH、KOH、Cu(OH)2、Mg(OH)2、Fe(OH) 2
Ca(OH) 2、Ba(OH)2、Fe(OH) 3、Al(OH) 3
盐按阴阳离子分无氧酸盐按酸根是否含氧分难溶盐K+ Na+ NH4+ NO3- Cl- SO42-CaCO3、BaSO4、AgClKNO3、KMnO4、FeSO4NaCl、ZnS、CaCl2按组成分
**碱式盐酸式盐Cu2(OH)2CO3NaHCO3、NH4HCO3、NaHSO4KNO3、KMnO4、FeSO4 、 NaCl、ZnS、CaCl2氧化物酸性氧化物
碱性氧化物
不成盐氧化物CuO、Fe2O3、Na2OCO、P2O5、H2OCO2、P2O5、SO3CaO、CuO、K2OCO、NO非金属氧化物金属氧化物两性氧化物Al2O3、(1)金属氧化物不一定是碱性氧化物,如 Al2O3、Mn2O7 等。
(2)非金属氧化物不一定是酸性氧化物,如 CO、NO 等。
(3)酸性氧化物不一定是非金属氧化物,如 Mn2O7 等。
(4)碱性氧化物一定是金属氧化物。学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时的归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。 下列实验室常见的物质,它们能和哪些物质发生反应,写出反应的方程式。并总结反应的规律。Fe、O2 、 C、CO2、CaO、NaOH溶液、H2SO4、CuSO4溶液、Na2CO3溶液Fe+CuSO4==FeSO4+Cu与金属氧化物反应CO2+H2O==H2CO3CO2+2NaOH==Na2CO3+H2OCaO+H2O==Ca(OH)2CaO+H2SO4==CaSO4+H2OCO2+ CaO == CaCO3H2SO4 + CaO ==CaSO4+H2OH2SO4 + 2NaOH ==Na2SO4+2H2O酸+指示剂2NaOH+ H2SO4 ==Na2SO4+2H2O2NaOH + CO2 ==Na2CO3+H2O 盐的性质2、与某些酸反应生成新的盐和酸3、与某些碱反应生成新的盐和碱4、与某些盐反应生成两种新的盐1、与金属反应生成金属和盐5、正盐与酸式盐的转化正盐加酸加碱或固体受热分解酸式盐NaHCO3Na2CO3三个标准:
①是不是化合反应
②根据反应物的特点
③是不是氧化反应你会对下列化学反应进行怎样的分类?
(1)硫在氧气里燃烧
(2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧
(4)铝箔在氧气里燃烧硫在氧气里燃烧红磷在氧气里燃烧铁丝在氧气里燃烧铝箔在氧气里燃烧蜡烛在氧气里燃烧非金属与氧气反应化合反应金属与氧气反应氧化反应写出下列有关反应方程式,然后提出它的反应类型。①Zn与稀硫酸反应②加热高锰酸钾制氧气③盐酸与碳酸钠反应④铁在氧气中燃烧Zn+H2SO4==ZnSO4+H2↑2HCl+Na2CO3==2NaCl+CO2 ↑ +H2O置换反应分解反应复分解反应化合反应在初中学过四种基本化学反应类型,它们是按照什么标准进行分类的?这四种基本反应类型能概括所有的化学反应吗?化学反应还可以按照哪些不同的标准进行分类呢?我们应当用什么样的态度对待对已学知识?化学反应按反应前后物质种数和类别分类化合反应:A+B=AB分解反应:AB=A+B置换反应:A+BC=AB+C复分解反应:AB+CD=AD+BC按得氧或失氧分类氧化反应还原反应按反应中是否有离子参加一、简单分类法及其应用
1.分类 2.分类的意义
3.简单分类法
(1)交叉分类法
标准不唯一,根据分类的标准不同而不同
(2)树状分类法
对某一标准分类后的再分类化学物质及其变化化学物质化学反应纯净物混合物单
质化
合
物化合反应分解反应置换反应复分解反应离子反应氧化还原反应溶
液胶
体浊
液1.下列每组中都有一种物质与其他物质在分类上不同,试找出这种物质并说明理由。
①、NaCl KCl KClO3 BaCl2
②、CaO MgO K2O Na2CO3
③、Cl2 H2 I2 Fe
④、H3PO4 HNO3 HCl H2SO4
⑤、空气 N2 H2O CuSO4·H2O
⑥、Cu Au Pt NaKClO3Na2CO3 Fe HCl空气 Na2、完成下列转化关系,并指出各物质的类别和反应类型?Ca CaO Ca(OH)2 CaCO3 CCO2 H2CO3 CaCO3 金属 碱性氧化物 碱 盐 非金属 酸性氧化物 酸 盐 碱性氧化物都是金属氧化物,但金属氧化物不一定都是碱性氧化物 。酸性氧化物不一定都是非金属氧化物,非金属氧化物也不一定都是酸性氧化物。①②③④⑤⑥3. 请从下列每组中挑出1个与另外3个属于不同“分类”的物质,并说明挑选的依据:
(1)CO、CO2、SO2、P2O5
(2)S2-、I-、Fe、SO42-
(3) HCl、CO2、NH3、CaO
(4)蒸馏、分液、蒸发、中和P2O5
状态不同Fe是否带有电荷CaO
状态不同中和是否是物理变化还是化学变化 4.下列物质:①H2O ②NaCl ③H2SO4 ④Ca(OH)2 ⑤Fe2O3 ⑥FeSO4·7H2O ⑦HNO3 ⑧AgNO3 ⑨NaHCO3中,其中属于氧化物的是 ;属于碱的是 ;属于酸的是 ;属于盐的是 。(填写各物质的序号)①②④③⑦②⑥⑧⑨
