4.3 二氧化碳的实验室制法 课件(共33张PPT)
文档属性
| 名称 | 4.3 二氧化碳的实验室制法 课件(共33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-09 00:00:00 | ||
图片预览







文档简介
课件33张PPT。 二氧化碳的实验室制法生物体的呼吸作用可产生二氧化碳;
碳在氧气中燃烧生成二氧化碳;
蜡烛燃烧也可以生成二氧化碳;
煤气或天然气燃烧也可生成二氧化碳;
碳在高温下还原氧化铜可生成二氧化碳;
煅烧石灰石可生成二氧化碳。开动脑筋这些反应能否用于在实验室里制取少量纯净的CO2?提示:应考虑产生的气体是否纯净并易于收集,操作是否简便易行、安全,原料是否廉价易得,实验是否绿色环保等。请列举你所知道的哪些反应可以产生CO2?工业制法大理石和稀盐酸在常温下反应可产生二氧化碳;
大理石和稀硫酸在常温下反应可产生二氧化碳;
碳酸钠粉末与稀盐酸在常温下反应可产生二氧化碳;
碳酸钠粉末与稀硫酸在常温下反应可产生二氧化碳;常温下反应,不消耗能源;装置、操作简单;比较安全。碳酸钠粉末和稀硫酸
碳酸钠粉末和稀盐酸
CaCO3粉末和稀硫酸
CaCO3粉末和稀盐酸
反应速度太快,不利于气体的收集。反应速度太快,不利于气体的收集。通过实验来选择具体药品!反应速度太快,不利于气体的收集。反应速度太快,不利于气体的收集。块状大理石(主要成分CaCO3)和稀硫酸
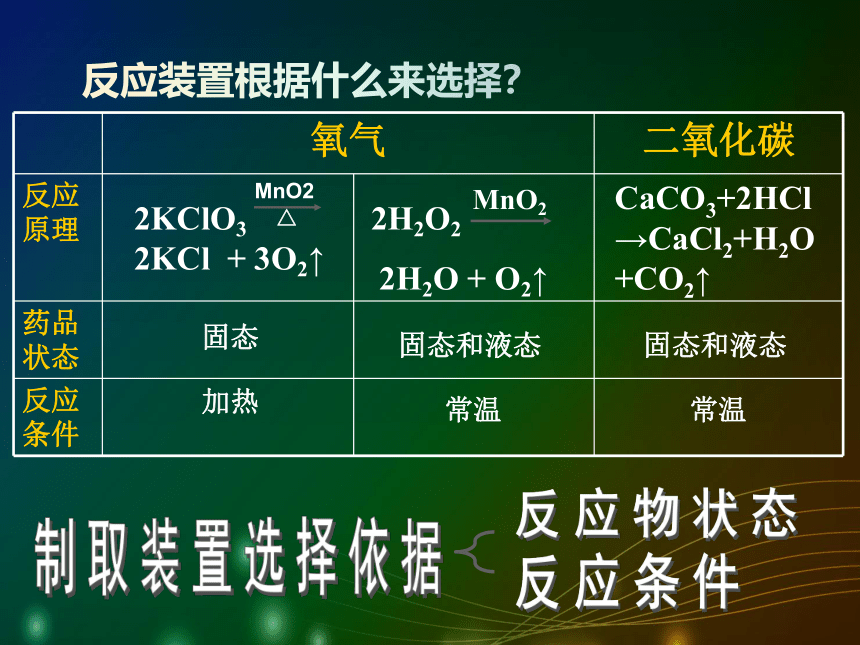
块状大理石(主要成分CaCO3)和稀盐酸
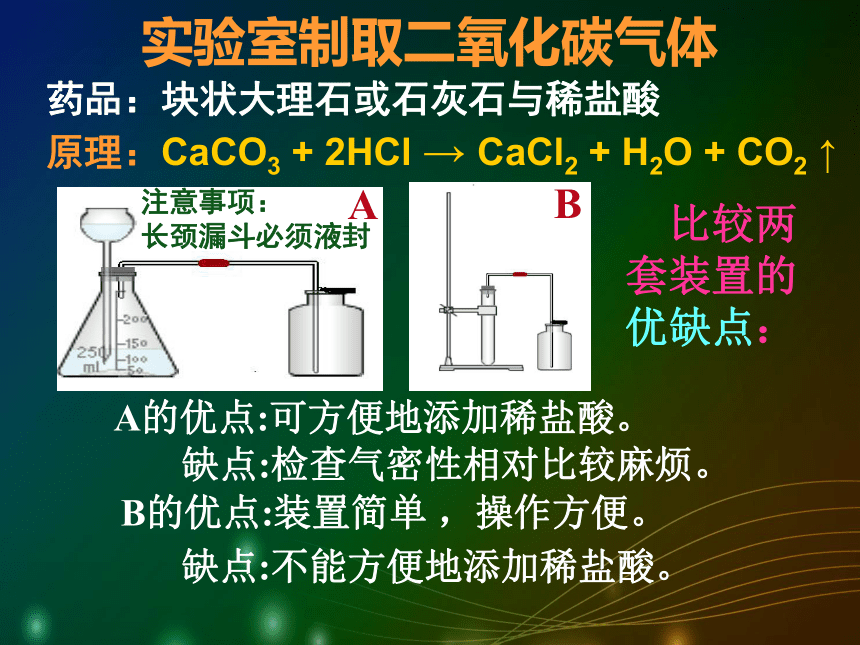
两者反应生成的硫酸钙是微溶物,覆盖在石灰石表面,阻止反应的进一步进行。产生气泡速率比较适中,适合实验室制取二氧化碳气体。实验室制取二氧化碳气体原理:CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑药品:块状大理石或石灰石与稀盐酸 实验仪器又该如何选择呢?反应装置根据什么来选择?CaCO3+2HCl→CaCl2+H2O+CO2↑ 反应物状态反应条件实验室制取二氧化碳气体原理:CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑注意事项:
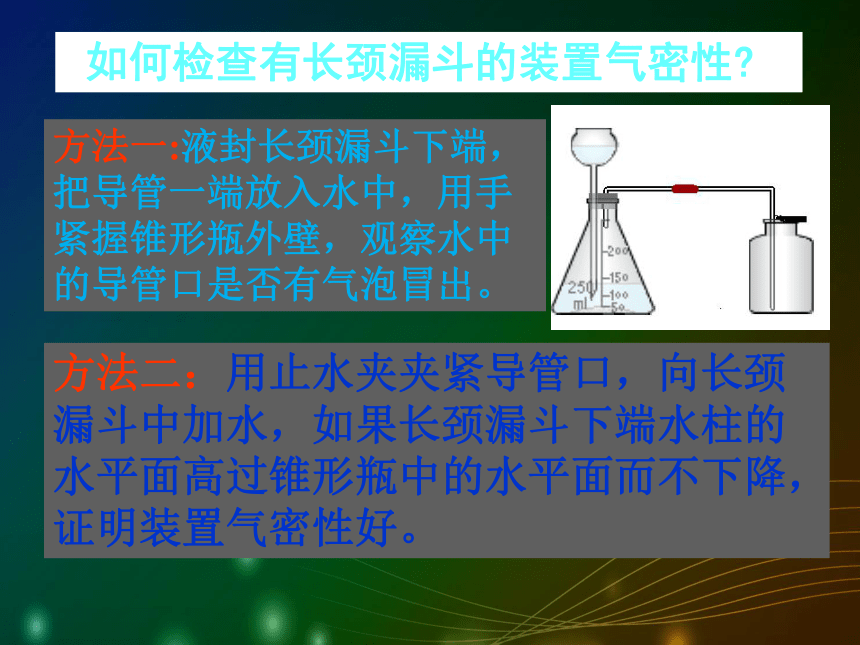
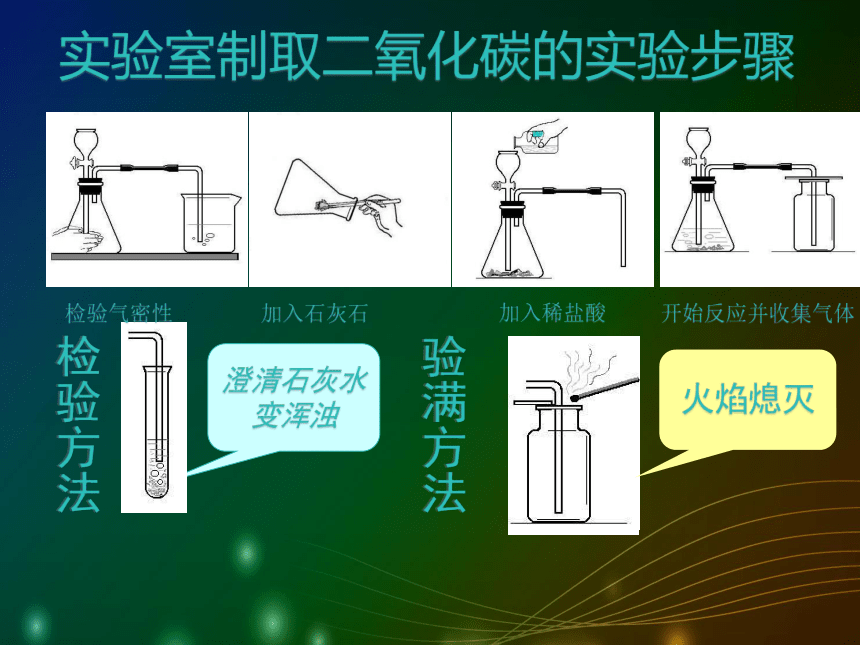
长颈漏斗必须液封AB 比较两套装置的优缺点:A的优点:可方便地添加稀盐酸。缺点:检查气密性相对比较麻烦。B的优点:装置简单 ,操作方便。药品:块状大理石或石灰石与稀盐酸 缺点:不能方便地添加稀盐酸。 如何检查有长颈漏斗的装置气密性?方法一:液封长颈漏斗下端,把导管一端放入水中,用手紧握锥形瓶外壁,观察水中的导管口是否有气泡冒出。方法二:用止水夹夹紧导管口,向长颈漏斗中加水,如果长颈漏斗下端水柱的水平面高过锥形瓶中的水平面而不下降,证明装置气密性好。检验方法澄清石灰水
变浑浊验满方法实验室制取二氧化碳的实验步骤火焰熄灭检验气密性
加入石灰石
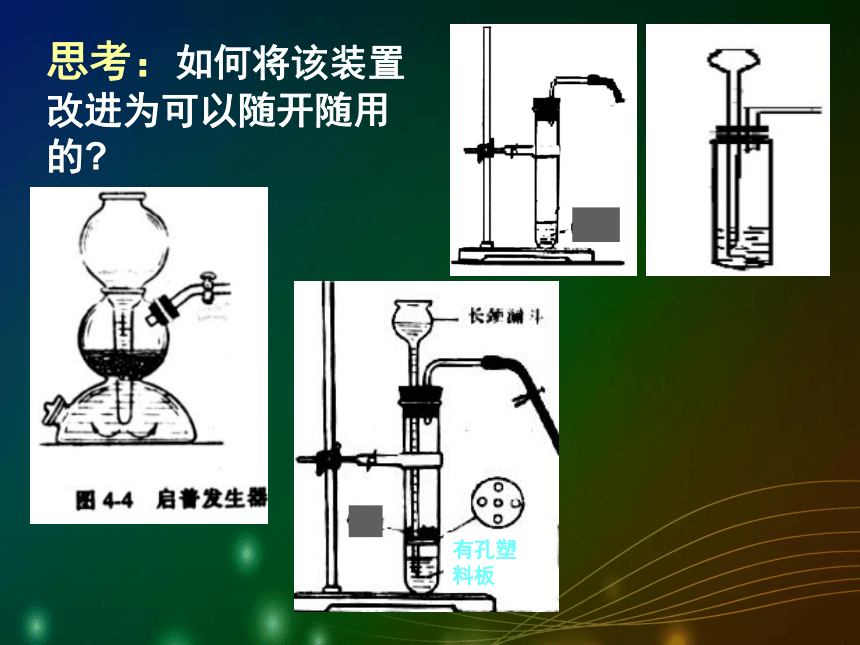
加入稀盐酸开始反应并收集气体小结二氧化碳实验室制法1)药品选择2)反应原理3)装置选择4)收集方法6)验满方法5)检验方法(石灰石和稀盐酸)(固液常温型)(向上排空气法)(澄清石灰水变浑)(燃着的木条放瓶口,木条熄灭)CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑思考:如何将该装置改进为可以随开随用的?有孔塑料板实验室里制取二氧化碳的简易装置启普发生器容器球形漏斗导气管注意事项 右图四组装置能起到与启普发生器相同效果的是_____B、D思考与讨论:1、下列是一些同学设计的实验室制二氧化碳的装置图,其中能用于实验室制取二氧化碳的有( )A E F课堂练习2、右图是某同学设计的实验室制取并收集 CO2 的装置图,请指出图中的错误,并改正。长颈漏斗应插到液面以下;1、错用了稀硫酸制取二氧化碳;
2、长颈漏斗没有液封;
3、发生装置内的导管过长;
4、集气瓶内导管太短。错误:改正:稀硫酸石灰石改用稀盐酸制取二氧化碳;集气瓶内导管伸入底部。(或接近底部。)导管应稍伸出橡皮塞少许;3、小明在实验室学习制取CO2,具体操作如下:
⑴组装仪器后,进行了装置气密性的检查,见图A,请你帮他判断一下,该装置是否漏气 ?
⑵他从稀H2SO4、稀HCl中选择了一种酸,与石灰石反应制CO2。想一想他不选另一种酸的原因是什么?
⑶小明想用图B装置来制取CO2,你认为是否理想? 4、某同学用废试管(试管底部有一小裂口)等仪器设计了一套制取气体的简易发生装置(见下图)。当把盛有块状反应物的试管放入仪器a里的液体反应物中时,反应发生并产生气体,当把试管提离液面时反应即刻停止。⑴仪器a的名称是 。
⑵若用该装置制取CO2,则a中盛放的液体是 ,试管中应放入反应物是 。
⑶该装置的优点 。□烧杯稀盐酸CaCO3可以随时使反应发生或停止。 5、实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷气体,已知甲烷的密度比空气小,难溶于水,则制取并收集甲烷的实验装置?ABCDE答 案:
A和C、A和E 6、如果用浓盐酸代替稀盐酸与石灰石反应制取CO2行不行?为什么?答:不行。因为浓盐酸易挥发,使制得的CO2气体中含有较多的氯化氢气体,导致CO2不纯。 7、实验室为何不用碳酸钙粉末跟稀盐酸反应制取CO2?答: 碳酸钙粉末跟稀盐酸反应的速度太快,不利于收集,因此不用于实验室制取CO2气体。答:不能用。因为生成微溶于水的硫酸钙,附着在石灰石的表面,使它不能接触到稀硫酸,阻止反应继续进行。 8、可否用硫酸代替盐酸与石灰石反应制CO2?为什么?(1)长颈漏斗管口没有伸入液面下;会导致CO2从长颈漏斗逸出。(2)发生装置内的导管管口不应伸入液面下;这样CO2会把酸液压出,无法收集到CO2 。发生装置内的导管口应略伸出橡皮塞一点。(3)不应用向下排空气法收集CO2; 这样CO2会从瓶口逸出。应改用直形导管、用向上排空气法收集并且导管插到接近集气瓶底部。9、此实验室制取二氧化碳的装置图有哪些错误?为什么?请改正?12312、根据下图所示实验装置进行回答(1)实验室用KClO3制O2的发生装置选____,收集装置选_____;
(2)实验室制取氢气的发生装置可选____,收集装置可选____;
(3)实验室制取CO2的发生装置可选____,收集装置可选___.
(4)实验室可用氧化钙(固)与浓氨水反应制备氨气,已知氨气 易溶于水,密度比空气小。则制备氨气的发生装置可选_____收集
装置可选_____。AC、EBD、EBCBD13、如下图所示,反应前天平平衡,取下此装置(装置气密性良好)将其倾斜,使稀盐酸与大理石接触,待充分反应后,气球膨胀,再将装置放回天平左盘,天平的指针向右偏转。这一现象是否符合质量守恒定律?为什么?请写出有关反应的化学方程式。 14、实验室利用石灰石和足量的稀盐酸反应制取二氧化碳,若要制取66.0g二氧化碳,至少需要含杂质20%(杂质不与盐酸反应)的石灰石多少克? 15、某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下: ⑴哪几项反应中盐酸有剩余______________;
⑵上表中m的数值是____________;
⑶试计算这种石灰石矿中碳酸钙的质量分数。 16、小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应),请计算:
⑴8g 石灰石样品中含有杂质多少克?
⑵样品中碳酸钙的质量分数是多少?
⑶下表中m的数值应为多少?
⑷要得到280Kg的CaO,需纯度为80%的石灰石多少千克? 发生装置特点1、固体与固体反应,并需要加热
简称固固加热型2、固体与液体反应,不需要加热
简称固液不加热型复习回顾: 收集方法:排水法向上排空气法向下排空气法难溶或微溶于水且不与水反应的气体密度大于空气且不与空气反应的气体密度小于空气且不与空气反应的气体如:O2、H2、CO如:O2、CO2如:H2收集装置的选择反应在常温下进行气体需导出反应前固体与液体分离气体密度比空气大气体能溶于水固体与液体反应实验室里制取二氧化碳的装置选择实验室里制取二氧化碳的简易装置
碳在氧气中燃烧生成二氧化碳;
蜡烛燃烧也可以生成二氧化碳;
煤气或天然气燃烧也可生成二氧化碳;
碳在高温下还原氧化铜可生成二氧化碳;
煅烧石灰石可生成二氧化碳。开动脑筋这些反应能否用于在实验室里制取少量纯净的CO2?提示:应考虑产生的气体是否纯净并易于收集,操作是否简便易行、安全,原料是否廉价易得,实验是否绿色环保等。请列举你所知道的哪些反应可以产生CO2?工业制法大理石和稀盐酸在常温下反应可产生二氧化碳;
大理石和稀硫酸在常温下反应可产生二氧化碳;
碳酸钠粉末与稀盐酸在常温下反应可产生二氧化碳;
碳酸钠粉末与稀硫酸在常温下反应可产生二氧化碳;常温下反应,不消耗能源;装置、操作简单;比较安全。碳酸钠粉末和稀硫酸
碳酸钠粉末和稀盐酸
CaCO3粉末和稀硫酸
CaCO3粉末和稀盐酸
反应速度太快,不利于气体的收集。反应速度太快,不利于气体的收集。通过实验来选择具体药品!反应速度太快,不利于气体的收集。反应速度太快,不利于气体的收集。块状大理石(主要成分CaCO3)和稀硫酸
块状大理石(主要成分CaCO3)和稀盐酸
两者反应生成的硫酸钙是微溶物,覆盖在石灰石表面,阻止反应的进一步进行。产生气泡速率比较适中,适合实验室制取二氧化碳气体。实验室制取二氧化碳气体原理:CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑药品:块状大理石或石灰石与稀盐酸 实验仪器又该如何选择呢?反应装置根据什么来选择?CaCO3+2HCl→CaCl2+H2O+CO2↑ 反应物状态反应条件实验室制取二氧化碳气体原理:CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑注意事项:
长颈漏斗必须液封AB 比较两套装置的优缺点:A的优点:可方便地添加稀盐酸。缺点:检查气密性相对比较麻烦。B的优点:装置简单 ,操作方便。药品:块状大理石或石灰石与稀盐酸 缺点:不能方便地添加稀盐酸。 如何检查有长颈漏斗的装置气密性?方法一:液封长颈漏斗下端,把导管一端放入水中,用手紧握锥形瓶外壁,观察水中的导管口是否有气泡冒出。方法二:用止水夹夹紧导管口,向长颈漏斗中加水,如果长颈漏斗下端水柱的水平面高过锥形瓶中的水平面而不下降,证明装置气密性好。检验方法澄清石灰水
变浑浊验满方法实验室制取二氧化碳的实验步骤火焰熄灭检验气密性
加入石灰石
加入稀盐酸开始反应并收集气体小结二氧化碳实验室制法1)药品选择2)反应原理3)装置选择4)收集方法6)验满方法5)检验方法(石灰石和稀盐酸)(固液常温型)(向上排空气法)(澄清石灰水变浑)(燃着的木条放瓶口,木条熄灭)CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑思考:如何将该装置改进为可以随开随用的?有孔塑料板实验室里制取二氧化碳的简易装置启普发生器容器球形漏斗导气管注意事项 右图四组装置能起到与启普发生器相同效果的是_____B、D思考与讨论:1、下列是一些同学设计的实验室制二氧化碳的装置图,其中能用于实验室制取二氧化碳的有( )A E F课堂练习2、右图是某同学设计的实验室制取并收集 CO2 的装置图,请指出图中的错误,并改正。长颈漏斗应插到液面以下;1、错用了稀硫酸制取二氧化碳;
2、长颈漏斗没有液封;
3、发生装置内的导管过长;
4、集气瓶内导管太短。错误:改正:稀硫酸石灰石改用稀盐酸制取二氧化碳;集气瓶内导管伸入底部。(或接近底部。)导管应稍伸出橡皮塞少许;3、小明在实验室学习制取CO2,具体操作如下:
⑴组装仪器后,进行了装置气密性的检查,见图A,请你帮他判断一下,该装置是否漏气 ?
⑵他从稀H2SO4、稀HCl中选择了一种酸,与石灰石反应制CO2。想一想他不选另一种酸的原因是什么?
⑶小明想用图B装置来制取CO2,你认为是否理想? 4、某同学用废试管(试管底部有一小裂口)等仪器设计了一套制取气体的简易发生装置(见下图)。当把盛有块状反应物的试管放入仪器a里的液体反应物中时,反应发生并产生气体,当把试管提离液面时反应即刻停止。⑴仪器a的名称是 。
⑵若用该装置制取CO2,则a中盛放的液体是 ,试管中应放入反应物是 。
⑶该装置的优点 。□烧杯稀盐酸CaCO3可以随时使反应发生或停止。 5、实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷气体,已知甲烷的密度比空气小,难溶于水,则制取并收集甲烷的实验装置?ABCDE答 案:
A和C、A和E 6、如果用浓盐酸代替稀盐酸与石灰石反应制取CO2行不行?为什么?答:不行。因为浓盐酸易挥发,使制得的CO2气体中含有较多的氯化氢气体,导致CO2不纯。 7、实验室为何不用碳酸钙粉末跟稀盐酸反应制取CO2?答: 碳酸钙粉末跟稀盐酸反应的速度太快,不利于收集,因此不用于实验室制取CO2气体。答:不能用。因为生成微溶于水的硫酸钙,附着在石灰石的表面,使它不能接触到稀硫酸,阻止反应继续进行。 8、可否用硫酸代替盐酸与石灰石反应制CO2?为什么?(1)长颈漏斗管口没有伸入液面下;会导致CO2从长颈漏斗逸出。(2)发生装置内的导管管口不应伸入液面下;这样CO2会把酸液压出,无法收集到CO2 。发生装置内的导管口应略伸出橡皮塞一点。(3)不应用向下排空气法收集CO2; 这样CO2会从瓶口逸出。应改用直形导管、用向上排空气法收集并且导管插到接近集气瓶底部。9、此实验室制取二氧化碳的装置图有哪些错误?为什么?请改正?12312、根据下图所示实验装置进行回答(1)实验室用KClO3制O2的发生装置选____,收集装置选_____;
(2)实验室制取氢气的发生装置可选____,收集装置可选____;
(3)实验室制取CO2的发生装置可选____,收集装置可选___.
(4)实验室可用氧化钙(固)与浓氨水反应制备氨气,已知氨气 易溶于水,密度比空气小。则制备氨气的发生装置可选_____收集
装置可选_____。AC、EBD、EBCBD13、如下图所示,反应前天平平衡,取下此装置(装置气密性良好)将其倾斜,使稀盐酸与大理石接触,待充分反应后,气球膨胀,再将装置放回天平左盘,天平的指针向右偏转。这一现象是否符合质量守恒定律?为什么?请写出有关反应的化学方程式。 14、实验室利用石灰石和足量的稀盐酸反应制取二氧化碳,若要制取66.0g二氧化碳,至少需要含杂质20%(杂质不与盐酸反应)的石灰石多少克? 15、某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下: ⑴哪几项反应中盐酸有剩余______________;
⑵上表中m的数值是____________;
⑶试计算这种石灰石矿中碳酸钙的质量分数。 16、小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应),请计算:
⑴8g 石灰石样品中含有杂质多少克?
⑵样品中碳酸钙的质量分数是多少?
⑶下表中m的数值应为多少?
⑷要得到280Kg的CaO,需纯度为80%的石灰石多少千克? 发生装置特点1、固体与固体反应,并需要加热
简称固固加热型2、固体与液体反应,不需要加热
简称固液不加热型复习回顾: 收集方法:排水法向上排空气法向下排空气法难溶或微溶于水且不与水反应的气体密度大于空气且不与空气反应的气体密度小于空气且不与空气反应的气体如:O2、H2、CO如:O2、CO2如:H2收集装置的选择反应在常温下进行气体需导出反应前固体与液体分离气体密度比空气大气体能溶于水固体与液体反应实验室里制取二氧化碳的装置选择实验室里制取二氧化碳的简易装置
