5.2 酸和碱的性质研究 基础练习(含答案)
文档属性
| 名称 | 5.2 酸和碱的性质研究 基础练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 82.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-09 16:35:35 | ||
图片预览



文档简介
沪教版第5章《初识酸和碱》5.2酸和碱的性质研究
一、选择题:
1、为延缓袋装食品变质,包装时不宜采用( )
A、充入氧气 B、真空包装
C、放入一小包铁粉 D、充入氮气
2、某外控型食品保鲜剂以淀粉,二氧化硅(SiO2)为载体,吸附酒精制作而成。保鲜原理是酒精缓慢挥发,在食品周围形成一定浓度的气体保护层,其中硅元素的相关信息如图所示,下列说法不正确的是( )
A.该保鲜剂属于混合物,且不能与明火接触
B.酒精挥发时分子体积变大
C.SiO2中的Si的化合价为+4
D.硅原子的核外有14个电子
3、下列食品包装措施中,不能有效防止食品变质的是( )
A、填充氮气 B、填充空气
C、填充氧气 D、抽成真空
4、某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成。保鲜原理是酒精缓缓挥发,在食品周围形成一定浓度的气体保护层。下列说法错误的是( )
A.二氧化硅是一种氧化物
B.起保鲜作用的物质是酒精
C.酒精挥发时分子体积变大
D.该保鲜剂不能与明火按触
5、把生石灰、二氧化硫、食盐分别溶于水,在所得溶液中分别滴入紫色石蕊试液,溶液的颜色变化依次是( )
A、紫色、蓝色、红色
B、蓝色、红色、无色
C、蓝色、红色、紫色
D、红色、蓝色、紫色
6、购买的袋装食品中.常夹有一包白色干燥剂,主要成分可能是( )
A、生石灰 B、食盐
C、无水硫酸铜 D、碳酸钙
7、大致测定某溶液是酸性还是碱性,要采取( )
①石蕊试液 ②酚酞试液 ③石蕊试纸 ④pH试纸.
A、只有①② B、只有①②③
C、只有①④ D、以上都可以
8、小良同学自制了一种黄色的花汁作指示剂,将花汁加入到不同的试剂中,观察到的现象如下表
试剂
稀盐酸
食醋
氢氧化钠溶液
食盐水
蒸馏水
草木灰水?
颜色
红
红
绿
黄
黄
绿?
小良又用花汁测知家中花盆土壤显酸性,你认为可加入上表中的( )来改良花盆里的土壤.
A.食醋 B.食盐水 C.蒸馏水 D.草木灰水
9、下列整理的与化学有关的知识不完全正确的一组是( )
A
净化水的方法
C
微粒的性质
明矾-混凝剂 活性炭-消毒剂
空气易被压缩-微粒间有空隙 酒香不怕巷子深-微粒是运动的
B
日常物质的区别
D
食品保鲜的办法
硬水和软水-加肥皂水并搅拌 酱油和醋-闻气味
固体二氧化碳--冷藏保鲜 食品包装袋充入氮气--防腐
A.A B.B C.C D.D
10、小林同学发现月饼包装袋中有一小包“双吸剂”用来为月饼保鲜。根据所学知识判断这包“双吸剂”是为了除去( )
A.氧气与氮气 B.氮气与二氧化碳
C.二氧化碳与水蒸气 D.氧气与水蒸气
11、小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭.他猜想这包脱氧剂中可能含有①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe其中猜想合理的是( )
A.①③⑤ B.②④⑤ C.④⑤ D.②⑤
12、科研人员已开发出一种高效的水果长期保鲜技术。在3℃、多湿条件下通过低压水银灯的照射引起光化学反应,使水果贮存过程中释放出的乙烯(C2H4,它能催熟水果)转变为乙醇(C2H6O)。下列说法正确的是( )
A.光化学反应中乙烯是催化剂
B.乙烯和水发生光化学反应生成乙醇
C.乙烯与氧气发生光化学反应生成乙醇
D.低压水银灯仅起照明作用
答案:
1
2
3
4
5
6
7
8
9
10
A
B
C
C
C
A
C
D
A
D
11
12
13
14
15
16
17
18
19
20
D
B
二、填空题:
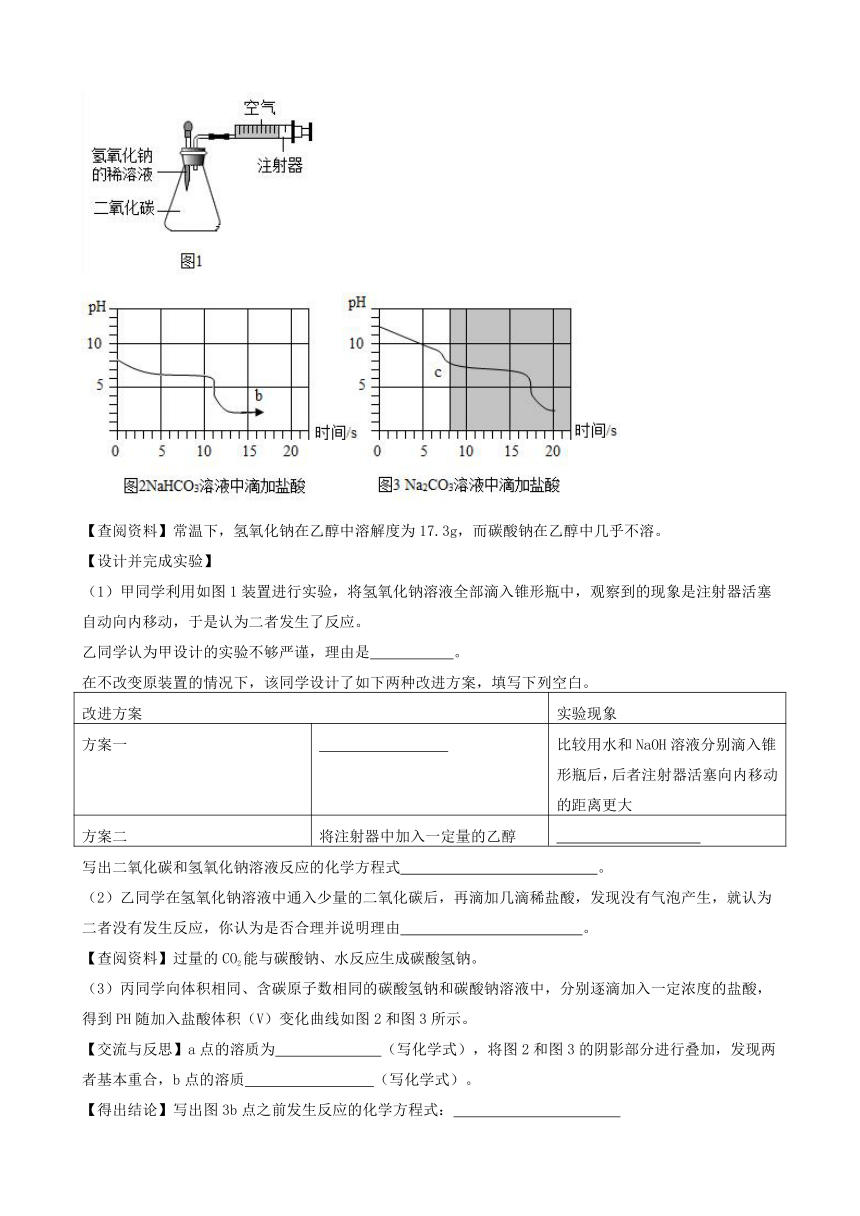
1、某研究性学习小组为探究“氢氧化钠溶液和二氧化碳是否发生反应”,开展了如下活动。
【查阅资料】常温下,氢氧化钠在乙醇中溶解度为17.3g,而碳酸钠在乙醇中几乎不溶。
【设计并完成实验】
(1)甲同学利用如图1装置进行实验,将氢氧化钠溶液全部滴入锥形瓶中,观察到的现象是注射器活塞自动向内移动,于是认为二者发生了反应。
乙同学认为甲设计的实验不够严谨,理由是 。
在不改变原装置的情况下,该同学设计了如下两种改进方案,填写下列空白。
改进方案
实验现象
方案一
比较用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大
方案二
将注射器中加入一定量的乙醇
写出二氧化碳和氢氧化钠溶液反应的化学方程式 。
(2)乙同学在氢氧化钠溶液中通入少量的二氧化碳后,再滴加几滴稀盐酸,发现没有气泡产生,就认为二者没有发生反应,你认为是否合理并说明理由 。
【查阅资料】过量的CO2能与碳酸钠、水反应生成碳酸氢钠。
(3)丙同学向体积相同、含碳原子数相同的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到PH随加入盐酸体积(V)变化曲线如图2和图3所示。
【交流与反思】a点的溶质为 (写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,b点的溶质 (写化学式)。
【得出结论】写出图3b点之前发生反应的化学方程式:
答案:
解:【设计并完成实验】 (1)乙同学认为甲设计的实验不够严谨,理由是二氧化碳溶于水后也能够导致注射器活塞自动向内移动。 故填:二氧化碳溶于水后也能够导致注射器活塞自动向内移动。 先后将等体积的水、氢氧化钠溶液全部滴入锥形瓶中,观察注射器活塞自动向内移动的幅度大小,用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大,说明二氧化碳能和氢氧化钠反应; 将注射器中加入一定量的乙醇,液体分层,说明反应生成了碳酸钠,实验过程如下所示:
?改进方案
?实验现象
?方案一
先后将等体积的水、氢氧化钠溶液全部滴入锥形瓶中,观察注射器活塞自动向内移动的幅度大小
比较用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大
?方案二
?将注射器中加入一定量的乙醇
液体分层
二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O。 故填:2NaOH+CO2═Na2CO3+H2O。 (2)乙同学在氢氧化钠溶液中通入少量的二氧化碳后,再滴加几滴稀盐酸,发现没有气泡产生,就认为二者没有发生反应,这种认为不合理,这是因为如果滴加的盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡。 故填:不合理,这是因为如果滴加的盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡。 (3)【交流与反思】 碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,a点pH小于7,溶液显酸性,说明盐酸过量,因此a点的溶质为NaCl、HCl; 将图2和图3的阴影部分进行叠加,发现两者基本重合,说明碳酸钠和盐酸反应时,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,因此b点的溶质是NaCl、NaHCO3。 故填:NaCl、HCl;NaCl、NaHCO3。
【得出结论】 图3b点之前发生的反应是酸钠和盐酸反应生成碳酸氢钠和氯化钠,反应的化学方程式为:Na2CO3+HCl=NaHCO3+NaCl。 故填:Na2CO3+HCl=NaHCO3+NaCl。
2、小杨往NaOH溶液中滴加稀盐酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
【实验一】
(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由 色变为无色,该反应的化学方程式为 。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到 现象,证明了滴加的稀硫酸过量。
【实验二】按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是 。
【拓展延伸】CO2通入NaOH溶液中也无明显现象,CO2与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
【查阅资料】常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
溶质
溶解性
溶剂
氢氧化钠
碳酸钠
水
极易溶
易溶
乙醇
易溶
微溶
【实验三】
小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三图所示(装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。
【温馨提示】CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
(1)把注射器I中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是 。
写出该反应的化学方程式 。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管c端往三口烧瓶中鼓入N2,目的是 。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器II中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从 角度证明了CO2与NaOH溶液发生了反应。
【总结归纳】对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。
答案:
解:【实验一】(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由红色变为无色,因为氢氧化钠和硫酸反应生成硫酸钠和水,配平即可;故答案为:无色变红色,又由红;2NaOH+H2SO4═Na2SO4+2H2O; (2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到过一会儿后溶液才变成红色的现象,证明了滴加的稀硫酸过量;故答案为:过一会儿后溶液才变成红色; 【实验二】把氢氧化钠溶液、稀盐酸混合在一起,然后滴加CuSO4溶液,没有蓝色沉淀生成,说明氢氧化钠和盐酸发生了反应,因此丙是CuSO4溶液;故答案为:CuSO4溶液; 【实验三】(1)把注射器Ⅰ中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是:生成白色沉淀、气球逐渐变大;因为二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠在酒精中微溶;故答案为:生成白色沉淀、气球逐渐变大;CO2+2NaOH=Na2CO3↓+H2O; (2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是排出装置内的二氧化碳;此实验从生成物角度证明了CO2与NaOH溶液发生了反应;故答案为:排出装置内的二氧化碳;生成物;
3、化学兴趣小组的同学在探究碱的化学性质时,完成了如图甲所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
(1)A实验中发生反应化学方程式为___.
(2)B实验中发生反应的现象是___,反应的化学方程式为___
【提出问题】废液中,能使酚酞溶液变红的物质可能是哪些呢?
【作出猜想】
猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是___;
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和氢氧化钙。
【实验验证】同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图乙所示的图象。
【结论】分析图象数据得出,废液中使酚酞溶液变红的物质一定是___和___,一定不是___.
【拓展提高】为了使以上废液实现安全排放,你的做法是:___.
答案:
解:(1)A实验中,氢氧化钠和稀盐酸反应生成氯化钠和水,发生反应化学方程式为:NaOH+HCl═NaCl+H2O。 故填:NaOH+HCl═NaCl+H2O。 (2)B实验中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,发生反应的现象是产生白色沉淀,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 故填:产生白色沉淀;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 【作出猜想】 猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠; 猜想二:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和碳酸钠; 猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和氢氧化钙。 故填:氢氧化钠和碳酸钠。 【结论】 分析图象数据得出,加入稀盐酸时先和氢氧化钠反应,氢氧化钠完全反应后,产生气体,说明溶液中含有碳酸钠,溶液中含有碳酸钠时一定不含有氢氧化钙,这是因为碳酸钠和氢氧化钙不能共存,因此废液中使酚酞溶液变红的物质一定是氢氧化钠和碳酸钠,一定不是氢氧化钙。 故填:氢氧化钠;碳酸钠;氢氧化钙。 【拓展提高】 为了使以上废液实现安全排放,做法是:加入适量稀盐酸至溶液刚好变成无色,因为此时稀盐酸恰好和氢氧化钠、碳酸钠完全反应。 故填:加入适量稀盐酸至溶液刚好变成无色。
4、某兴趣小组以“稀硫酸与氢氧化纳溶液能否发生反应”为课题进行了科学探究。如图中A所示,小组同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会儿后发现忘记了滴加指示剂,因此,他们停止滴加稀硫酸,并对烧杯内稀硫酸与氢氧化钠溶液是否发生了反应进行探究。 (1)小组同学设计了以下实验方案
实验步骤
实验现象
实验结论
在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH.
?pH (填“>”“<“)7
稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了。
(2)写出该反应的化学方程式: 。该组某同学认为,使用pH试纸之前,应该先用水润湿,效果会更好,你认为他的观点是否正确。 (填“正确“或“不正确”)
(3)同学们经过讨论致认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组继续实验。 甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。 【实验操作及现象】 如图B,向a试管中滴加足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现蓝色沉淀。 【实验结论】 通过以上实验操作及现象,你认为用CuSO4溶液 (填“可以”或“不可以”)?证明稀硫酸与氢氧化钠溶液能发生反应。 乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液能发生反应。 【实验操作及现象】 如图C,向b试管中滴加足量NaOH溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀。 【实验结论】 通过以上实验操作及现象,你认为用BaCl2溶液 (填“可以”或“不可以”)?证明稀硫酸与氢氧化钠溶液能发生反应,理由是 。
答案:
解:(1)硫酸过量则溶液显酸性,溶液的pH<7;故填:<; (2)氢氧化钠和稀硫酸反应生成硫酸钠和水,化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;使用pH试纸不能用水润湿,否则测定的pH不准确;故填:2NaOH+H2SO4═Na2SO4+2H2O;不正确; (3)【实验结论】氢氧根离子和铜离子反应会生成氢氧化铜沉淀,所以加入硫酸铜没有蓝色沉淀生成,说明溶液中不含氢氧根离子,可以证明稀硫酸与氢氧化钠溶液能发生反应;故填:可以; 【实验结论】硫酸和硫酸钠中的硫酸根离子均能与钡离子会生成硫酸钡沉淀,用BaCl2溶液不可以证明稀硫酸与氢氧化钠溶液能发生反应,故填:不可以;稀硫酸和硫酸钠都可以与氯化钡反应,生成硫酸钡白色沉淀。
5、在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
当滴入几滴酚酞试液后,溶液由无色变为? 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为:? 。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案
实验步骤
实验现象
实验结论
方案一
取样,滴入适量的氯化钡溶液
稀硫酸过量
方案二
取样,滴入几滴紫色石蕊试液
稀硫酸过量
上述设计的实验方案中,正确的是? (填“方案一”或“方案二”);
另外一个实验方案错误的原因是? 。
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是?,实验现象及结论是? 。
答案:
解:(1)酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O; (2)因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色,所以方案二正确,因为活泼金属与酸反应生成氢气,所以可以加入锌粒等活泼金属(或碳酸钠等),若有气体放出,证明稀硫酸过量,反之稀硫酸不过量; 故答案为(1)红;2NaOH+H2SO4=Na2SO4+2H2O; (2)方案一:出现白色沉淀; 方案二:溶液变红; 方案二;NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;锌粒(或碳酸钠等);若有气体放出,证明稀硫酸过量,反之稀硫酸不过量。
一、选择题:
1、为延缓袋装食品变质,包装时不宜采用( )
A、充入氧气 B、真空包装
C、放入一小包铁粉 D、充入氮气
2、某外控型食品保鲜剂以淀粉,二氧化硅(SiO2)为载体,吸附酒精制作而成。保鲜原理是酒精缓慢挥发,在食品周围形成一定浓度的气体保护层,其中硅元素的相关信息如图所示,下列说法不正确的是( )
A.该保鲜剂属于混合物,且不能与明火接触
B.酒精挥发时分子体积变大
C.SiO2中的Si的化合价为+4
D.硅原子的核外有14个电子
3、下列食品包装措施中,不能有效防止食品变质的是( )
A、填充氮气 B、填充空气
C、填充氧气 D、抽成真空
4、某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成。保鲜原理是酒精缓缓挥发,在食品周围形成一定浓度的气体保护层。下列说法错误的是( )
A.二氧化硅是一种氧化物
B.起保鲜作用的物质是酒精
C.酒精挥发时分子体积变大
D.该保鲜剂不能与明火按触
5、把生石灰、二氧化硫、食盐分别溶于水,在所得溶液中分别滴入紫色石蕊试液,溶液的颜色变化依次是( )
A、紫色、蓝色、红色
B、蓝色、红色、无色
C、蓝色、红色、紫色
D、红色、蓝色、紫色
6、购买的袋装食品中.常夹有一包白色干燥剂,主要成分可能是( )
A、生石灰 B、食盐
C、无水硫酸铜 D、碳酸钙
7、大致测定某溶液是酸性还是碱性,要采取( )
①石蕊试液 ②酚酞试液 ③石蕊试纸 ④pH试纸.
A、只有①② B、只有①②③
C、只有①④ D、以上都可以
8、小良同学自制了一种黄色的花汁作指示剂,将花汁加入到不同的试剂中,观察到的现象如下表
试剂
稀盐酸
食醋
氢氧化钠溶液
食盐水
蒸馏水
草木灰水?
颜色
红
红
绿
黄
黄
绿?
小良又用花汁测知家中花盆土壤显酸性,你认为可加入上表中的( )来改良花盆里的土壤.
A.食醋 B.食盐水 C.蒸馏水 D.草木灰水
9、下列整理的与化学有关的知识不完全正确的一组是( )
A
净化水的方法
C
微粒的性质
明矾-混凝剂 活性炭-消毒剂
空气易被压缩-微粒间有空隙 酒香不怕巷子深-微粒是运动的
B
日常物质的区别
D
食品保鲜的办法
硬水和软水-加肥皂水并搅拌 酱油和醋-闻气味
固体二氧化碳--冷藏保鲜 食品包装袋充入氮气--防腐
A.A B.B C.C D.D
10、小林同学发现月饼包装袋中有一小包“双吸剂”用来为月饼保鲜。根据所学知识判断这包“双吸剂”是为了除去( )
A.氧气与氮气 B.氮气与二氧化碳
C.二氧化碳与水蒸气 D.氧气与水蒸气
11、小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭.他猜想这包脱氧剂中可能含有①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe其中猜想合理的是( )
A.①③⑤ B.②④⑤ C.④⑤ D.②⑤
12、科研人员已开发出一种高效的水果长期保鲜技术。在3℃、多湿条件下通过低压水银灯的照射引起光化学反应,使水果贮存过程中释放出的乙烯(C2H4,它能催熟水果)转变为乙醇(C2H6O)。下列说法正确的是( )
A.光化学反应中乙烯是催化剂
B.乙烯和水发生光化学反应生成乙醇
C.乙烯与氧气发生光化学反应生成乙醇
D.低压水银灯仅起照明作用
答案:
1
2
3
4
5
6
7
8
9
10
A
B
C
C
C
A
C
D
A
D
11
12
13
14
15
16
17
18
19
20
D
B
二、填空题:
1、某研究性学习小组为探究“氢氧化钠溶液和二氧化碳是否发生反应”,开展了如下活动。
【查阅资料】常温下,氢氧化钠在乙醇中溶解度为17.3g,而碳酸钠在乙醇中几乎不溶。
【设计并完成实验】
(1)甲同学利用如图1装置进行实验,将氢氧化钠溶液全部滴入锥形瓶中,观察到的现象是注射器活塞自动向内移动,于是认为二者发生了反应。
乙同学认为甲设计的实验不够严谨,理由是 。
在不改变原装置的情况下,该同学设计了如下两种改进方案,填写下列空白。
改进方案
实验现象
方案一
比较用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大
方案二
将注射器中加入一定量的乙醇
写出二氧化碳和氢氧化钠溶液反应的化学方程式 。
(2)乙同学在氢氧化钠溶液中通入少量的二氧化碳后,再滴加几滴稀盐酸,发现没有气泡产生,就认为二者没有发生反应,你认为是否合理并说明理由 。
【查阅资料】过量的CO2能与碳酸钠、水反应生成碳酸氢钠。
(3)丙同学向体积相同、含碳原子数相同的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到PH随加入盐酸体积(V)变化曲线如图2和图3所示。
【交流与反思】a点的溶质为 (写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,b点的溶质 (写化学式)。
【得出结论】写出图3b点之前发生反应的化学方程式:
答案:
解:【设计并完成实验】 (1)乙同学认为甲设计的实验不够严谨,理由是二氧化碳溶于水后也能够导致注射器活塞自动向内移动。 故填:二氧化碳溶于水后也能够导致注射器活塞自动向内移动。 先后将等体积的水、氢氧化钠溶液全部滴入锥形瓶中,观察注射器活塞自动向内移动的幅度大小,用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大,说明二氧化碳能和氢氧化钠反应; 将注射器中加入一定量的乙醇,液体分层,说明反应生成了碳酸钠,实验过程如下所示:
?改进方案
?实验现象
?方案一
先后将等体积的水、氢氧化钠溶液全部滴入锥形瓶中,观察注射器活塞自动向内移动的幅度大小
比较用水和NaOH溶液分别滴入锥形瓶后,后者注射器活塞向内移动的距离更大
?方案二
?将注射器中加入一定量的乙醇
液体分层
二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O。 故填:2NaOH+CO2═Na2CO3+H2O。 (2)乙同学在氢氧化钠溶液中通入少量的二氧化碳后,再滴加几滴稀盐酸,发现没有气泡产生,就认为二者没有发生反应,这种认为不合理,这是因为如果滴加的盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡。 故填:不合理,这是因为如果滴加的盐酸不足以和氢氧化钠反应,即使溶液中含有碳酸钠,也不产生气泡。 (3)【交流与反思】 碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,a点pH小于7,溶液显酸性,说明盐酸过量,因此a点的溶质为NaCl、HCl; 将图2和图3的阴影部分进行叠加,发现两者基本重合,说明碳酸钠和盐酸反应时,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,因此b点的溶质是NaCl、NaHCO3。 故填:NaCl、HCl;NaCl、NaHCO3。
【得出结论】 图3b点之前发生的反应是酸钠和盐酸反应生成碳酸氢钠和氯化钠,反应的化学方程式为:Na2CO3+HCl=NaHCO3+NaCl。 故填:Na2CO3+HCl=NaHCO3+NaCl。
2、小杨往NaOH溶液中滴加稀盐酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
【实验一】
(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由 色变为无色,该反应的化学方程式为 。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到 现象,证明了滴加的稀硫酸过量。
【实验二】按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是 。
【拓展延伸】CO2通入NaOH溶液中也无明显现象,CO2与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
【查阅资料】常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
溶质
溶解性
溶剂
氢氧化钠
碳酸钠
水
极易溶
易溶
乙醇
易溶
微溶
【实验三】
小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三图所示(装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。
【温馨提示】CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
(1)把注射器I中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是 。
写出该反应的化学方程式 。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管c端往三口烧瓶中鼓入N2,目的是 。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器II中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从 角度证明了CO2与NaOH溶液发生了反应。
【总结归纳】对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。
答案:
解:【实验一】(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由红色变为无色,因为氢氧化钠和硫酸反应生成硫酸钠和水,配平即可;故答案为:无色变红色,又由红;2NaOH+H2SO4═Na2SO4+2H2O; (2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到过一会儿后溶液才变成红色的现象,证明了滴加的稀硫酸过量;故答案为:过一会儿后溶液才变成红色; 【实验二】把氢氧化钠溶液、稀盐酸混合在一起,然后滴加CuSO4溶液,没有蓝色沉淀生成,说明氢氧化钠和盐酸发生了反应,因此丙是CuSO4溶液;故答案为:CuSO4溶液; 【实验三】(1)把注射器Ⅰ中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是:生成白色沉淀、气球逐渐变大;因为二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠在酒精中微溶;故答案为:生成白色沉淀、气球逐渐变大;CO2+2NaOH=Na2CO3↓+H2O; (2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是排出装置内的二氧化碳;此实验从生成物角度证明了CO2与NaOH溶液发生了反应;故答案为:排出装置内的二氧化碳;生成物;
3、化学兴趣小组的同学在探究碱的化学性质时,完成了如图甲所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
(1)A实验中发生反应化学方程式为___.
(2)B实验中发生反应的现象是___,反应的化学方程式为___
【提出问题】废液中,能使酚酞溶液变红的物质可能是哪些呢?
【作出猜想】
猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是___;
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和氢氧化钙。
【实验验证】同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图乙所示的图象。
【结论】分析图象数据得出,废液中使酚酞溶液变红的物质一定是___和___,一定不是___.
【拓展提高】为了使以上废液实现安全排放,你的做法是:___.
答案:
解:(1)A实验中,氢氧化钠和稀盐酸反应生成氯化钠和水,发生反应化学方程式为:NaOH+HCl═NaCl+H2O。 故填:NaOH+HCl═NaCl+H2O。 (2)B实验中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,发生反应的现象是产生白色沉淀,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 故填:产生白色沉淀;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 【作出猜想】 猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠; 猜想二:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和碳酸钠; 猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钠和氢氧化钙。 故填:氢氧化钠和碳酸钠。 【结论】 分析图象数据得出,加入稀盐酸时先和氢氧化钠反应,氢氧化钠完全反应后,产生气体,说明溶液中含有碳酸钠,溶液中含有碳酸钠时一定不含有氢氧化钙,这是因为碳酸钠和氢氧化钙不能共存,因此废液中使酚酞溶液变红的物质一定是氢氧化钠和碳酸钠,一定不是氢氧化钙。 故填:氢氧化钠;碳酸钠;氢氧化钙。 【拓展提高】 为了使以上废液实现安全排放,做法是:加入适量稀盐酸至溶液刚好变成无色,因为此时稀盐酸恰好和氢氧化钠、碳酸钠完全反应。 故填:加入适量稀盐酸至溶液刚好变成无色。
4、某兴趣小组以“稀硫酸与氢氧化纳溶液能否发生反应”为课题进行了科学探究。如图中A所示,小组同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会儿后发现忘记了滴加指示剂,因此,他们停止滴加稀硫酸,并对烧杯内稀硫酸与氢氧化钠溶液是否发生了反应进行探究。 (1)小组同学设计了以下实验方案
实验步骤
实验现象
实验结论
在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH.
?pH (填“>”“<“)7
稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了。
(2)写出该反应的化学方程式: 。该组某同学认为,使用pH试纸之前,应该先用水润湿,效果会更好,你认为他的观点是否正确。 (填“正确“或“不正确”)
(3)同学们经过讨论致认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组继续实验。 甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。 【实验操作及现象】 如图B,向a试管中滴加足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现蓝色沉淀。 【实验结论】 通过以上实验操作及现象,你认为用CuSO4溶液 (填“可以”或“不可以”)?证明稀硫酸与氢氧化钠溶液能发生反应。 乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液能发生反应。 【实验操作及现象】 如图C,向b试管中滴加足量NaOH溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀。 【实验结论】 通过以上实验操作及现象,你认为用BaCl2溶液 (填“可以”或“不可以”)?证明稀硫酸与氢氧化钠溶液能发生反应,理由是 。
答案:
解:(1)硫酸过量则溶液显酸性,溶液的pH<7;故填:<; (2)氢氧化钠和稀硫酸反应生成硫酸钠和水,化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;使用pH试纸不能用水润湿,否则测定的pH不准确;故填:2NaOH+H2SO4═Na2SO4+2H2O;不正确; (3)【实验结论】氢氧根离子和铜离子反应会生成氢氧化铜沉淀,所以加入硫酸铜没有蓝色沉淀生成,说明溶液中不含氢氧根离子,可以证明稀硫酸与氢氧化钠溶液能发生反应;故填:可以; 【实验结论】硫酸和硫酸钠中的硫酸根离子均能与钡离子会生成硫酸钡沉淀,用BaCl2溶液不可以证明稀硫酸与氢氧化钠溶液能发生反应,故填:不可以;稀硫酸和硫酸钠都可以与氯化钡反应,生成硫酸钡白色沉淀。
5、在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
当滴入几滴酚酞试液后,溶液由无色变为? 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为:? 。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案
实验步骤
实验现象
实验结论
方案一
取样,滴入适量的氯化钡溶液
稀硫酸过量
方案二
取样,滴入几滴紫色石蕊试液
稀硫酸过量
上述设计的实验方案中,正确的是? (填“方案一”或“方案二”);
另外一个实验方案错误的原因是? 。
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是?,实验现象及结论是? 。
答案:
解:(1)酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O; (2)因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色,所以方案二正确,因为活泼金属与酸反应生成氢气,所以可以加入锌粒等活泼金属(或碳酸钠等),若有气体放出,证明稀硫酸过量,反之稀硫酸不过量; 故答案为(1)红;2NaOH+H2SO4=Na2SO4+2H2O; (2)方案一:出现白色沉淀; 方案二:溶液变红; 方案二;NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;锌粒(或碳酸钠等);若有气体放出,证明稀硫酸过量,反之稀硫酸不过量。
